Abrocitinib
Abrocitinib ist ein Januskinase (JAK)-Hemmer zur oralen Behandlung von atopischer Dermatitis (Neurodermitis). Es handelt sich neben Baricitinib (Olumiant) und Upadacitinib (Rinvoq) um den dritten Januskinase-Inhibitor, der speziell für die Behandlung von Neurodermitis zugelassen wurde.
Abrocitinib: Übersicht
Anwendung
Abrocitinib ist unter dem Namen Cibinqo von Pfizer indiziert für die orale Behandlung von mittelschwerer bis schwerer atopischer Dermatitis bei Erwachsenen, die für eine systemische Therapie infrage kommen.
Anwendungsart
Abrocitinib ist zur oralen Anwendung bestimmt und soll einmal täglich unabhängig von den Mahlzeiten ungefähr zur selben Tageszeit eingenommen werden. Die Einnahme zusammen mit einer Mahzeit kann eine Übelkeit verringern.
Wirkmechanismus
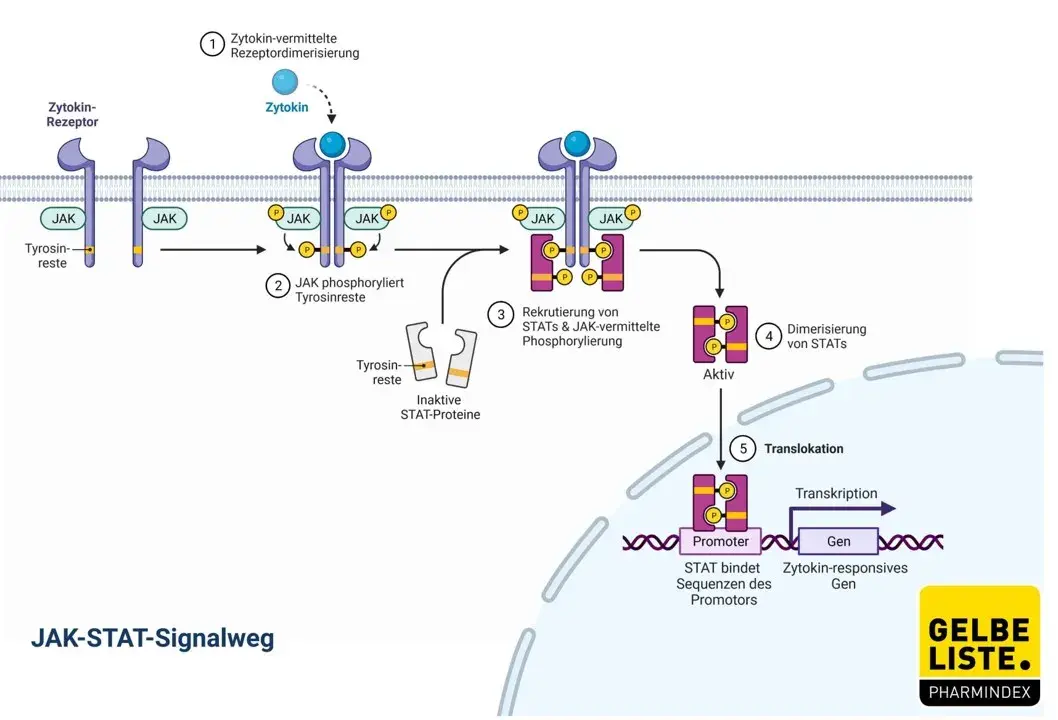
Abrocitinib ist ein oraler JAK1-selektiver Inhibitor, der mehrere wichtige Zytokin-Signalwege hemmt, von denen bekannt ist, dass sie eine wichtige Rolle bei den pathophysiologischen Eigenschaften der Neurodermitis spielen, darunter IL-4, IL-13, IL-31 und Interferon-γ.
Die Familie der Januskinasen (JAK) ist eine Gruppe von zytoplasmatischen Tyrosinkinasen, die Signalwege vermitteln, die durch verschiedene Zytokine aktiviert werden. Über die Beeinflussung des JAK-STAT-Signalwegs ist JAK1 an zahlreichen Vorgängen der Zellproliferation und -differenzierung beteiligt. JAKs phosphorylieren und aktivieren Signaltransduktoren und Aktivatoren der Transkription (STATs), die wiederum die intrazelluläre Aktivität, einschließlich der Genexpression, modulieren. Durch die Hemmung von JAK1 werden diese Signalwege moduliert, indem die Phosphorylierung und Aktivierung von STATs verhindert wird.
Pharmakokinetik
Resorption
- Abrocitinib mit einer oralen Resorption von über 91% resorbiert
- Die absolute orale Bioverfügbarkeit beträgt etwa 60%.
- Die Spitzenkonzentration im Plasma wird nach 1 Stunde erreicht.
- Steady-State-Plasmakonzentrationen werden innerhalb von 48 Stunden nach einmal täglicher Gabe erreicht.
- Sowohl die Cmax als auch die AUC steigen dosisproportional bis zu einer Dosis von 200 mg an.
- Die gleichzeitige Anwendung mit einer fettreichen Mahlzeit hat keine klinisch relevanten Auswirkungen auf die Abrocitinib-Exposition.
Verteilung
- Das Verteilungsvolumen von Abrocitinib beträgt nach intravenöser Infusion etwa 100 l.
- Jeweils etwa 64%, 37% bzw. 29% des zirkulierenden Abrocitinibs und seiner aktiven Metaboliten M1 und M2 werden an Plasmaproteine gebunden.
- Abrocitinib und seine aktiven Metaboliten verteilen sich zu gleichen Teilen auf Erythrozyten und Plasma.
Biotransformation
- In vitro wird die Metabolisierung von Abrocitinib durch verschiedene CYP-Enzyme vermittelt: CYP2C19 (ca. 53%), CYP2C9 (ca. 30%), CYP3A4 (ca. 11%) und CYP2B6 (ca. 6%).
- In einer Humanstudie mit radioaktiver Markierung war Abrocitinib die am häufigsten zirkulierende Spezies, wobei hauptsächlich drei polare monohydroxylierte Metaboliten als M1 (3-Hydroxypropyl), M2 (2-Hydroxypropyl) und M4 (Pyrrolidinon-Pyrimidin) identifiziert wurden.
- Im Steady-State sind M2 und M4 die Hauptmetaboliten und M1 ein Nebenmetabolit.
- Von den 3 zirkulierenden Metaboliten haben M1 und M2 ein ähnliches JAK-inhibitorisches Profil wie Abrocitinib, während M4 pharmakologisch inaktiv ist.
Elimination
- Die Eliminationshalbwertszeit von Abrocitinib beträgt etwa 5 Stunden.
- Abrocitinib wird hauptsächlich durch metabolische Clearance-Mechanismen eliminiert
- Weniger als 1% der Dosis werden als unveränderter Wirkstoff im Urin ausgeschieden.
- Die Metaboliten von Abrocitinib, M1, M2 und M4, werden überwiegend renal ausgeschieden und sind Substrate des OAT3-Transporters.
Dosierung
- Die empfohlene Anfangsdosis von Abrocitinib beträgt 200 mg einmal täglich.
- Eine Anfangsdosis von 100 mg einmal täglich wird bei Patienten ab einem Alter von 65 Jahren empfohlen.
- Während der Behandlung kann die Dosis je nach Verträglichkeit und Wirksamkeit verringert oder erhöht werden.
- Es sollte die niedrigste wirksame Dosis für die Erhaltungstherapie in Betracht gezogen werden. Die Tageshöchstdosis beträgt 200 mg.
Nebenwirkungen
Die am häufigsten unter der Therapie mit Abrocitinib gemeldeten Nebenwirkungen sind:
- Übelkeit (15,1%)
- Kopfschmerzen (7,9%)
- Akne (4,8%)
- Herpes simplex (4,2%)
- Kreatinphosphokinase im Blut erhöht (3,8%)
- Erbrechen (3,5%)
- Schwindelgefühl und (3,4%)
- Schmerzen Oberbauch (2,2%)
Die häufigsten schwerwiegenden Nebenwirkungen sind Infektionen (0,3%), weshalb Patienten während und nach der Behandlung mit Abrocitinib engmaschig auf Anzeichen und Symptome einer Infektion überwacht werden sollen.
Wechselwirkungen
Bei der Therapie mit Cibinqo sind folgende Wechselwirkungen zu beachten:
Mögliche Beeinflussung von Abrocitinib durch andere Arzneimittel
- Abrocitinib wird vorwiegend über die Enzyme CYP2C19 und CYP2C9 und in geringerem Maße über die Enzyme CYP3A4 und CYP2B6 metabolisiert.
- Die aktiven Metaboliten werden über die Nieren ausgeschieden und sind Substrate des organischen Anionentransporters 3 (OAT3).
- Arzneimittel, die Inhibitoren oder Induktoren dieser Enzyme und Transporter sind, könnten sich deshalb auf die Exposition gegenüber Abrocitinib und/oder seinen aktiven Metaboliten auswirken.
Gleichzeitige Anwendung mit CYP2C19/CYP2C9-Inhibitoren
- Wenn Abrocitinib zusammen mit Fluvoxamin (einem starken CYP2C19- und mittelstarken CYP3A-Inhibitor) oder Fluconazol (einem starken CYP2C19- und mittelstarken CYP2C9- und CYP3A-Inhibitor) gegeben wurde, erhöhte sich die Abrocitinib-Wirkstoffexposition um jeweils 91% bzw. 155% im Vergleich zu einer alleinigen Gabe
Gleichzeitige Anwendung mit CYP2C19/CYP2C9-Induktoren
- Eine Anwendung von 200 mg Abrocitinib nach mehreren Dosen Rifampicin, einem starken Induktor von CYP-Enzymen, führte zu einer Verringerung der Abrocitinib-Wirkstoffexposition um etwa 56%
Gleichzeitige Anwendung mit Arzneimitteln, die den pH-Wert im Magen erhöhen
- Die Resorption von Abrocitinib könnte aufgrund der verminderten Löslichkeit von Abrocitinib bei einem pH-Wert über 4 verringert sein.
Mögliche Beeinflussung anderer Arzneimittel durch Abrocitinib
- In vitro ist Abrocitinib ein Inhibitor des P-Glykoproteins (P-gp). Bei einer gleichzeitigen Anwendung von Dabigatranetexilat (ein P-gp-Substrat) mit einer Einzeldosis von 200 mg Abrocitinib erhöhten sich die AUCinf und Cmax von Dabigatran um etwa 53% bzw. 40% im Vergleich zur alleinigen Anwendung.
- Vorsicht ist geboten, da sich die Konzentration von P-gp-Substraten mit engem therapeutischen Index, wie z. B. Digoxin, erhöhen könnte.
- In vitro induziert Abrocitinib die Enzyme CYP2B6 und CYP1A2 und induziert und hemmt die CYP2C19-Enzyme.
- Die Exposition gegenüber Arzneimitteln, die über CYP2B6 (z. B. Bupropion, Efavirenz) und CYP1A2 (z. B. Alosetron, Duloxetin, Ramelteon, Tizanidin) verstoffwechselt werden, kann bei einer gleichzeitigen Anwendung mit Abrocitinib vermindert sein.
- Die Exposition gegenüber Arzneimitteln, die über CYP2C19 metabolisiert werden (z. B. S-Mephenytoin), kann sich zunächst erhöhen und dann verringern bei gleichzeitiger Anwendung von Abrocitinib.
Kontraindikationen
Abrocitinib darf weder in der Schwangerschaft noch in der Stillzeit angewendet werden. Darüber hinaus darf Abrocitinib nicht eingenommen werden bei:
- Überempfindlichkeit gegen den Wirkstoff oder einen der genannten sonstigen Bestandteile
- aktiven, schwerwiegenden systemischen Infektionen, einschließlich Tuberkulose
- schweren Leberfunktionsstörungen
Schwangerschaft
Abrocitinib ist während der Schwangerschaft kontraindiziert, da tierexperimentelle Studien eine Reproduktionstoxizität gezeigt haben: Bei trächtigen Ratten und Kaninchen zeigten sich unter Abrocitinib embryofetale Letalität und Skelettveränderungen bei den Feten. Bei Ratten gab es zudem Auswirkungen auf die Geburt und peri-/postnatale Entwicklung.
Stillzeit
Abrocitinib ist während der Stillzeit kontraindiziert, da der Wirkstoff in die Muttermilch ausgeschieden wird und ein Risiko für Neugeborene/Säuglinge nicht ausgeschlossen werden kann.
Verkehrstüchtigkeit
Die Anwendung von Abrocitinib hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Anwendungshinweise
- Bei Patienten, die mit Abrocitinib behandelt wurden, wurden schwerwiegende Infektionen berichtet. Die häufigsten schwerwiegenden Infektionen in klinischen Studien waren Herpes simplex, Herpes zoster und Pneumonie.
- Vor Beginn der Behandlung mit Abrocitinib sollten Patienten auf Tuberkulose getestet werden.
- Unter Abrocitinib ist eine Virusreaktivierung möglich, einschließlich Fälle der Reaktivierung von Herpes-Viren (z. B. Herpes zoster, Herpes simplex), weshalb vor Beginn und während der Therapie ein Screening auf eine Virushepatitis durchgeführt werden sollte.
- Die Anwendung von attenuierten Lebendimpfstoffen sollte während oder unmittelbar vor der Behandlung vermieden werden.
- Bei Patienten, die Abrocitinib erhielten, wurden tiefe Venenthrombosen (TVT) und Lungenembolien (LE) berichtet, weshalb Abrocitinib bei Patienten mit hohem Risiko für TVT/LE nur mit Vorsicht angewendet werden sollte. Faktoren, die bei der Beurteilung des TVT/LE-Risikos berücksichtigt werden sollten, sind höheres Alter, Adipositas, TVT/LE in der Vorgeschichte, prothrombotische Störung, Anwendung kombinierter hormoneller Kontrazeptiva oder Hormonersatztherapie und Patienten, die sich einem größeren chirurgischen Eingriff unterziehen oder für längere Zeit immobilisiert werden.
- Maligne Erkrankungen, einschließlich nicht-melanozytärer Hautkrebs (non-melanoma skin cancer, NMSC), wurden in klinischen Studien zu Abrocitinib beobachtet. Die klinischen Daten sind jedoch nicht ausreichend, um einen möglichen Zusammenhang zu beurteilen. Es laufen derzeit Evaluierungen zur Langzeit-Sicherheit.
- Bei Patienten mit einer Thrombozytenzahl von < 150 × 103/mm3, einer absoluten Lymphozytenzahl von < 0,5 × 103/mm3, einer absoluten Neutrophilenzahl von < 1,2 × 103/mm3 oder einem Hämoglobinwert von < 10 g/dl sollte eine Therapie mit Abrocitinib nicht begonnen werden.
- Es gibt Berichte zu dosisabhängigen Erhöhungen der Blutlipidwerte unter Abrocitinib, weshalb die Lipidparameter etwa 4 Wochen nach Beginn der Therapie und anschließend entsprechend dem Risiko des Patienten für kardiovaskuläre Erkrankungen überprüft werden sollten.
- Eine gleichzeitige Anwendung biologischer Immunmodulatoren, starken Immunsuppressiva wie z. B Ciclosporin, oder anderen Januskinase (JAK)-Inhibitoren mit Abrocitinib wird nicht empfohlen, da das Risiko für eine additive Immunsuppression nicht ausgeschlossen werden kann.
Alternativen
Neben Abrocitinib stehen noch die zwei weiteren Januskinase-Inibitoren Baricitinib (Olumiant) und Upadacitinib (Rinvoq) für die Behandlung der Neurodermitis zur Verfügung.
Wirkstoff-Informationen
- EMA: Fachinformation Cibinqo
- Gooderham MJ, Forman SB, Bissonnette R, Beebe JS, Zhang W, Banfield C, Zhu L, Papacharalambous J, Vincent MS, Peeva E. Efficacy and Safety of Oral Janus Kinase 1 Inhibitor Abrocitinib for Patients With Atopic Dermatitis: A Phase 2 Randomized Clinical Trial. JAMA Dermatol. 2019 Dec 1;155(12):1371-1379. doi: 10.1001/jamadermatol.2019.2855
- Szalus K, Trzeciak M, Nowicki RJ. JAK-STAT Inhibitors in Atopic Dermatitis from Pathogenesis to Clinical Trials Results. Microorganisms. 2020 Nov 6;8(11):1743. doi: 10.3390/microorganisms8111743
Abbildung
Created with Biorender
-
Cibinqo® 50 mg Filmtabletten
Pfizer Pharma GmbH
-
Cibinqo 100 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
Cibinqo® 100 mg Filmtabletten
Pfizer Pharma GmbH
-
Cibinqo 100 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Cibinqo 200 mg Abacus Filmtabletten
Abacus Medicine A/S
-
Cibinqo 200 mg axicorp Filmtabletten
axicorp Pharma B.V.
-
Cibinqo 200 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
Cibinqo® 200 mg Filmtabletten
Pfizer Pharma GmbH
-
Cibinqo 200 mg kohlpharma Filmtabletten
kohlpharma GmbH













