Amiodaron
Das Klasse-III-Antiarrhythmikum Amiodaron wird als Mittel der 2. Wahl bei ventrikulären und supraventrikulären Herzrhythmusstörungen angewendet. Der Wirkstoff besitzt eine sehr lange Halbwertszeit von 20 bis 100 Tagen.
Amiodaron: Übersicht
Anwendung
Amiodaron ist indiziert bei symptomatischen und behandlungsbedürftigen tachykarden supraventrikulären Herzrhythmusstörungen, wie z. B.
- AV-junktionale Tachykardien
- supraventrikuläre Tachykardien bei WPW-Syndrom oder
- paroxysmales Vorhofflimmern.
Es ist für Patienten geeignet, die nicht auf die Behandlung mit anderen Antiarrhythmika ansprechen bzw. bei denen andere Antiarrhythmika nicht angezeigt sind.
Schwerwiegende, symptomatische, tachykarde ventrikuläre Herzrhythmusstörungen.
Auf die Therapie mit β-Rezeptorenblockern sollte jedoch nicht zugunsten einer Therapie mit Amiodaron verzichtet werden.
Bei Wiederbelebungen nach Kammertachykardien oder Kammerflimmern gilt Amiodaron als Mittel der 1. Wahl.
Wirkmechanismus
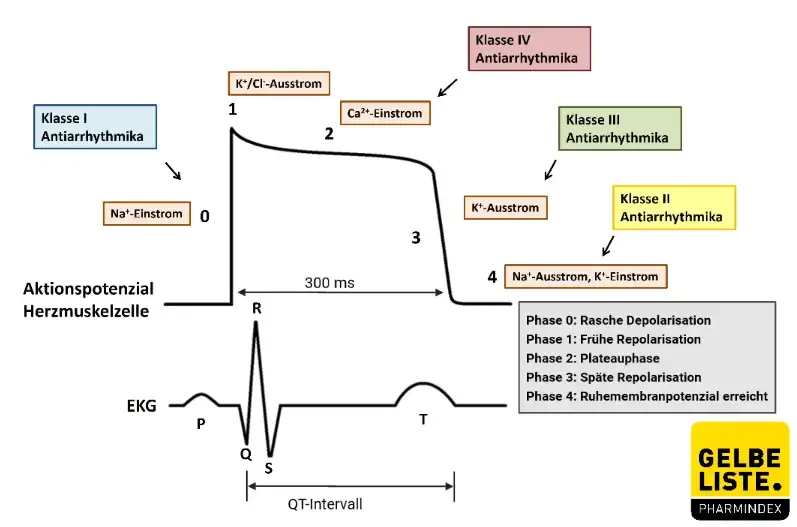
Amiodaron ist ein Antiarrhythmikum der Klasse III. Es hat eine stark hemmende Wirkung auf viele Herzrhythmusstörungen, die mit einer gestörten Erregungsleitung des Herzens einhergehen. Amiodaron hemmt spannungsabhängige Kaliumkanäle im Myokardgewebe. Dadurch wird der Kaliumausstrom in Phase III des Aktionspotenzials inhibiert und selektiv die Repolarisationsdauer und Refraktärperiode des Aktionspotenzials verlängert. Die Kontraktionskraft des Myokards wird nicht beeinflusst. Amiodaron zeigt eine dosisabhängige, nicht kompetitive Hemmung der α- und β-adrenergen Aktivitäten. Dies äußert sich in einer koronar- und gefäßerweiternden Wirkung. Die Sauerstoffversorgung des Herzens wird verbessert und der Herzmuskel entlastet.
In Medikamenten ist der Wirkstoff als Amiodaronhydrochlorid enthalten.
Pharmakokinetik
Amiodaronhydrochlorid wird nach oraler Gabe zu 50% aus dem Magen-Darm-Trakt resorbiert. Für die therapeutische Wirksamkeit ist die Anreicherung der Substanz an ihrem Wirkort bzw. die Aufsättigung des Myokardgewebes entscheidend. Therapeutische Wirkungen sind in Abhängigkeit von der Sättigungsdosierung in einem Zeitraum von wenigen Tagen bis zu zwei Wochen zu erwarten.
Nach Injektion wird das Wirkmaximum nach 15 Minuten erreicht. Anschließend kommt es zu einer Umverteilung ins Gewebe und zu einem schnellen Abfall des Plasmaspiegels innerhalb von 4 Stunden. Zur Aufsättigung der Gewebespeicher muss die Therapie intravenös oder oral weitergeführt werden.
Amiodaron hat eine lange Halbwertszeit, die individuell stark variiert (20 bis 100 Tage). Die Substanz kumuliert während der Aufsättigung insbesondere im Fettgewebe. Der Steady State wird innerhalb eines Zeitraumes von einem bis zu mehreren Monaten erreicht. Aufgrund dieser Charakteristika sollte die empfohlene Sättigungsdosis verabreicht werden, um eine schnelle Gewebesättigung zu erreichen, die Voraussetzung für die therapeutische Wirksamkeit ist.
Der Hauptausscheidungsweg geht über die Leber und die Galle. Amiodaron wird hauptsächlich über CYP-3A4 und auch über CYP2C8 metabolisiert. 10% der Substanz werden renal ausgeschieden. Aufgrund der geringen renalen Ausscheidung kann niereninsuffizienten Patienten die übliche Dosis verabreicht werden. Nach Absetzen wird Amiodaron noch über mehrere Monate ausgeschieden.
Amiodaron und sein Metabolit, Desethylamiodaron, sind in vitro in der Lage die folgenden Enzyme des Cytochrom P450 Systems zu hemmen: CYP1A1, CYP1A2, CYP2C9, CYP2D6, CYP-3A4, CYP2A6, CYP2B6 und CYP2C8 zu hemmen. Darüber hinaus haben beide Substanzen das Potenzial, einige Transporter (wie z.B. P-Glykoprotein und organische Kationen-Transporter (OCT2)) zu hemmen. In-vivo-Daten haben eine Interaktion von Amiodaron und CYP-3A4, CYP2C9, CYP2D6 und P-gp-Substraten gezeigt.
In den begrenzten, veröffentlichten Daten, die für pädiatrische Patienten verfügbar sind, wurde kein Unterschied zu Erwachsenen festgestellt. Studien wurden an Kindern und Jugendlichen nicht durchgeführt.
Dosierung
Für die Einstellung der Therapie bei ventrikulären Herzrhythmusstörungen bedarf es einer sorgfältigen kardiologischen Überwachung. Sie darf nur bei Vorhandensein einer kardiologischen Notfallausrüstung sowie der Möglichkeit einer Monitorkontrolle erfolgen. Folgende Richtwerte können für die Dosisfindung herangeszogen werden:
- Sättigungsdosis bei Erwachsenen: 8-10 Tage lang 600 mg pro Tag (3 x täglich 200 mg)
- Anschließend Reduzierung der Dosis auf eine Erhaltungsdosis: im Allgemeinen 200 mg (1 x täglich) an 5 Tagen pro Woche.
- In Einzelfällen kann eine Sättigungsdosis bis 1200 mg erforderlich sein und für die Erhaltungsdosis 200-600 mg pro Tag.
- Bei der Behandlung von Kindern sollte die Dosis in abhängig von der Körperoberfläche und vom Körpergewicht angepasst werden. In Studien wurden 10 bis 20mg/kg/Tag für 7 bis 10 Tage als Sättigungsdosis eingesetzt. Die Erhaltungsdosis sollte die minimale effektive Dosis sein. Sie kann zwischen 5 bis 10mg/kg/Tag liegen.
Nebenwirkungen
Die Anwendung von Amiodaron muss dringend ärztlich überwacht werden, da der Wirkstoff schwerwiegende Nebenwirkungen wie Lungenfibrosen oder Schilddrüsenunterfunktion mit sich bringen und sogar selbst Herzrhythmusstörungen verursachen kann.
Im Folgenden sind die Nebenwirkungen von Amiodaron nach ihrer Häufigkeit aufgelistet:
Sehr häufig:
- Mikroablagerungen an der Vorderfläche der Hornhaut des Auges (Cornea verticillata), können zu Sehstörungen (Schleiersehen, Farbhöfe um Lichtquellen) führen. Es handelt sich um komplexe Lipidablagerungen die üblicherweise auf die Region unterhalb der Pupille begrenzt sind. Sie bilden sich meist 6 bis 12 Monate nach Absetzen des Wirkstoffes zurück
- Übelkeit, Erbrechen, Geschmacksveränderungen zu Behandlungsbeginn (Sättigungsdosis), die bei Dosisreduktion verschwinden
- Leichte Erhöhungen der Serumtransaminasen zu Beginn der Therapie (Normalisierung meist bei Dosisreduktion oder spontan)
- Photosensibilisierung
Häufig:
- Akute Hepatitis mit stark erhöhten Serumtransaminasen und/oder cholestatischer Ikterus, einschließlich Leberversagen (in Einzelfällen tödlicher Verlauf)
- Hyper- oder Hypothyreose (Einzelfälle mit tödlichem Verlauf)
- Extrapyramidaler Tremor, Albträume, Schlafstörungen
- Bradykardie (moderat und dosisabhängig)
- Infolge der Lungentoxizität von Amiodaron können atypische Pneumonien als Ausdruck einer Überempfindlichkeitsreaktion (Hypersensitivitäts-Pneumonitis), alveoläre oder interstitielle Pneumonien oder Fibrosen, Pleuritis, Bronchiolitis obliterans mit Pneumonie/BOOP auftreten. Einzelfälle mit tödlichem Verlauf wurden berichtet. Nicht produktiver Husten und Atemnot sind häufig erste Anzeichen der vorgenannten Lungenveränderungen
- Gewichtsverlust, Fieber und Schwächegefühl
- Obstipation
- Ekzem
- Hyperpigmentierung
- Muskelschwäche
Wechselwirkungen
- Schwerwiegende Interaktionen bestehen mit Arzneimitteln, die Torsade de pointes auslösen oder die die QT-Zeit verlängern.
- Die gleichzeitige Behandlung mit Arzneimitteln, die Torsade de pointes auslösen (z.B. MAO-Hemmer, Antiarrhythmika der Klassen I und III) können, ist daher kontraindiziert.
- Arzneimittel, von denen bekannt ist, dass sie die QT-Zeit (z. B. Vincamin, einige Neuroleptika [z.B. Sulpirid], Pentamidin i.v. und Erythromycin i.v.) verlängern, können das Risiko für Torsade de pointes erhöhen. Gemeinsame Anwendung sollte nur nach sorgfältiger Bewertung der möglichen Risiken und des Nutzens für jeden Patienten erfolgen. Die Patienten sollten im Hinblick auf eine QT-Zeit-Verlängerung überwacht werden.
- Verabreichung von Fluorochinolonen sollte bei Patienten, die mit Amiodaron behandelt werden, vermieden werden.
- Gleichzeitige Behandlung mit Arzneimitteln, die die Herzfrequenz vermindern oder Reizbildungs- oder Leitungsstörungen verursachen wird nicht empfohlen.
- Anwendung mit Calciumkanalblockern vom Verapamil- und Diltiazem-Typ oder β-Blockern kann zu einer exzessiven Bradykardie, zu höhergradigen atrioventrikulären Überleitungsstörungen und zu einer additiven kardiodepressiven Wirkung führen.
- Gleichzeitige Anwendung von Arzneimitteln, die in der Lage sind Hypokaliämien auszulösen, wird nicht empfohlen. So können Laxanzien, die Hypokaliämien verursachen das Risiko für Torsade de pointes erhöhen. In Kombination mit Amiodaron sollten daher andere Laxantien verwendet werden.
- Aufgrund des erhöhten Risikos für das Auftreten hypokaliämisch induzierter Herzrhythmusstörungen (einschließlich Torsade de pointes) ist Vorsicht bei einer gleichzeitigen Behandlung mit folgenden Arzneimitteln ist geboten: kaliumausschwemmende Diuretika (z.B. Hydrochlorothiazid, Furosemid), systemische Kortikosteroide, Tetracosactid oder Amphotericin B i.v.
- Eine Hypokaliämie muss vermieden (und korrigiert) werden. Im Falle von Torsade de pointes sollen keine Antiarrhythmika gegeben werden.
- Bei einer Allgemeinnarkose sind in seltenen Fällen atropinresistente Bradykardie, Blutdruckabfall, Überleitungsstörungen und reduziertes Herzminutenvolumen möglich. Sehr selten sind schwere respiratorische Komplikationen (Schocklunge, ARDS) beobachtet worden.
- CYP1A1, CYP-1A2, CYP3A4, CYP2C9, CYP2D6 und P-Glykoprotein (P-gp) werden durch Amiodaron und/oder sein Metabolit, Desethylamiodaron, inhibiert. Dadurch kann die Exposition gegenüber den Substraten dieser Enzyme und damit deren Wirkung und Toxizität erhöht werden. Eventuell ist eine Dosisanpassung notwendig. Interaktionen können mehrere Monate nach dem Absetzen von Amiodaron anhalten (aufgrund der langen Halbwertszeit von Amiodaron).
- Amiodaron und herzwirksame Glykoside zeigen eine synergistische Wirkung am Herzen. Dadurch kann es bei gleichzeitiger Gabe zu Störungen der Reizbildung (exzessive Bradykardie) und der atrioventrikulären Überleitung kommen. Mit Digoxin kann es zu einer Erhöhung des Digoxin-Serumspiegels (auf Grund einer erniedrigten Digoxin-Clearance) kommen. Diese Patienten sollten auf Symptome einer Digitalis-Überdosierung kontrolliert werden (vorsorgliche Bestimmung der Digoxin-Plasmaspiegel und evtl. Dosisanpassung).
- Gleichzeitige Anwendung von Dabigatran sollte aufgrund eines erhöhten Blutungsrisikos mit Vorsicht erfolgen. Eine Dosisanpassung von Dabigatran kann erforderlich sein.
- CYP2C9-Substrate: Vitamin K-Antagonisten (Warfarin, Dicoumarol, Phenprocoumon): Verstärkung des gerinnungshemmenden Effektes und folglich erhöhtes Blutungsrisiko. Häufigere INR-Kontrollen sollten während und nach der Behandlung mit Amiodaron durchgeführt werden. Gegebenenfalls ist eine Dosisanpassung der Vitamin K-Antagonisten erforderlich.
- Phenytoin (Symptome einer Phenytoin-Überdosierung sind z. B. Sehstörungen, Tremor, Schwindel)
- Antiarrhythmika (z.B. Chinidin, Procainamid, Flecainid).
- CYP2D6-Substrate: Flecainid (Die Flecainid-Dosis sollte bei gemeinsamer Anwendung angepasst werden).
- Cytochrom P450 3A4-Substrate: Ciclosporin, Fentanyl, Statine, Lidocain,Tacrolimus, Sildenafil, Midazolam, Triazolam, Ergotamin und Dihydroergotamin, Colchicin
- CYP3A4- und CYP2C8-Inhibitoren haben das Potenzial, den Metabolismus von Amiodaron zu hemmen und die Exposition gegenüber Amiodaron zu erhöhen. Während der Behandlung mit Amiodaron sollte die Anwendung von CYP3A4-Inhibitoren (wie z.B. Grapefruitsaft oder bestimmte Arzneimittel) vermieden werden.
Kontraindikation
Amiodaron darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff
- Sinusbradykardie (weniger als 55 Pulsschläge pro Minute)
- allen Formen einer Leitungsverzögerung (sinuaurikuläre und nodale Leitungsverzögerung) einschließlich Syndrom des kranken Sinusknotens, AV-Block II. und III. Grades sowie bi- und trifaszikulärer Blöcke, sofern kein Herzschrittmacher eingesetzt ist (Gefahr eines Sinusknotenstillstands)
- Schilddrüsenerkrankungen
- vorbestehender QT-Verlängerung
- Hypokaliämie
- Iodallergien
- anamnestisch bekanntem angioneurotischem Ödem (hereditär oder idiopathisch, z. B. infolge einer früheren Amiodaron-Therapie)
- gleichzeitiger Behandlung mit MAO-Hemmern
- gleichzeitiger Behandlung mit Arzneimitteln, die Torsade de pointes auslösen können
- Schwangerschaft, es sei denn, dies ist eindeutig erforderlich.
Schwangerschaft
Amiodaron passiert die Plazentaschranke und hat schädliche Wirkungen auf die Schwangerschaft, den Fötus und das Neugeborene. Wachstumsstörungen, Frühgeburten und Funktionsstörungen der Schilddrüse beim Neugeborenen sind die häufigsten Komplikationen. Es wurden aber auch Hypothyreoidismus, Bradykardie und verlängerte QT-Intervalle bei einigen Neugeborenen festgestellt. Vereinzelt wurden eine Vergrößerung der Schilddrüse oder Herzgeräusche gefunden. Auch wenn die Fehlbildungsrate nicht erhöht zu sein scheint, sollte die Möglichkeit von Herzdefekten berücksichtigt werden.
Amiodaron darf während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich. Frauen mit Kinderwunsch sollten wegen der langen Halbwertszeit von Amiodaron den Beginn einer Schwangerschaft frühestens ein halbes Jahr nach dem Ende der Therapie planen, um eine Exposition des Kindes in der Frühschwangerschaft zu vermeiden.
Stillzeit
Ein Übergang in die Muttermilch ist für den Wirkstoff und für den aktiven Metaboliten nachgewiesen. Während der Behandlung mit Amiodaron darf nicht gestillt werden.
Verkehrstüchtigkeit
Amiodaron kann auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. In verstärktem Maße gilt dies bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie in Kombination mit Alkohol.
Die Behandlung mit diesem Arzneimittel bedarf der regelmäßigen ärztlichen Kontrolle.
Weitere Details zu diesem Wirkstoff können Sie der jeweiligen Fachinformation entnehmen.
Wirkstoff-Informationen
-
Amiodaron 1 A Pharma 200 mg BB Farma Tabletten
BB Farma S.R.L.
-
Amiodaron 200 - 1 A Pharma®, 200 mg Tabletten
1 A Pharma GmbH
-
Amiodaron 200 Heumann
Heumann Pharma GmbH & Co. Generica KG
-
Amiodaron 200 Heumann Heunet Tabletten
Heunet Pharma GmbH
-
Amiodaron AL 200
ALIUD PHARMA® GmbH
-
Amiodaron Aurobindo 200 mg BB Farma Tabletten
BB Farma S.R.L.
-
Amiodaron Aurobindo 200 mg Tabletten
PUREN Pharma GmbH & Co. KG
-
Amiodaron Carefarm 200 mg Tabletten
1 0 1 Carefarm GmbH
-
Amiodaron-CT 200 mg Tabletten
AbZ-Pharma GmbH
-
Amiodaron-hameln 20 mg/ml Infusionslösung, 50 ml
hameln pharma GmbH
-
Amiodaron-hameln 50 mg/ml Konzentrat zur Herstellung einer Injektions-/Infusionslösung
hameln pharma GmbH
-
Amiodaron HCl Hikma 50 mg/ml Injektionslösung
Hikma Pharma GmbH
-
Amiodaron Holsten 200 mg Tabletten
Holsten Pharma GmbH
-
Amiodaron PUREN 200 mg Tabletten
PUREN Pharma GmbH & Co. KG
-
Amiodaron-ratiopharm® 100 mg Tabletten
ratiopharm GmbH
-
Amiodaron-ratiopharm® 150 mg/3 ml Injektionslösung
ratiopharm GmbH
-
Amiodaron-ratiopharm® 200 mg Tabletten
ratiopharm GmbH
-
Amiodaron STADA 200 mg BB Farma Tabletten
BB Farma S.R.L.
-
Amiodaron STADA® 200 mg Tabletten
STADAPHARM GmbH
-
Amiodaron Winthrop 200 mg BB Farma Tabletten
BB Farma S.R.L.
-
Amiodaron Winthrop 200 mg Tabletten
Zentiva Pharma GmbH
-
amiodura 200 mg BB Farma Tabletten
BB Farma S.R.L.
-
amiodura 200 mg Tabletten
Viatris Healthcare GmbH
-
Amiogamma® 200, 200 mg Tabletten
AAA Pharma GmbH
-
Cordarex®, 200 mg Tabletten
Sanofi-Aventis Deutschland GmbH
-
Cordarex® Injektionslösung, 150 mg/3 ml
Sanofi-Aventis Deutschland GmbH
-
Cordarone 200 mg BB Farma Tabletten
BB Farma S.R.L.
-
Cordarone 200 mg Eurim Tabletten
Eurim-Pharm Arzneimittel GmbH
-
Cordarone 200 mg kohlpharma Tabletten
kohlpharma GmbH
-
Cordarone Emra 200 mg Tabletten
Emra-Med Arzneimittel GmbH
-
Cordarone Emra Injektionslösung, 150 mg/3 ml
Emra-Med Arzneimittel GmbH
-
Cordarone Eurim Injektionslösung 150 mg/3 ml
Eurim-Pharm Arzneimittel GmbH
-
Cordarone kohlpharma Injektionslösung, 150 mg/3 ml
kohlpharma GmbH
-
Cordarone Orifarm Injektionslösung, 150 mg/3 ml
Orifarm GmbH












