Anifrolumab
Anifrolumab ist der erste in Europa zugelassene Interferonrezeptor-Antikörper zur Behandlung von systemischem Lupus erythematodes (SLE).
Anifrolumab : Übersicht
Anwendung
Anifrolumab (Saphnelo) ist ein vollständig menschlicher, monoklonaler IgG1κ-Antikörper, der an den Typ I IFN-α/β/ω-Rezeptor (IFNAR) bindet und so die nachgeschaltete Signalübertragung und die Gentranskription von Entzündungsmediatoren verringert.
Anifrolumab ist indiziert als Add-on-Therapie zur Behandlung von erwachsenen Patienten mit moderatem bis schwerem, aktivem Autoantikörper-positivem systemischem Lupus erythematodes (SLE), die bereits eine Standardtherapie erhalten. Die Anti-Malaria-Medikamente Chloroquin und Hydroxychloroquin gelten beim SLE als Basismedikamente. Bei Arthralgien und Arthritiden werden NSARs, Glukokortikoide, Methotrexat, Leflunomid oder Belimumab eingesetzt. Bei Befall des Nervensystems oder Lebensgefahr werden systemische Steroiden, Cyclophosphamid oder Rituximab angewendet.
Weitere monoklonale Antikörper, die auf den Typ-1-Interferonweg abzielen und aktuell in klinischen Studien als potenzielle Behandlungen für systemischen Lupus erythematodes untersucht werden, sind Rontalizumab und Sifalimumab
Anwendungsart
- Anifrolumab ist für die intravenöse Anwendung vorgesehen und darf nicht als intravenöse Druck- oder Bolusinjektion verabreicht werden.
- Nach Verdünnung mit 0,9%iger Natriumchlorid-Infusionslösung (9 mg/ml) wird Saphnelo als Infusion über 30 Minuten unter Verwendung eines Infusionsschlauchs gegeben, der einen sterilen 0,2- oder 0,22-Mikrometer-In-line-Filter mit geringer Proteinbindung enthält.
- Die Infusionsgeschwindigkeit kann verlangsamt oder unterbrochen werden, wenn der Patient eine Infusionsreaktion entwickelt.
Über SLE
Systemischer Lupus erythematodes (SLE) ist eine chronische und komplexe multisystemische Autoimmunerkrankung, die Gelenke, Nieren, Haut, Schleimhäute und die Wände der Blutgefäße betreffen kann. SLE kann durch eine Reihe von Symptomen gekennzeichnet sein, darunter Schmerzen, Hautausschläge, Müdigkeit, Schwellungen an den Gelenken und Fieber. Mehr als 50% der Patienten mit SLE entwickeln dauerhafte Organschäden, die durch die Krankheit oder bestehende Behandlungen verursacht werden, was die Symptome verschlimmert und das Mortalitätsrisiko erhöht.
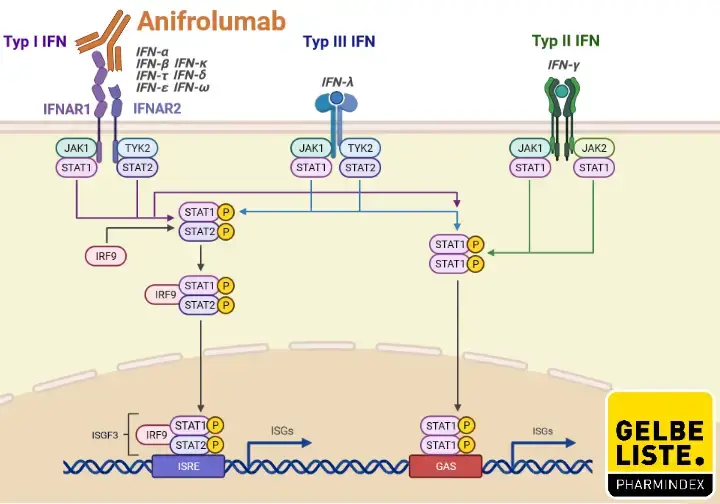
Die Behandlung von SLE ist aufgrund begrenzter Wirksamkeiten und schlechten Verträglichkeit der bisherigen Standardtherapien eine Herausforderung. Die Aktivierung des Typ-I-Interferon (IFN)-Systems scheint der zentrale pathogene Mediator bei SLE zu sein. Die Zellsignalisierung durch alle Typ-I-IFNs, einschließlich IFNα, IFNβ, IFNɛ, IFNκ und IFNω, wird durch den Typ I IFN-α/β/ω-Rezeptor (IFNAR) vermittelt, was zu einer IFN-stimulierten Gentranskription führt.
Wirkmechanismus
Anifrolumab ist ein humaner monoklonaler Immunglobulin-G1-kappa-Antikörper, der mit hoher Spezifität und Affinität an die Untereinheit 1 des Typ-I-Interferonrezeptors (IFNAR1) bindet. Die Aktivierung von INFAR1 und INFAR2 führt zur Phosphorylierung von STAT1 und STAT2, die mit dem Interferon-regulatorischen Faktor 9 (IRF9) in den Zellkern transloziert werden, um das Interferon-stimulierte Response-Element (ISRE) zu aktivieren. Die Aktivierung von ISRE führt zur Expression vieler entzündungsfördernder und immunmodulatorischer Proteine sowie zur Aktivierung einer positiven Rückkopplungsschleife, die mehr Typ-1-Interferone produziert.
Durch die Bindung von Anifrolumab an IFNAR1wird die Typ-I-IFN-Signaltransduktion und damit die biologische Aktivität von Typ-I-Interferonen blockiert. Darüber hinaus induziert Anifrolumab die Internalisierung von IFNAR1 und reduziert so die Anzahl der Rezeptoren auf der Zelloberfläche, so dass weniger IFNAR1 für die Rezeptorbindung zur Verfügung stehen.
Die Blockade der rezeptorvermittelten Typ-I-IFN-Signaltransduktion hemmt die Expression des Interferon-stimulierten Gens sowie die nachgelagerten inflammatorischen und immunologischen Prozesse. Die Hemmung des Typ-I-IFN blockiert die Plasmazelldifferenzierung und normalisiert die Untergruppen der peripheren T-Zellen, wodurch das Gleichgewicht zwischen adaptiver und angeborener Immunität, welches bei SLE fehlreguliert ist, wiederhergestellt wird.
Dosierung
- Die empfohlene Dosis Saphnelo beträgt 300 mg Anifrolumab, die alle 4 Wochen über eine Dauer von 30 Minuten als intravenöse Infusion gegeben wird.
- Bei infusionsbedingten Reaktionen in der Anamnese kann vor der Infusion eine Prämedikation bestehend aus einem Antihistaminikum gegeben werden.
- Wenn eine geplante Infusion verpasst wurde, soll diese so bald wie möglich nachgeholt werden, wobei ein Mindestabstand von 14 Tagen zwischen den Dosen eingehalten werden soll.
Nebenwirkungen
Die am häufigsten berichteten Nebenwirkungen, die in den kontrollierten klinischen Studien mit Anifrolumab auftraten, waren:
- Infektionen der oberen Atemwege (34%)
- Bronchitis (11%)
- infusionsbedingte Reaktionen (9,4%)
- Herpes Zoster (6,1%)
Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt. Es ist aber nicht davon auszugehen, dass die Metabolisierung von Anifrolumab durch Leberenzyme oder die Ausscheidung über die Nieren erfolgt. Bei einer chronischen Entzündung wird die Bildung einiger CYP450-Enzyme durch den Anstieg bestimmter Zytokine unterdrückt. Anifrolumab unterdrückt moderat die Spiegel einiger Zytokine. Die Auswirkungen auf die CYP450-Aktivität sind jedoch nicht bekannt. Bei gleichzeitiger Anwendung von CYP-Substraten mit einer geringen therapeutischen Breite oder Wirkstoffen deren Dosis individuell angepasst wird (z. B. Warfarin), soll eine therapeutische Überwachung erfolgen.
Kontraindikationen
Anifrolumab darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels.
Schwangerschaft
Bisher liegen nur sehr begrenzte Erfahrungen (weniger als 300 Schwangeschaftsverläufe) mit der Anwendung von Anifrolumab bei Schwangeren vor. Tierexperimentelle Studien sind nicht eindeutig in Bezug auf eine Reproduktionstoxizität. Die Anwendung von Anifrolumab während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die nicht verhüten, wird deshalb nicht empfohlen, es sei denn der mögliche Nutzen rechtfertigt das potenzielle Risiko.
Stillzeit
Es ist nicht bekannt, ob Anifrolumab in die Muttermilch übergeht. Anifrolumab wurde in der Milch weiblicher Cynomolgus-Affen nachgewiesen. Da ein Risiko für das gestillte Kind kann nicht ausgeschlossen werden kann, muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Anifrolumab verzichtet werden soll. Dabei soll sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau berücksichtigt werden.
Verkehrstüchtigkeit
Anifrolumab hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Anwendungshinweise
- Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
- Anifrolumab wurde nicht in Kombination mit anderen Biologika-Therapien, einschließlich auf B-Zellen zielgerichtete Therapien, untersucht. Die Anwendung von Anifrolumab in Kombination mit Biologika-Therapien wird daher nicht empfohlen.
- Anifrolumab wurde nicht bei Patienten mit schwerem aktivem Lupus des Zentralnervensystems oder schwerer aktiver Lupus Nephritis untersucht.
- Nach der Anwendung von Anifrolumab wurden schwere Überempfindlichkeitsreaktionen, einschließlich Anaphylaxie berichtet - in den placebokontrollierten klinischen Studien bei 0,6% der Patienten. Bei Patienten mit infusionsbedingten Reaktionen und/oder Überempfindlichkeit in der Anamnese kann vor der Infusion von Anifrolumab eine Prämedikation (zum Beispiel ein Antihistaminikum) gegeben werden. Wenn eine schwere infusionsbedingte Reaktion oder Überempfindlichkeitsreaktion (zum Beispiel Anaphylaxie) auftritt, soll die Gabe von Anifrolumab umgehend abgebrochen und eine geeignete Therapie eingeleitet werden.
- Anifrolumab erhöht das Risiko für Atemwegsinfektionen und Herpes Zoster. SLE-Patienten, die auch Immunsuppressiva einnehmen, haben möglicherweise ein höheres Risiko für Herpes-Zoster-Infektionen.
- In kontrollierten klinischen Studien traten schwere und zum Teil tödlich verlaufende Infektionen auf, einschließlich bei Patienten, die Anifrolumab erhielten. Aufgrund seines Wirkmechanismus soll Anifrolumab bei Patienten mit einer chronischen Infektion, mit rezidivierenden Infektionen in der Anamnese oder bekannten Risikofaktoren für eine Infektion mit Vorsicht angewendet werden. Eine Therapie mit Anifrolumab soll bei Patienten mit einer klinisch signifikanten aktiven Infektion nicht begonnen werden, bevor die Infektion abgeheilt ist oder adäquat behandelt wird.
- Die Patienten sollen angewiesen werden, medizinische Hilfe in Anspruch zu nehmen, wenn Anzeichen oder Symptome einer klinisch signifikanten Infektion auftreten. Wenn ein Patient eine Infektion entwickelt oder auf die Standardtherapie nicht anspricht, soll er engmaschig überwacht werden und es soll sorgfältig geprüft werden, ob die Therapie mit Anifrolumab unterbrochen werden soll, bis die Infektion abgeheilt ist.
- Es wurden keine Studien bei Patienten mit einer primären Immundefizienz in der Anamnese durchgeführt.
- In den placebokontrollierten klinischen Studien waren Patienten mit einer aktiven Tuberkulose (tuberculosis, TBC) oder einer latenten TBC in der Anamnese, bei denen ein adäquater Behandlungsverlauf nicht bestätigt werden konnte, ausgeschlossen. Vor Einleitung einer Behandlung mit Anifrolumab bei Patienten mit unbehandelter latenter TBC soll eine Anti-Tuberkulose (Anti-TBC)-Therapie in Erwägung gezogen werden. Anifrolumab soll nicht bei Patienten mit aktiver TBC angewendet werden.
- Es liegen keine Daten zur Immunantwort auf Impfstoffe vor. Vor Beginn der Behandlung sollte darauf geachtet werden, dass alle entsprechenden Schutzimpfungen gemäß Schutzimpfungs-Empfehlungen abgeschlossen sind. Patienten, die mit Anifrolumab behandelt werden, sollen nicht gleichzeitig eine Impfung mit Lebendimpfstoffen oder attenuierten Lebendimpfstoffen erhalten.
- Der Einfluss einer Behandlung mit Anifrolumab auf die potenzielle Entwicklung von Malignomen ist nicht bekannt. Es wurden keine Studien bei Patienten mit Malignomen in der Anamnese durchgeführt. Patienten mit Plattenepithel- oder Basalzellkarzinomen und Gebärmutterhalskrebs, die entweder operativ vollständig entfernt oder ausreichend behandelt worden waren, durften jedoch in die klinischen SLE-Studien aufgenommen werden.
- In den placebokontrollierten klinischen Studien wurden in jedweder Dosis maligne Neoplasmen (einschließlich nicht-melanotischer Hautkrebs) bei 1,2% der Patienten berichtet, die Anifrolumab erhielten, im Vergleich zu 0,6% der Patienten, die Placebo erhielten (EAIR: 1,2 bzw. 0,7 pro 100 Patientenjahre). Malignome, ausgenommen nicht-melanotischer Hautkrebs, wurden bei 0,7% bzw. 0,6% der Patienten beobachtet, die Anifrolumab bzw. Placebo erhielten. Bei den Patienten, die Anifrolumab erhielten, wurden Brust- und Plattenepithelkarzinome bei mehr als einem Patienten beobachtet.
- Bei Patienten mit bekannten Risikofaktoren für die Entwicklung oder das Wiederauftreten eines Malignoms soll das individuelle Nutzen-Risiko-Verhältnis abgewogen werden. Bei Patienten, bei denen sich ein Malignom entwickelt hat, soll die Entscheidung zur Fortführung der Therapie sorgfältig abgewogen werden.
- EMA: Fachinformation Saphnelo
- Furie R, Khamashta M, Merrill JT, et al. Anifrolumab, an Anti-Interferon-α Receptor Monoclonal Antibody, in Moderate-to-Severe Systemic Lupus Erythematosus. Arthritis Rheumatol. 2017;69(2):376-386. doi:10.1002/art.39962
- BDI: Systemischer Lupus erythematodes: Wie wird der Systemische Lupus erythematodes behandelt?, abgerufen am 28.03.2022
Abbildung
Adapted from „ Interferon Pathway”, by BioRender.com














