Atezolizumab
Atezolizumab ist ein humanisierter monoklonaler Antikörper zur Behandlung des metastasierten Urothelkarzinoms sowie des metastasierten nicht-kleinzelligen Lungenkarzinoms.
Atezolizumab: Übersicht
Anwendung
Der Checkpoint-Inhibitor Atezolizumab wird beim erwachsenen Patienten zur Behandlung des lokal fortgeschrittenen oder metastasierten Urothelkarzinoms nach vorangegangener platinhaltiger Chemotherapie angewendet. Ebenso können erwachsenen Patienten, die für eine Behandlung mit Cisplatin ungeeignet sind, damit therapiert werden. Der Einsatz erfolgt als Monotherapie.
Zur Therapie des lokal fortgeschrittenen oder metastasierten nicht-kleinzelligen Lungenkarzinoms wird Atezolizumab ebenfalls als Monotherapie und nach vorangegangener Chemotherapie angewendet. Träger von EGFR-Mutationen oder ALK-positiven Tumormutationen sollten vor Behandlung mit Atezolizumab eine auf diese Mutation zielgerichtete Therapie erhalten haben.
Wirkmechanismus
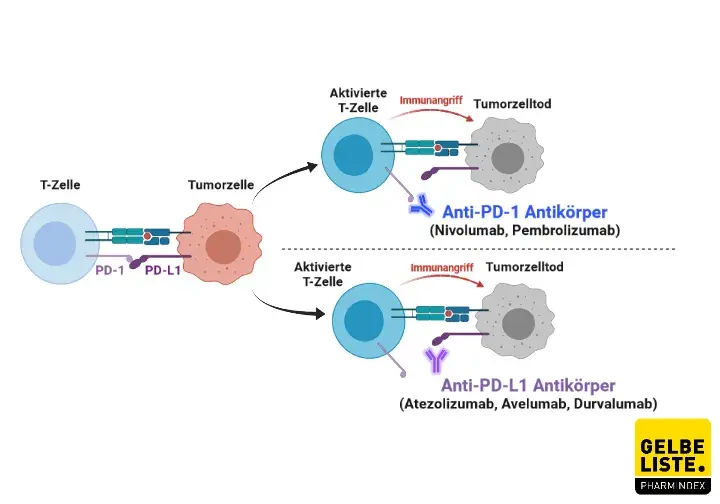
Atezolizumab ist ein modifizierter, humanisierter monoklonaler Immunglobulin G1 (IgG1)-Antikörper, der direkt an den programmierten Zelltod-Liganden 1 (PD-L1) bindet. PD-L1 kann auf Tumorzellen und/oder tumorinfiltrierenden Immunzellen exprimiert werden. Bindet PD-L1 an die Rezeptoren PD-1 und B7.1 auf T-Zellen, werden diese deaktiviert und die zytotoxische T-Zell-Aktivität, T-Zell-Proliferation sowie die Zytokin-Produktion unterdrückt. Durch Bindung von Atezolizumab an PD-L1 kommt es zu einer Blockade der PD-1- und B7.1-Rezeptoren. Die PD-L1/PD-1-vermittelte Hemmung der Immunantwort wird aufgehoben und die antitumorale Immunantwort reaktiviert.
Es wird keine Antikörper-induzierte zelluläre Zytotoxizität ausgelöst. Atezolizumab hat keinen Einfluss auf die PD-L2/ PD-1-Interaktion.
Pharmakokinetik
Die Pharmakokinetik von Atezolizumab wurde bei Patienten in mehreren klinischen Studien mit Dosen von 0,01 mg/kg bis 20 mg/kg alle 3 Wochen einschließlich der Fixdosis 1200 mg charakterisiert. Im Dosisbereich 1 mg/kg bis 20 mg/kg nahm die Exposition von Atezolizumab dosisproportional zu. Atezolizumab wird als intravenöse Infusion alle 3 Wochen verabreicht. Der Steady-State wird bei wiederholter Gabe nach 6-9 Wochen (2 bis 3 Zyklen) erreicht. Die Terminale Eliminationshalbwertzeit beträgt 27 Tage. Körpergewicht, Geschlecht, positiver anti-therapeutischer Antikörper-Status, Albuminspiegel und Tumorlast haben keine klinisch relevante Auswirkung auf die Pharmakokinetik von Atezolizumab und es werden keine Dosisanpassungen empfohlen.
Nebenwirkungen
Die am häufigsten aufgetretene Nebenwirkung war Fatigue. Nachfolgend sind die Nebenwirkungen entsprechend ihrer Häufigkeit gelistet:
- Sehr häufig (≥ 1/10): Fatigue, verminderter Appetit, Übelkeit, Dyspnoe, Diarrhoe, Hautausschlag, Fieber, Erbrechen, Arthralgie, Asthenie, Pruritus
- Häufig (≥ 1/100, < 1/10): Infusionsbedingte Reaktionen, grippeähnliche Erkrankung, Schüttelfrost, Schmerzen des Bewegungsapparates, erhöhte Leberwerte (AST und ALT), Bauchschmerzen, Kolitis, Dysphagie, Pneumonitis, Hypoxie, verstopfte Nase, Hypotonie, Hypokaliämie, Hyponatriämie, Hypothyreose, Hyperthyreose, Thrombozytopenie und Hypersensitivität
- Gelegentlich (≥ 1/1000, < 1/100): Hepatitis, Pankreatitis, erhöhte Lipase, nichtinfektiöse Meningitis, Guillain-Barré-Syndrom, Diabetes mellitus, Nebenniereninsuffizienz.
Wechselwirkungen
Es sind keine metabolischen Arzneimittelwechselwirkungen zu erwarten, da Atezolizumab katabolisch aus dem Blutkreislauf eliminiert wird. Es wurden keine Studien dazu durchgeführt.
Kortikosteroide und Immunsuppressiva
Aufgrund einer möglichen Beeinträchtigung der pharmakodynamischen Aktivität und der Wirksamkeit von Atezolizumab sollte eine vorhergehende Behandlung mit systemischen Kortikosteroiden oder Immunsuppressiva vermieden werden.
Nach Beginn der Therapie mit Atezolizumab können diese jedoch zur Behandlung immunvermittelter Nebenwirkungen eingesetzt werden.
Kontraindikation
Atezolizumab darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile der Infusionslösung.
Schwangerschaft
Frauen im gebärfähigen Alter müssen während der Behandlung und 5 Monate danach eine wirksame Verhütungsmethode anwenden.
Zur Anwendung bei Schwangeren liegen derzeit keine Daten vor. Es ist aber wahrscheinlich, dass Atezolizumab von der Mutter auf den Fötus übertragen wird. Tierexperimentelle Daten deuten auf eine fruchtschädigende Wirkung von Atezolizumab hin. Deshalb darf der Arzneistoff während der Schwangerschaft nicht angewendet werden, es sei denn eine Behandlung der Frau ist aufgrund ihres klinischen Zustandes notwendig.
Stillzeit
Frauen, die mit Atezolizumab therapiert werden, sollten nicht stillen, da Antikörper in der Regel in die Muttermilch ausgeschieden werden und ein Risiko für Neugeborene und Säuglinge nicht ausgeschlossen werden kann.
Klinische Daten über mögliche Auswirkungen auf die Fertilität sind nicht verfügbar. Eine langfristige Toxizitätsstudie an Affen zeigte keine Auswirkungen auf männliche Fortpflanzungsorgane. Bei weiblichen Tieren wurde ein reversibel veränderter Menstruationszyklus beobachtet.
Wirkstoff-Informationen
Roche, Fachinformation; EMA














