Avelumab
Avelumab ist ein humaner rekombinanter monoklonaler Antikörper, der als sogenannter Checkpoint-Inhibitor zur Behandlung des metastasierten Merkelzellkarzinoms zugelassen ist.
Avelumab: Übersicht
Anwendung
Avelumab wird als Monotherapie zur Behandlung von erwachsenen Patienten mit metastasiertem Merkelzellkarzinom (MCC) angewendet. Mindestens während der ersten vier Behandlungen werden vor der Behandlung mit Avelumab zusätzlich Paracetamol und ein Antihistaminikum verabreicht, um mögliche Nebenwirkungen im Zusammenhang mit der Infusion zu verhindern.
Wirkmechanismus
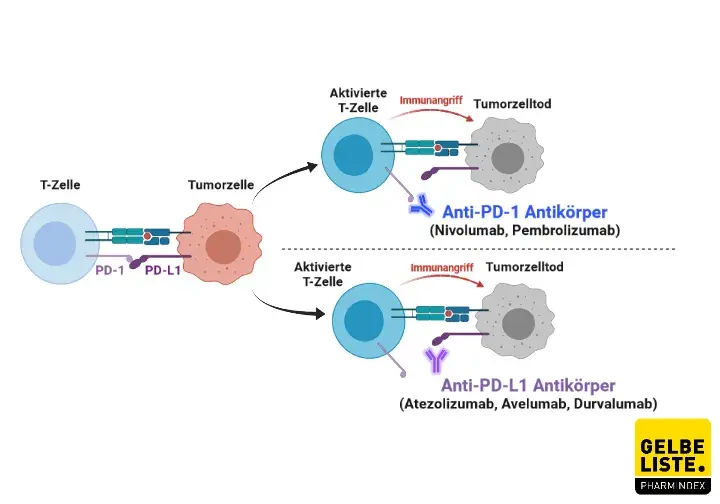
Der Checkpoint-Inhibitor Avelumab (Bavencio) ist ein humaner monoklonaler Immunglobulin G1 (IgG1)-Antikörper, der gegen den programmierten Zelltod-Liganden 1 (PD-L1) gerichtet ist. PD-L1 befindet sich auf der Oberfläche von MCC-Zellen und schützt die Krebszellen vor der antitumoralen Immunantwort. Avelumab bindet an PD-L1 und hemmt die Interaktion zwischen PD-1 und den Rezeptoren PD-1 (programmierter Zelltod) und B7.1. Dadurch wird der Schutzmechanismus der Krebszellen außer Kraft gesetzt und sie werden angreifbar für die körpereigene Immunabwehr durch zytotoxische CD8+ T-Zellen.
Es wurde gezeigt, dass Avelumab darüber hinaus die körpereigene Immunabwehr stimuliert, indem es durch Antikörper-abhängige zelluläre Zytotoxizität (ADCC), die durch Natürliche Killerzellen vermittelt wird, eine direkte Tumorzelllyse auslöst.
Pharmakokinetik
Avelumab verteilt sich im systemischen Kreislauf und in geringem Umfang im Extrazellularraum. Das Verteilungsvolumen im Steady-State ist gering und betrug in klinischen Studien 4,72 l. Avelumab bindet nicht spezifisch an Plasmaproteine. Bei wiederholter Gabe von 10mg/kg Körpergewicht alle 2 Wochen wurde der Steady-State-Zustand nach ca. 4-6 Wochen (2-3 Zyklen) erreicht.
Bei der empfohlenen Dosis beträgt die Eliminationshalbwertzeit 6,1 Tage. Die systemische Gesamtclearance nimmt mit dem Körpergewicht zu. Die Exposition im Steady-State war bei gewichtskontrollierter Dosierung über einen breiten Bereich von Körpergewichten (30 bis 204 kg) hinweg annähernd einheitlich. Alter, Geschlecht, ethnische Herkunft, PD-L1-Status, Tumorlast, eingeschränkte Nierenfunktion und leicht oder mäßig eingeschränkte Leberfunktion üben keinen Einfluss auf die Gesamtclearance von Avelumab aus.
Dosierung
Die empfohlene Dosis von Avelumab in Kombination mit Axitinib beträgt 800 mg alle zwei Wochen und wird über 60 Minuten intravenös verabreicht, während Axitinib in einer Dosis von 5 mg zweimal täglich oral (im Abstand von 12 Stunden) eingenommen wird.
Nebenwirkungen
Am häufigsten ist Avelumab mit immunvermittelten Nebenwirkungen assoziiert. Diese waren meist reversibel und konnten durch geeignete Therapie z.B. mit Kortikosteroiden und/oder durch vorüber-gehendes (evtl. dauerhaftes) Absetzen von Avelumab, kontrolliert werden.
Nachfolgend sind die Nebenwirkungen entsprechend ihrer Häufigkeit gelistet:
Sehr häufig (≥ 1/10):
- Ermüdung
- Übelkeit
- Diarrhö
- verminderter Appetit
- Obstipation
- infusionsbedingte Reaktionen
- Gewichtsverlust
- Erbrechen
- Fieber
- peripheres Ödem
- Rückenschmerzen
- Arthralgie
- Anämie
- Husten
- Dyspnoe
- Abdominalschmerzen
Häufig (≥ 1/100, < 1/10):
- gamma-Glutamyltransferase erhöht
- alkalische Phosphatase erhöht
- Amylase erhöht
- Lipase erhöht
- Kreatinin erhöht
- Asthenie
- Schüttelfrost
- Influenza-ähnliche Erkrankung
- Myalgie
- immunvermittelte Nebenwirkungen (wie Ausschlag, Pruritus und makulo-papulöser Ausschlag, Pneumonitis)
- trockene Haut
- Mundtrockenheit
- Hypertonie
- Hypotonie
- Kopfschmerzen
- Schwindel
- periphere Neuropathie.
Weitere gelegentlich und selten auftretende Nebenwirkungen sind hier nicht einzeln aufgeführt und können der Fachinformation entnommen werden.
Wechselwirkungen
Studien zur Erfassung von Wechselwirkungen mit Avelumab wurden nicht durchgeführt. Pharmakokinetische Wechselwirkungen mit anderen Arzneimitteln sind nicht zu erwarten, da Avelumab hauptsächlich über katabole Stoffwechselvorgänge eliminiert wird.
Kontraindikation
Avelumab darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile der Infusionslösung.
Schwangerschaft
Zur Anwendung bei Schwangeren liegen kaum Daten vor. Den Frauen im gebärfähigen Alter sollte jedoch während der Behandlung mit Avelumab von einer Schwangerschaft abgeraten werden. Eine zuverlässige Verhütungsmethode sollte bis mindestens 1 Monat nach der letzten Dosis angewendet werden.
Eine Blockade der PD-L1-Signalübertragung hat in Tierversuchen zu erhöhten fetalen Verlusten geführt. Dies deutet auf das potentielle Risiko hin, dass Avelumab in der Schwangerschaft zu einer Schädigung des Fötus einschließlich vermehrter Aborte und Totgeburten führen könnte. Eine Anwendung in der Schwangerschaft sollte nur erfolgen, wenn die Behandlung aufgrund des klinischen Zustandes der Frau notwendig ist.
Stillzeit
Frauen sollten während der Behandlung und mindestens 1 Monat nach der letzten Anwendung nicht stillen, da ein Risiko für das Neugeborene/den Säugling nicht ausgeschlossen werden kann.
Anwendungshinweise
Infusionsbedingte Reaktionen
Bei Patienten unter Avelumab wurden Fälle von infusionsbedingten Reaktionen, auch mit schwerem Verlauf, berichtet. Die Patienten sollten deshalb auf Anzeichen und Symptome von infusionsbedingten Reaktionen wie Fieber, Schüttelfrost, Hitzegefühl, Hypotonie, Dyspnoe, Giemen, Rückenschmerzen, Abdominalschmerzen und Urtikaria überwacht werden.
Immunvermittelte Nebenwirkungen
Die meisten immunvermittelten Nebenwirkungen, die unter Avelumab auftraten, waren reversibel und konnten durch vorübergehendes oder dauerhaftes Absetzen, Gabe von Kortikosteroiden und/oder unterstützende Maßnahmen kontrolliert werden.
Nebenniereninsuffizienz
Die Patienten sollten während und nachder Behandlung auf Anzeichen und Symptome einer Nebenniereninsuffizienz überwacht werden.
Diabetes mellitus Typ 1
Avelumab kann Diabetes mellitus Typ1 einschließlich diabetischer Ketoazidose hervorrufen.
Hepatotoxizität (bei Kombination mit Axitinib)
Bei Patienten, die Avelumab in Kombination mit Axitinib erhielten, trat eine Hepatotoxizität mit ALT- und AST-Erhöhungen 3. und 4.Grades häufiger auf als im Vergleich zur Monotherapie mit Avelumab zu erwarten war.
Wirkstoff-Informationen
Merck Serono, Fachinformation; EMA
-
Bavencio 20 mg/ml CC Pharma Konzentrat zur Herstellung einer Infusionlösung, 10 ml
CC Pharma GmbH
-
Bavencio 20 mg/ml Eurim Konzentrat zur Herstellung einer Infusionlösung, 10 ml
Eurim-Pharm Arzneimittel GmbH
-
Bavencio 20 mg/ml Haemato-Pharm Konzentrat zur Herstellung einer Infusionlösung, 10 ml
HAEMATO PHARM GmbH
-
Bavencio 20 mg/ml kohlpharma Konzentrat zur Herstellung einer Infusionlösung, 10 ml
kohlpharma GmbH
-
Bavencio 20 mg/ml Konzentrat zur Herstellung einer Infusionlösung, 10 ml
Merck Serono GmbH
-
Bavencio 20 mg/ml Medicopharm Konzentrat zur Herstellung einer Infusionlösung, 10 ml
Medicopharm AG
-
Bavencio 20 mg/ml Orifarm Konzentrat zur Herstellung einer Infusionlösung, 10 ml
Orifarm GmbH
-
Bavencio 20 mg/ml Paranova Konzentrat zur Herstellung einer Infusionlösung, 10 ml
Paranova Pack A/S