Azacitidin
Azacitidin ist ein DNA-Methyltransferase-Inhibitor und epigenetischer Modifikator, der nach zellulärer Aufnahme und enzymatischer Biotransformation zu Nukleotidtriphosphaten in die DNA und RNA integriert wird. Der Wirkstoff wird angewendet zur Behandlung der akuten myeloischen Leukämie oder myelodysplastischen Syndromen.
Azacitidin: Übersicht
Anwendung
Bei Azacitidin handelt es sich um einen antineoplastischen Wirkstoff, der für die parenterale Anwendung beim myelodysplastischen Syndrom, bei chronischer myelomonozytärer Leukämie und bei der akuten myeloischen Leukämie zugelassen ist.
Im Juni 2021 wurde mit Onureg auch eine orale Azacitidin-Behandlungsoption für die Erhaltungstherapie bei Erwachsenen mit AML zugelassen, die eine komplette Remission oder eine komplette Remission mit unvollständiger Regeneration des Blutbildes nach einer Induktionstherapie mit oder ohne Konsolidierungstherapie erreicht haben und die nicht für eine Transplantation hämatopoetischer Stammzellen (HSZT) geeignet sind, einschließlich derer, die sich dagegen entschieden haben.
Wirkmechanismus
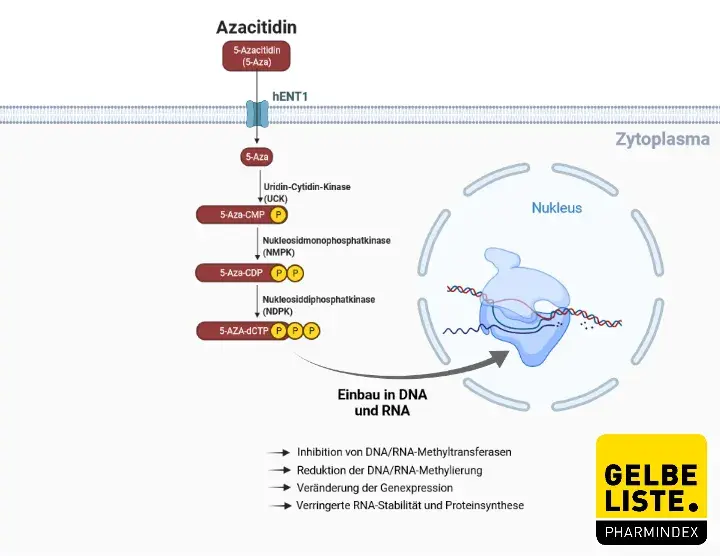
Azacitidin ist ein DNA-Methyltransferase-Inhibitor und epigenetischer Modifikator, der nach zellulärer Aufnahme und enzymatischer Biotransformation zu Nukleotidtriphosphaten in die DNA und RNA integriert wird.
Die Integration von Azacitidin in die DNA von AML-Zellen modifizierte epigenetische Signalwege durch Inhibition von DNA-Methyltransferasen und Reduktion der DNA-Methylierung. Dies führte zur Veränderung der Genexpression, einschließlich Re-Expression von Genen, welche die Tumorunterdrückung, Immunsignalwege, den Zellzyklus und die Zelldifferenzierung regulieren.
Die Integration von Azacitidin in die RNA von AML-Zellen hemmte die RNA-Methyltransferase, reduzierte die RNA-Methylierung, verringerte die RNA-Stabilität und die Proteinsynthese.
Pharmakokinetik
Resorption
Nach subkutaner Anwendung einer Einzeldosis von 75 mg/m2 wurde Azacitidin rasch resorbiert; Eine halbe Stunde nach Gabe (erste Probenahme) wurden im Plasma Spitzenkonzentrationen von 750±403 ng/ml gemessen. Die absolute Bioverfügbarkeit von Azacitidin nach subkutaner gegenüber intravenöser Anwendung (Einzeldosis von 75mg/m2) betrug auf Grundlage der Fläche unter der Kurve (AUC) etwa 89%. Die AUC und die maximale Plasmakonzentration (Cmax) waren nach subkutaner Anwendung von Azacitidin im Dosisbereich von 25 bis 100 mg/m2 etwa proportional.
Bei oraler Anwendung war die Exposition allgemein linear mit dosisproportionalen Anstiegen der systemischen Exposition. Eine hohe interindividuelle Variabilität wurde beobachtet. Das geometrische Mittel (Variationskoeffizient [%CV]) der Cmax und AUC nach oraler Anwendung einer Einzeldosis von 300 mg betrug 145,1 ng/ml (63,7) bzw. 241,6 ng h/ml (64,5). Mehrfache Gaben mit der empfohlenen Dosis führten nicht zur Akkumulation des Arzneimittels. Die Resorption von Azacitidin erfolgte rasch; so lag die mediane Tmax bei einer Stunde nach der Dosis.
Die mittlere orale Bioverfügbarkeit im Vergleich zur subkutanen Anwendung betrug ungefähr 11%
Verteilung
Das mittlere Verteilungsvolumen betrug nach intravenöser Applikation 76±26 l, die systemische Clearance lag bei147±47l/h. Nach oraler Anwendung lag das geometrische mittlere scheinbare Verteilungsvolumen bei 12,6 l/kg für eine Person von 70 kg. Die Plasmaproteinbindung betrug 6 bis 12%.
Biotransformation
Auf Grundlage von in-vitro-Daten scheint die Metabolisierung von Azacitidin nicht durch Cytochrom-P450-Isoenzyme (CYP), UDP-Glucuronosyltransferasen (UGT), Sulfotransferasen (SULT) und Glutathiontransferasen (GST) vermittelt zu werden. Azacitidin unterliegt einer spontanen Hydrolyse und einer durch Cytidindeaminase vermittelten Deaminierung. In humanen Leber-S9-Fraktionen erwies sich die Bildung der Metaboliten als NADPH-unabhängig, was darauf schließen lässt, dass der Azacitidin-Metabolismus nicht durch CYP450-Isoenzyme vermittelt wird.
Eine CYP-Enzym-Induktion oder -Inhibition durch Azacitidin in klinisch erreichbaren Plasmakonzentrationen ist unwahrscheinlich.
Elimination
Azacitidin wird nach subkutaner Verabreichung mit einer mittleren Eliminationshalbwertszeit (t½) von 41±8 Minuten rasch aus dem Plasma eliminiert. Nach subkutaner Applikation von 75 mg/m2 Azacitidin einmal täglich über 7 Tage tritt keine Akkumulation auf. Der primäre Eliminationsweg von Azacitidin und/oder dessen Metaboliten ist die renale Ausscheidung. Nach intravenöser und subkutaner Verabreichung von14C-markiertem Azacitidin wurden 85 bzw. 50% der gegebenen Radioaktivität im Urin und <1% in den Fäzes wiedergefunden.
Nach oraler Anwendung lag diee geometrische mittlere scheinbare Clearance bei 1242 l/Stunde und die geometrische mittlere Halbwertzeit bei etwa 0,5 Stunden. Nach intravenöser Gabe von 14C-Azacitidin an 5 Krebspatienten betrug die kumulative Urinausscheidung 85% der radioaktiven Dosis. Die Menge an unverändert im Urin wiedergefundenen Azacitidin in Bezug auf die Dosis betrug <2% nach subkutaner oder oraler Anwendung. Die Ausscheidung in den Fäzes nach oraler Gabe wurde nicht gemessen.
Dosierung
CAVE: Aufgrund der Unterschiede bezüglich Exposition, Dosis und Einnahmeplan darf oral anwendbares Azacitidin (Onureg) NICHT mit injizierbarem Azacitidin ausgetauscht werden. Medizinischem Fachpersonal wird empfohlen, die Bezeichnung, Dosis und Art der Anwendung des vorliegenden Arzneimittels zu überprüfen.
Subkutane Applikation:
Die empfohlene Anfangsdosis für den ersten Behandlungszyklus beträgt für alle Patienten, unabhängig von den hämatologischen Ausgangswerten,75 mg/m2 Körperoberfläche, subkutan injiziert, täglich über sieben Tage, gefolgt von einer Behandlungspause von 21 Tagen (28-tägiger Behandlungszyklus). Es wird empfohlen, dass die Patienten mindestens sechs Behandlungszyklen erhalten. Die Behandlung sollte so lange fortgesetzt werden, wie der Patient davon profitiert, oder bis eine Progression der Erkrankung eintritt.
Orale Anwendung:
Die empfohlene Dosis beträgt 300 mg Azacitidin einmal täglich oral. Jeder Wiederholungszyklus besteht aus einem Behandlungszeitraum von 14 Tagen, gefolgt von einem behandlungsfreien Zeitraum von 14 Tagen (28-tägiger Behandlungszyklus). Die Behandlung sollte fortgesetzt werden, solange nicht mehr als 15 Prozent Blasten im peripheren Blut oder Knochenmark beobachtet werden oder bis eine inakzeptable Toxizität auftritt.
Nebenwirkungen
Die häufigsten Nebenwirkungen unter der Anwendung von Azacitidin sind:
- Übelkeit, Erbrechen, Diarrhoe
- Neutropenie
- Ermüdung/ Asthenie
- Obstipation
- Thrombozytopenie
- Abdominalschmerz
- Atemwegsinfektion
- Arthralgie
- verminderter Appetit
- febrile Neutropenie
- Rückenschmerzen
- Leukopenie
- Schmerz in einer Extremität
- Pneumonie
Wechselwirkungen
Bei gleichzeitiger Anwendung mit anderen antineoplastischen Arzneimitteln wird zur Vorsicht und Überwachung des Patienten geraten, da eine antagonistische, additive oder synergistische pharmakodynamische Wirkung nicht ausgeschlossen werden kann.
Kontraindikationen
Azacitidin darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels sowie in der Stillzeit.
Bei Patienten mit hoher Tumorlast infolge einer Metastasierung wurden Fälle von fortschreitendem hepatischem Koma und Tod unter Behandlung mit Azacitidin berichtet, insbesondere bei Patienten mit einem Albuminausgangswert im Serum von <30g/l. Azacitidin ist deshalb bei Patienten mit fortgeschrittenen malignen Lebertumoren kontraindiziert.
Schwangerschaft
Tierexperimentelle Studien an Mäusen und Ratten haben eine Reproduktions- und Entwicklungstoxizität gezeigt. Das potenzielle Risiko für den Menschen ist nicht bekannt. Aufgrund der Ergebnisse von tierexperimentellen Studien und seines Wirkmechanismus wird die Anwendung von Azacitidin während der Schwangerschaft (insbesondere während des ersten Trimesters, sofern nicht unbedingt notwendig) und bei gebärfähigen Frauen, die nicht verhüten, nicht empfohlen. Die Vorteile der Behandlung sollten in jedem Einzelfall gegen die möglichen Risiken für den Fötus abgewogen werden. Wenn eine Patientin oder die Partnerin eines Patienten während der Einnahme schwanger wird, sollte die Patientin oder der Patient über das potenzielle Risiko für den Fötus informiert werden.
Stillzeit
Es ist nicht bekannt, ob Azacitidin oder seine Metaboliten in die Muttermilch übergehen. Aufgrund der potenziell schwerwiegenden Nebenwirkungen bei Säuglingen ist Stillen während der Therapie mit Azacitidin kontraindiziert.
Verkehrstüchtigkeit
Azacitidin hat geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen, da unter der Anwendung von Azacitidin Ermüdung auftreten kann. Beim Führen eines Fahrzeugs oder Bedienen von Maschinen ist deshalb Vorsicht geboten.
Anwendungshinweise
Hämatologische Toxizität
Die Behandlung mit Azacitidin kann zu Neutropenie, Thrombozytopenie und febriler Neutropenie führen, weshab eine Unterbrechung, Reduktion oder sogar ein Absetzen zur Behandlung hämatologischer Toxizitäten erforderlich werden kann.
- Die Patienten sollten angewiesen werden, Fieberepisoden sofort zu melden.
- Patienten mit niedrigen Thrombozytenzahlen sollten angewiesen werden, erste Anzeichen oder Symptome von Blutungen zu melden.
- Eine unterstützende Therapie wie Antibiotika und/oder Antipyretika zur Behandlung von Infektionen/Fieber und G-CSF für Neutropenie sollte je nach individuellen Patientenmerkmalen, dem Ansprechen auf die Behandlung und gemäß den aktuellen klinischen Leitlinien angewendet werden.
Gastrointestinale Toxizitäten
Die häufigsten Nebenwirkungen unter der Behandlung mit Azacitidin sind Gastrointestinale Toxizitäten.
- Die Patienten sollten in den ersten zwei Zyklen der Behandlung eine Prophylaxe mit Antiemetika erhalten.
- Diarrhoe sollte unverzüglich bei Einsetzen der Symptome behandelt werden.
- Unterbrechung, Reduktion oder Absetzen von Azacitidin kann zur Behandlung gastrointestinaler Toxizitäten erforderlich werden.
Weitere Hinweise sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
- Bristol Myers Squibb: Bristol Myers Squibb Receives European Commission Approval for Onureg® (azacitidine tablets) as Frontline Oral Maintenance Therapy for Adults with Acute Myeloid Leukemia
- NEJM: Oral Azacitidine Maintenance Therapy for Acute Myeloid Leukemia in First Remission
- EMA: Fachinformation Onureg
- EMA: Fachinformation Vidaza
- Onkopedia: Akute Myeloische Leukämie (AML)
Abbildung
Created with BioRender.com
-
Azacitidin Accord 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 100 mg
Accord Healthcare GmbH
-
Azacitidin Accord 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 150 mg
Accord Healthcare GmbH
-
Azacitidin AqVida 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 100 mg
AqVida GmbH
-
Azacitidin AqVida 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 150 mg
AqVida GmbH
-
Azacitidin Bendalis 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 100 mg
Bendalis GmbH
-
Azacitidin Bendalis 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 150 mg
Bendalis GmbH
-
Azacitidin betapharm 25 mg/ml BB Farma Pulver zur Herstellung einer Injektionssuspension
BB Farma S.R.L.
-
Azacitidin betapharm 25 mg/ml Eurim Pulver zur Herstellung einer Injektionssuspension
Eurim-Pharm Arzneimittel GmbH
-
Azacitidin betapharm 25 mg/ml Pulver zur Herstellung einer Injektionssuspension
betapharm Arzneimittel GmbH
-
Azacitidin HEXAL® 25 mg/ml Pulver zur Herstellung einer Injektionssuspension
Hexal AG
-
Azacitidin Hikma 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 100 mg
Hikma Pharma GmbH
-
Azacitidin Kabi 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 100 mg
FRESENIUS KABI Deutschland GmbH
-
Azacitidin Mylan 25 mg/ml BB Farma Pulver zur Herstellung einer Injektionssuspension
BB Farma S.R.L.
-
Azacitidin Mylan 25mg/ml Pulver zur Herstellung einer Injektionssuspension
Viatris Healthcare GmbH
-
Azacitidin Onko 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 100 mg
Accord Healthcare GmbH
-
Azacitidin onkovis 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 100 mg
Onkovis GmbH
-
Azacitidin onkovis 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 150 mg
Onkovis GmbH
-
Azacitidin Pharmascience 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 100 mg
AIRA Pharm GmbH
-
Azacitidin Pharmascience 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 150 mg
AIRA Pharm GmbH
-
Azacitidin PUREN 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 100 mg
PUREN Pharma GmbH & Co. KG
-
Azacitidin Seacross 25 mg/ml Pulver zur Herstellung einer Injektionssuspension
Seacross Pharmaceuticals Ltd.
-
Azacitidin Seacross 25 mg/ml Sun Pharmaceuticals Pulver zur Herstellung einer Injektionssuspension, 100 mg
Sun Pharmaceuticals Germany GmbH
-
Azacitidin STADA 25 mg/ml BB Farma Pulver zur Herstellung einer Injektionssuspension, 100 mg
BB Farma S.R.L.
-
Azacitidin STADA® 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 100 mg
STADAPHARM GmbH
-
Azacitidin STADA® 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, 150 mg
STADAPHARM GmbH
-
Azacitidin Tillomed 25 mg/ml Pulver zur Herstellung einer Injektionssuspension, Durchstechfl.
Zentiva Pharma GmbH
-
Azacitidin Zentiva 25 mg/ml Pulver zur Herstellung einer Injektionssuspension
Zentiva Pharma GmbH
-
Azacitidine Accord 25 mg/ml BB Farma Pulver zur Herstellung einer Injektionssuspension, 100 mg
BB Farma S.R.L.
-
Azacitidine Accord 25 mg/ml docpharm Pulver zur Herstellung einer Injektionssuspension, 100 mg
Docpharm GmbH
-
Onureg 200 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Onureg® 200 mg Filmtabletten
Bristol-Myers Squibb GmbH & Co. KGaA
-
Onureg 200 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Onureg 200 mg Orifarm Filmtabletten
Orifarm GmbH
-
Onureg 300 mg Abacus Filmtabletten
Abacus Medicine A/S
-
Onureg 300 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Onureg® 300 mg Filmtabletten
Bristol-Myers Squibb GmbH & Co. KGaA
-
Onureg 300 mg Orifarm Filmtabletten
Orifarm GmbH
-
Vidaza 25 mg/ml Abacus Pulver zur Herstellung einer Injektionssuspension, 100 mg
Abacus Medicine A/S
-
Vidaza 25 mg/ml BB Farma Pulver zur Herstellung einer Injektionssuspension
BB Farma S.R.L.
-
Vidaza 25 mg/ml CC Pharma Pulver zur Herstellung einer Injektionssuspension
CC Pharma GmbH
-
Vidaza® 25 mg/ml Pulver zur Herstellung einer Injektionssuspension
Bristol-Myers Squibb GmbH & Co. KGaA














