Belantamab mafodotin
Belantamab-Mafodotin ist ein Antikörper-Wirkstoff-Konjugat, das sich gegen das B-Zell-Reifungsantigen (BCMA) richtet und für die Behandlung des Multiplen Myeloms zugelassen ist.
Belantamab-Mafodotin: Übersicht
Anwendung
Belantamab-Mafodotin (Blenrep) ist als Monotherapie indiziert zur Behandlung des multiplen Myeloms bei erwachsenen Patienten, die bereits mindestens vier Therapien erhalten haben und deren Erkrankung refraktär gegenüber mindestens einem Proteasom-Inhibitor, einem Immunmodulator und einem monoklonalen Anti-CD38-Antikörper ist, und die während der letzten Therapie eine Krankheitsprogression zeigten.
Anwendungsart
Belantamab-Mafodotin wird als intravenöse Infusion angewendet und sollte über einen Zeitraum von mindestens 30 Minuten infundiert werden.
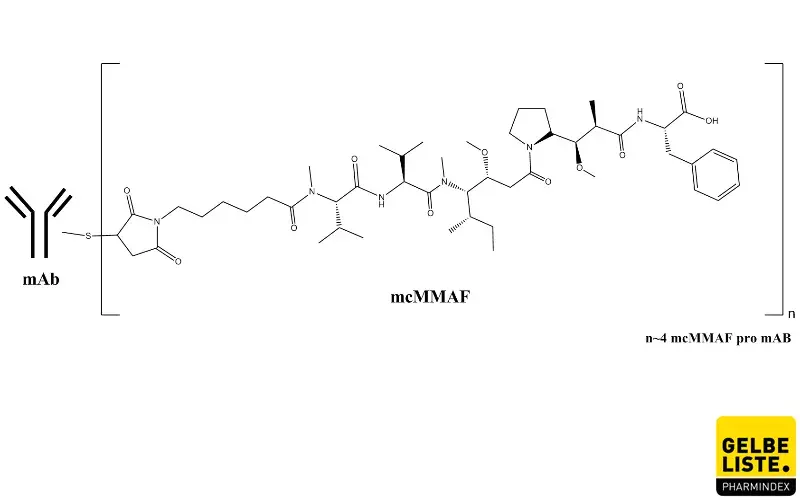
Wirkmechanismus
Belantamab-Mafodotin ist ein Antikörper-Wirkstoff-Konjugat, bestehend aus dem monoklonalen IgG1κ-Antikörper Belantamab, der gegen das B-Zell-Reifungsantigen (B-cell maturation antigen, BCMA) gerichtet ist, das auf Zellen des Multiplen Myeloms, jedoch nicht auf gesunden B-Zellen vorhanden ist und dem zytotoxischen Wirkstoff Monomethylauristatin F (MMAF).
MMAF ist über einen Linker kovalent an den Antikörper gebunden. Bindet das Konjugat über die Antikörper-Komponente an BCMA, wird es in die Zelle internalisiert und MMAF freigesetzt. Dies führt zum Zellzyklus-Arrest und zur Apoptose, da MMAF die Tubulin-Polymerisation in der Zelle hemmt. Der Antikörper verbessert zudem die Rekrutierung und Aktivierung von Immuneffektorzellen, die Tumorzellen durch eine antikörperabhängige zelluläre Zytotoxizität und Phagozytose abtöten.

Pharmakokinetik
Resorption
Zum oder kurz nach Ende der Infusion vonBelantamab-Mafodotin zeigte sich die Höchstkonzentration, während die cysmcMMAF-Konzentrationen ihren Höhepunkt etwa 24 Stunden nach der Applikation erreichten. Die geometrischen mittleren Cmax und AUC(0 – tau)-Konzentrationen von Belantamab-Mafodotin betrugen 43 μg/ml bzw. 4.666 μg.h/ml. Die geometrischen mittleren
Cmax- und AUC(0 – 168 h)-Konzentrationen von cys-mcMMAF lagen bei 0,90 ng/ml bzw. 84 ng.h/ml.
Verteilung
Das mittlere Steady-State-Verteilungsvolumen von Belantamab-Mafodotin betrug 10,8 l.
Biotransformation
Es ist zu erwarten, dass der monoklonale Antikörper-Anteil von Belantamab-Mafodotin durch ubiquitäre proteolytische Enzyme in kleine Peptide und individuelle Aminosäuren abgebaut wird. CysmcMMAF hatte in Studien zur Inkubation der humanen hepatischen S9-Fraktion eine begrenzte metabolische Clearance.
Elimination
Belantamab-Mafodotin wurde langsam mit einer Gesamtplasma-Clearance von 0,92 l/ Tag und einer terminalen Halbwertszeit von 12 Tagen eliminiert. Im Laufe der Zeit wurde die Clearance auf 0,72 l/Tag mit einer Eliminationshalbwertszeit von 14 Tagen gesenkt. Prädosiskonzentrationen des cycmcMMAF lagen bei jeder Dosis typischerweise unter der Quantifizierungsgrenze (0,05 ng/ml). In einer Tierstudie wurden ca. 83% der radioaktiven Dosis in den Fäzes ausgeschieden. Die Ausscheidung über den Urin (ca. 13%) spielte eine untergeordnete Rolle.
Linearität/Nicht-Linearität
Belantamab-Mafodotin weist über den empfohlenen Dosierungsbereich eine dosisproportionale Pharmakokinetik mit einer mit der Zeit abnehmenden Clearance auf.
Dosierung
Die empfohlene Dosis beträgt 2,5 mg/kg Körpergewicht, verabreicht als intravenöse Infusion alle 3 Wochen. Es wird empfohlen, die Behandlung bis zur Progression der Erkrankung oder einer inakzeptablen Toxizität fortzusetzen.
Nebenwirkungen
Die häufigsten Nebenwirkungen (≥ 30%), die in der klinischen Studie »205678 BLENREP« an 95 Patienten auftraten waren:
- Keratopathie (71%)
- Thrombozytopenie (38%)
Die am häufigsten berichteten schwerwiegenden Nebenwirkungen waren:
- Pneumonie (7%)
- Pyrexie (7%)
- infusionsbedingte Reaktionen (3%)
Ein dauerhafter Abbruch aufgrund einer Nebenwirkung erfolgte bei 9% der Patienten, wobei 3% der Abbrüche mit okularen Nebenwirkungen zusammenhing.
Wechselwirkungen
Wechselwirkungen mit Belantamab-Mafodotin durchgeführt. Auf Grundlage der verfügbaren in vitro- und klinischer Daten besteht ein geringes Risiko pharmakokinetischer oder pharmakodynamischer Arzneimittelwechselwirkungen.
Kontraindikation
Belantamab-Mafodotin darf nicht angewendet werden bei Überempfindlichkeit gegenüber den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels.
Schwangerschaft/Stillzeit
Es liegen keine Daten zur Anwendung von Belantamab-Mafodotin bei Schwangeren vor. Beruhend auf dem Wirkmechanismus der zytotoxischen Komponente Monomethyl-Auristatin F (MMAF) kann Belantamab-Mafodotin zu einer Schädigung des Embryos/Fötus führen. Für humanes Immunglobulin G (IgG) ist bekannt, dass es die Plazenta passiert; daher besteht auch bei Belantamab-Mafodotin das Potenzial, dass es von der Mutter auf den sich entwickelnden Fötus übertragen wird. Das Arzneimittel sollte deshalb in der Schwangerschaft nur angewendet werden, wenn der Nutzen für die Mutter gegenüber dem potenziellen Risiko für den Fötus überwiegt.
Stillzeit
Es ist nicht bekannt, ob Belantamab-Mafodotin in die Muttermilch übergeht. Da allerdings ImmunglobulinG (IgG) in der Muttermilch vorhanden ist und es sich bei Belantamab- Mafodotin um einen humanisierten monoklonalen IgG-Antikörper handelt, kann es bei gestillten Kindern zu schweren Nebenwirkungen kommen. Frauen sollten darauf hingewiesen werden, vor Beginn der Behandlung abzustillen und bis 3 Monaten nach der letzten Dosis nicht zu stillen.
Verkehrstüchtigkeit
Patienten sollten drauf hingewiesen werden, dass beim Führen von Fahrzeugen oder Bedienen von Maschinen Vorsicht geboten ist, da Belantamab-Mafodotin die Sehkraft beeinträchtigen kann.
Studienlage
Grundlage der Zulassung sind Ergebnisse der offenen, unverblindeten zweiarmigen Phase-II-Studie DREAMM-2 (DRiving Excellence in Approaches to Multiple Myeloma), einschließlich einer 13-monatigen Nachbeobachtung. Hier führte eine Dosierung von 2,5 mg/kg KG (i.v.) Blenrep alle 3 Wochen zu einer Gesamtansprechrate von 32% (21,7-43,6, 97,5%-KI). Durchschnittlich sprachen die Patienten elf Monate an und das mediane Gesamtüberleben betrug knapp 14 Monate.
Ähnliche Vertreter
MMAF ähnelt Monomethylauristatin E (MMAE), das in anderen Antikörper-Wirkstoff-Konjugaten wie Polatuzumab Vedotin (Polivy) und Brentuximab Vedotin (Adcetris) enthalten ist.
Mit Idecabtagen-Vicleucel arbeitet die Firma Celgene an CAR-T-Zellen, die gegen BCMA gerichtet sind. Auch dieses Medikament soll beim Multiplen Myelom eingesetzt werden.
[1] Fachinformation Blenrep
[2] Oncotrends: Multiples Myelom: Europäische Kommission erteilt Zulassung für Belantamab-Mafodotin












