Benralizumab
Benralizumab ist ein humanisierter monoklonaler Antikörper zur Behandlung von schwerem eosinophilem Asthma.
Benralizumab: Übersicht
Anwendung
Benralizumab (Fasenra) wird angewendet zur Add-on-Erhaltungstherapie bei erwachsenen Patienten mit schwerem eosinophilen Asthma, welches trotz hochdosierter inhalativer Kortikosteroide plus langwirksamer Beta-Agonisten (LABA) unzureichend kontrolliert ist. Es sollte nicht zur Behandlung von akuten Asthma-Exazerbationen angewendet werden.
Wirkmechanismus
Benralizumab ist ein anti-eosinophiler, humanisierter, afucosylierter, monoklonaler Immunglobulin G1 (IgG1)-Antikörper, der hochaffin und spezifisch an die Alpha-Untereinheit des menschlichen Interleukin-5-Rezeptors (IL-5Rα) bindet. IL-5R wird spezifisch auf der Oberfläche von Eosinophilen und Basophilen exprimiert. Durch das Fehlen von Fucose im Fc-Bereich von Benralizumab hat der Arzneistoff eine hohe Affinität zu FcyRIII-Rezeptoren auf Immuneffektorzellen. Dazu gehören die natürlichen Killerzellen (NK-Zellen). Eine dadurch verstärkte antikörperabhängige zellvermittelte Zytotoxizität (ADCC) führt zur Apoptose von Eosinophilen und Basophilen und folglich zu einer Reduktion der eosinophilen Entzündung.
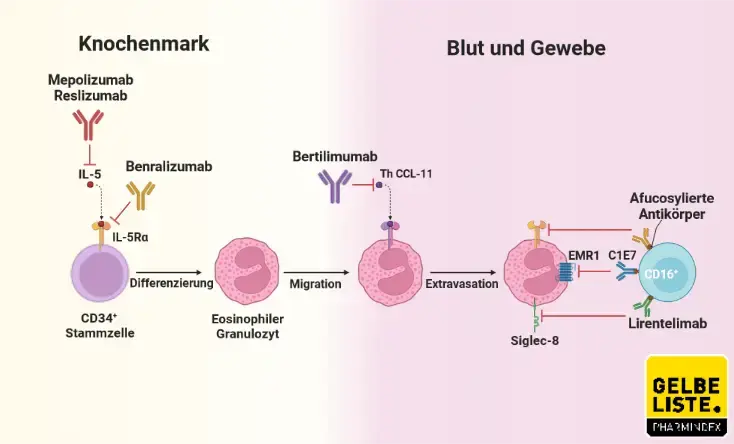
Pharmakokinetik
Die Pharmakokinetik von Benralizumab war bei Asthmatikern nach subkutaner Gabe im Dosierungsintervall von 2-200 mg dosisabhängig. Die Resorptionshalbwertzeit nach subkutaner Gabe betrug 3,6 Tage mit einer geschätzten absoluten Bioverfügbarkeit von 59 %. Es wurden keine klinisch relevanten Unterschiede bezüglich der relativen Bioverfügbarkeit bei Verabreichung in den Bauch, Oberschenkel oder Oberarm festgestellt.
Der Abbau von Benralizumab erfolgt durch proteolytische Enzyme, die im Körper weit verbreitet und nicht auf das Lebergewebe beschränkt sind. Benralizumab zeigte in populationskinetischer Analyse eine lineare Pharmakokinetik. Die mittlere terminale Halbwertzeit nach subkutaner Gabe betrug 15,5 Tage.
Dosierung
Die empfohlene Dosis von Benralizumab beträgt 30 mg als subkutane Injektion, die ersten drei Dosen in einem Abstand von 4 Wochen und anschließend alle 8 Wochen. Wenn eine Injektion am geplanten Termin versäumt wird, sollte die Anwendung schnellstmöglich gemäß dem Dosierungsschema fortgesetzt werden; es darf keine doppelte Dosis angewendet werden.
Nebenwirkungen
Kopfschmerzen und Pharyngitis waren die am häufigsten registrierten Nebenwirkungen.
Nachfolgend sind die Nebenwirkungen entsprechend ihrer Häufigkeit aufgeführt:
- Sehr häufig (≥ 1/10): keine
- Häufig (≥ 1/100, < 1/10): Kopfschmerzen, Pharyngitis , Überempfindlichkeitsreaktionen (z.B. Urtikaria, papulöse Urtikaria und Hautausschlag) Pyrexie, Reaktionen an der Einstichstelle (z.B. Schmerzen, Erytheme, Pruritus).
Wechselwirkungen
Eine Wirkung von Benralizumab auf die Pharmakokinetik gleichzeitig angewendeter Arzneimittel ist nicht zu erwarten. Formale Studien zur Erfassung von Wechselwirkungen mit anderen Arzneimitteln wurden folglich nicht durchgeführt. Häufig gleichzeitig angewendete Arzneimittel sind Montelukast, Paracetamol, Protonenpumpeninhibitoren, Makrolide sowie Theophyllin/Aminophyllin. Diese hatten keine Wirkung auf die Clearance von Benralizumab bei Patienten mit Asthma.
Kontraindikationen
Gegenanzeigen sind Überempfindlichkeit gegen den Wirkstoff oder einen anderen Bestandteil der Arzneiformulierung.
Schwangerschaft
Es existieren nur begrenzt Daten zur Anwendung von Benralizumab bei Schwangeren. Eine Anwendung während der Schwangerschaft sollte möglichst vermieden und nur dann in Erwägung gezogen werden, wenn der zu erwartende Nutzen für die Mutter das potenzielle Risiko für das ungeborene Kind überwiegt. Da monoklonale Antikörper mit fortschreitender Schwangerschaft linear durch die Plazenta transportiert werden, ist das Risiko im zweiten und dritten Trimester der Schwangerschaft entsprechend größer.
Stillzeit
Beim Stillen ist ein Risiko für den Säugling nicht auszuschließen. Deshalb sollte unter sorgfältiger Nutzen-Risiko-Abwägung entweder das Stillen oder die Behandlung mit Benralizumab unterbrochen werden.
Alternativen
Patienten mit diagnostiziertem Asthma sollen gemäß Stufenschema (siehe Leitlinie) behandelt werden.
Zur medikamentösen Therapie des Asthmas stehen in Abhängigkeit patientenindividueller Faktoren (Alter, Erkrankungsstadium, Begleiterkrankungen) diese Alternativen zur Verfügung:
- Inhalative Kortikosteroide wie Fluticason und Budesonid
- Kurzwirksame Beta-2-Sympathomimetika (SABA) wie Salbutamol und Fenoterol
- Langwirksame Beta-2-Sympathomimetika (LABA) wie Salmeterol und Formoterol
- Leukotrienrezeptor-Antagonisten (LTRA) wie Montelukast
- Langwirksame Muskarinrezeptor-Antagonisten (LAMA) wie Ipratropiumbromid und Tiotropiumbromid
- Anti-IgE-Antikörper wie Omalizumab
- Anti-IL-5-Antikörper wie Mepolizumab, Reslizumab
- Anti-IL-4Rα-Antikörper wie Dupilumab
- EMA: Fachinformation Fasenra
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- NVL Asthma (4. Auflage)
Abbildung
Adapted from „Antibody Targeting in Eosinophil-Associated Diseases”, by BioRender.com
-
Fasenra 30 mg Abacus Injektionslösung in einem Fertigpen
Abacus Medicine A/S
-
Fasenra 30 mg CC Pharma Injektionslösung in einem Fertigpen
CC Pharma GmbH
-
Fasenra 30 mg Eurim Injektionslösung im Fertigpen
Eurim-Pharm Arzneimittel GmbH
-
Fasenra® 30 mg Injektionslösung im Fertigpen
AstraZeneca GmbH GB Spezialvertrieb
-
Fasenra® 30 mg Injektionslösung in einer Fertigspritze
AstraZeneca GmbH GB Spezialvertrieb
-
Fasenra 30 mg kohlpharma Injektionslösung in einem Fertigpen
kohlpharma GmbH
-
Fasenra 30 mg Orifarm Injektionslösung in einem Fertigpen
Orifarm GmbH
-
Fasenra 30 mg Paranova Injektionslösung in einem Fertigpen
Paranova Pack A/S














