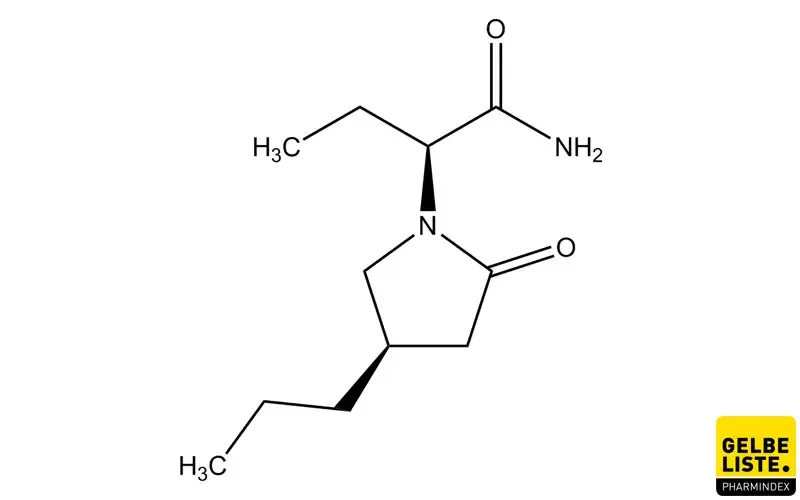
Brivaracetam
Brivaracetam ist ein Wirkstoff aus der Gruppe der Antiepileptika (Antikonvulsiva), der zur Zusatzbehandlung fokaler Anfälle mit oder ohne sekundäre Generalisierung eingesetzt wird.
Brivaracetam: Übersicht
Anwendung
Der antikonvulsive Wirkstoff Brivaracetam (Briviact) ist indiziert zur Zusatzbehandlung fokaler Anfälle mit oder ohne sekundäre Generalisierung bei Erwachsenen, Jugendlichen und Kindern ab 2 Jahren mit Epilepsie.
Anwendungsart
Brivaracetam ist in den Darreichungsformen Filmtablette (10, 25, 50, 100 mg), Lösung zum Einnehmen (10 mg/mL) und Injektions-/Infusionslösung (10 mg/mL) erhältlich. Die Filmtabletten müssen zusammen mit Flüssigkeit eingenommen und als Ganzes geschluckt werden. Die Einnahme kann dabei nahrungsunabhängig erfolgen. Patienten, die die Tabletten nicht als Ganzes schlucken können, oder Patienten, für die die passende Dosis nicht mit ganzen Tabletten zusammengestellt werden kann, sollten die Lösung zum Einnehmen verwenden.
Wirkmechanismus
Brivaracetam ist ein Analogon des ebenfalls antikonvulsiven Wirkstoffes Levetiracetam. Beide Wirkstoffe binden an das synaptische Vesikelprotein 2A (SV2A), ein transmembranäres Glykoprotein, das im zentralen Nervensystem (ZNS) eine elementare Rolle bei der Regulation der Neurotransmitterfreisetzung einnimmt. Brivaracetam bindet dabei selektiver und mit 15- bis 30-fach höherer Affinität an eine andere Bindestelle oder Konformation von SV2A.
Die exakte Funktion des synaptischen Vesikelproteins 2A ist noch nicht vollständig erforscht, wobei postuliert wird, dass SV2A als eine Art Transporter fungiert oder die Exozytose von Transmitter-enthaltenen synaptischen Vesikeln moduliert.
Pharmakokinetik
Allgemein
- Brivaracetam Filmtabletten, Lösung zum Einnehmen und Lösung zur intravenösen Injektion weisen dieselbe AUC auf, während die maximale Plasmakonzentration nach intravenöser Anwendung etwas höher ist.
- Die Pharmakokinetik von Brivaracetam ist linear und zeitunabhängig mit einer niedrigen intra- und interindividuellen Variabilität.
- Die Resorption ist vollständig, die Proteinbindung sehr niedrig und die Ausscheidung über die Nieren erfolgt nach ausgiebiger Biotransformation.
Resorption
- Nach oraler Anwendung wird Brivaracetam rasch und vollständig resorbiert.
- Die absolute Bioverfügbarkeit beträgt etwa 100%.
- tmax für Tabletten, die ohne Nahrung eingenommen werden, beträgt im Median 1 Stunde (tmax-Bereich liegt bei 0,25 bis 3 Stunden).
- Die gleichzeitige Einnahme mit fettreicher Nahrung verlangsamt die Resorptionsrate (im Median tmax 3 Stunden) und reduziert die maximale Plasmakonzentration (37% niedriger) von Brivaracetam, während das Ausmaß der Resorption unverändert bleibt.
Verteilung
- Brivaracetam wird schwach (< 20 %) an Plasmaproteine gebunden.
- Das Verteilungsvolumen beträgt 0,5 L/kg (dieser Wert kommt dem des gesamten Körperwassers recht nahe).
- Aufgrund seiner Lipophilie (Log P) verfügt Brivaracetam über eine hohe Membranpermeabilität.
Metabolismus
- Brivaracetam wird primär über Hydrolyse des Amid-Anteils metabolisiert, wodurch die entsprechende Carbonsäure gebildet wird (etwa 60% der Eliminierung), sowie sekundär über Hydroxylierung der Propylseitenkette (etwa 30% der Eliminierung).
- Die Hydrolyse des Amid-Anteils, die zum Carbonsäure-Metaboliten führt (34% der Dosis im Urin), wird durch hepatische und extrahepatische Amidase unterstützt.
- In vitro wird die Hydroxylierung von Brivaracetam primär über CYP2C19 vermittelt.
- Beide Metaboliten werden weiter zu der gleichen hydroxylierten Säure abgebaut, überwiegend durch Hydroxylierung der Propyl-Seitenkette des Carbonsäure-Metaboliten (hauptsächlich über CYP2C9).
- In vivo ist die Bildung des Hydroxy-Metaboliten bei Probanden mit nicht-funktionalen Mutationen von CYP2C19 um das 10-fache verringert, während Brivaracetam selbst um 22% oder 42% bei Menschen mit einem oder beiden mutierten Allelen erhöht ist.
- Die drei Metaboliten sind pharmakologisch nicht aktiv.
Elimination
- Brivaracetam wird hauptsächlich über Metabolisierung und Ausscheidung mit dem Urin eliminiert.
- Mehr als 95% der Dosis (einschließlich Metaboliten) werden innerhalb von 72 Stunden nach Einnahme mit dem Urin ausgeschieden.
- Weniger als 1% wird über den Stuhl und weniger als 10% Brivaracetam werden unverändert mit dem Urin ausgeschieden.
- Die terminale Halbwertszeit im Plasma (t1/2) beträgt etwa 9 Stunden.
- Die gesamte Plasmaclearance bei Patienten wird auf 3,6 L/h geschätzt.
Linearität/Nicht-Linearität
Die Pharmakokinetik von Brivaracetam verhält sich von 10 mg bis mindestens 600 mg proportional zur Dosis.
Patientenindividuelle Pharmakokinetik
- Nierenfunktionsstörung: Eine Studie bei Probanden mit schwerer Niereninsuffizienz (Kreatinin-Clearance < 30 mL/min/1,73 m² und nicht dialysepflichtig) ergab, dass der AUC-Wert von Brivaracetam im Plasma im Vergleich zu gesunden Probanden mäßig erhöht war (+ 21%), während die AUC-Werte der Säure-, Hydroxy- und Hydroxysäure-Metaboliten um das 3-, 4- bzw. 21-fache erhöht waren. Die renale Clearance dieser nicht-aktiven Metaboliten war um das 10-fache reduziert. Der Hydroxysäure-Metabolit führte in den nicht-klinischen Studien zu keinen Sicherheitsbedenken (Brivaracetam wurde nicht bei Hämodialyse-Patienten untersucht).
- Leberfunktionsstörung: In einer pharmakokinetischen Studie bei Probanden mit Leberzirrhose (Child-Pugh-Klassen A, B und C) wurden vergleichbare Zunahmen der Konzentration von Brivaracetam unabhängig vom Schweregrad der Krankheit (50 %, 57 % und 59 %) im Vergleich zu entsprechenden gesunden Kontrollpersonen gezeigt.
- Körpergewicht: Eine Reduzierung der Steady-State-Plasmakonzentration um 40% wurde über einen Körpergewichtsbereich von 46 kg bis 115 kg geschätzt (dies wird jedoch nicht als klinisch relevanter Unterschied betrachtet).
- Kinder und Jugendliche: Dosen von 5,0 mg/kg/Tag (Körpergewicht 10 kg bis 20 kg) und 4,0 mg/kg/Tag (Körpergewicht 20 kg bis 50 kg) ergeben laut einer Analyse dieselbe durchschnittliche Steady-State-Konzentration im Plasma wie bei Erwachsenen, die 200 mg/Tag erhalten. Die geschätzte Plasma-Clearance beträgt 0,96 L/h, 1,61 L/h, 2,18 L/h bzw. 3,19 L/h bei Kindern mit einem Körpergewicht von 10 kg, 20 kg, 30 kg bzw. 50 kg. Im Vergleich dazu wird die Plasma-Clearance bei erwachsenen Patienten (70 kg Körpergewicht) auf 3,58 L/h geschätzt.
Dosierung
Grundsätzlich sollte der behandelnde Arzt die nach Körpergewicht und Dosis am besten geeignete Darreichungsform und Stärke verordnen. Dabei soll die Dosis 2x täglich in zwei gleich großen Dosen mit einem Abstand von etwa 12 Stunden appliziert werden.
Erwachsene
- Empfohlene Anfangsdosis: 50 mg/Tag oder 100 mg/Tag (basierend auf der ärztlichen Beurteilung der benötigten Anfallsreduktion unter Berücksichtigung möglicher Nebenwirkungen)
- Je nach Ansprechen des einzelnen Patienten und der Verträglichkeit kann die Dosis im effektiven Dosisbereich von 50 mg/Tag bis 200 mg/Tag angepasst werden.
Jugendliche und Kinder mit einem Körpergewicht ab 50 kg
- Empfohlene Anfangsdosis: 50 mg/Tag (basierend auf der ärztlichen Beurteilung der benötigten Anfallskontrolle kann auch mit 100 mg Brivaracetam/Tag begonnen werden)
- Empfohlene Erhaltungsdosis: 100 mg/Tag
- Je nach Ansprechen des einzelnen Patienten kann die Dosis im effektiven Dosisbereich von 50 mg/Tag bis 200 mg/Tag angepasst werden.
Jugendliche und Kinder mit einem Körpergewicht ab 20 kg bis unter 50 kg
- Empfohlene Anfangsdosis: 1 mg/kg/Tag (basierend auf der ärztlichen Beurteilung der benötigten Anfallskontrolle kann auch mit Dosen bis zu 2 mg Brivaracetam/kg/Tag begonnen werden)
- Empfohlene Erhaltungsdosis: 2 mg/kg/Tag
- Je nach Ansprechen des einzelnen Patienten kann die Dosis im effektiven Dosisbereich von 1 mg/kg/Tag bis 4 mg/kg/Tag angepasst werden.
Kinder mit einem Körpergewicht ab 10 kg bis unter 20 kg
- Empfohlene Anfangsdosis: 1 mg/kg/Tag (basierend auf der ärztlichen Beurteilung der benötigten Anfallskontrolle kann auch mit Dosen bis zu 2,5 mg Brivaracetam/kg/Tag begonnen werden)
- Empfohlene Erhaltungsdosis: 2,5 mg/kg/Tag
- Je nach Ansprechen des einzelnen Patienten kann die Dosis im effektiven Dosisbereich von 1 mg/kg/Tag bis 5 mg/kg/Tag angepasst werden.
Vergessene Dosen
- Wenn Patienten eine Dosis oder mehrere Dosen vergessen haben, wird empfohlen, dass sie (sobald es ihnen wieder einfällt) eine Einzeldosis einnehmen und die darauf folgende Dosis zur gewohnten Zeit abends oder morgens einnehmen.
- Dadurch kann verhindert werden, dass die Brivaracetam-Konzentration im Plasma unter den wirksamen Spiegel fällt und dass Durchbruchanfälle auftreten.
Beendigung der Therapie
- Falls Brivaracetam bei Patienten ab 16 Jahren abgesetzt werden muss, sollte dies ausschleichend erfolgen mit einer Verringerung der Tagesdosis um 50 mg pro Woche.
- Falls Brivaracetam bei Patienten unter 16 Jahren abgesetzt werden muss, sollte die Dosis pro Woche maximal um die Hälfte reduziert werden bis eine Dosis von 1 mg/kg/Tag (bei Patienten mit einem Körpergewicht unter 50 kg) beziehungsweise 50 mg/Tag (bei Patienten mit einem Körpergewicht ab 50 kg) erreicht ist.
- Nach einer Woche Behandlung mit 50 mg/Tag wird eine letzte Behandlungswoche mit einer Dosis von 20 mg/Tag empfohlen.
Spezielle Patientenpopulationen
- Eingeschränkte Nierenfunktion: Bei Patienten mit eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich. Aufgrund fehlender Daten wird Brivaracetam bei Patienten mit terminaler Niereninsuffizienz, die eine Dialysebehandlung erhalten, nicht empfohlen. Basierend auf Daten bei Erwachsenen ist bei pädiatrischen Patienten mit eingeschränkter Nierenfunktion keine Dosisanpassung notwendig. Es liegen keine klinischen Daten für pädiatrische Patienten mit eingeschränkter Nierenfunktion vor.
- Eingeschränkte Leberfunktion: Bei erwachsenen Patienten mit chronischer Lebererkrankung ist die Brivaracetam-Konzentration erhöht. Bei Patienten mit eingeschränkter Leberfunktion in allen Stadien werden angepasste Dosen empfohlen (siehe Fachinformation), die aufgeteilt in 2 Dosen mit einem Abstand von etwa 12 Stunden eingenommen werden sollen. Es liegen keine klinischen Daten für pädiatrische Patienten mit eingeschränkter Leberfunktion vor.
Nebenwirkungen
Die am häufigsten berichteten Nebenwirkungen (> 10%) unter Brivaracetam sind:
- Somnolenz
- Schwindel
Diese sind in der Regel leicht bis mäßig ausgeprägt.
Weitere häufige Nebenwirkungen umfassen:
- Influenza
- Verminderter Appetit
- Depression
- Angst
- Insomnie
- Reizbarkeit
- Konvulsion
- Vertigo
- Infektionen der oberen Atemwege
- Husten
- Übelkeit und Erbrechen
- Obstipation
- Fatigue
Die Abbruchrate aufgrund von Nebenwirkungen betrug 3,5%, 3,4% und 4,0% bei Patienten, die Brivaracetam randomisiert in der Dosis 50 mg/Tag, 100 mg/Tag bzw. 200 mg/Tag erhielten und 1,7% bei der Placebo-Gruppe.
Die Nebenwirkungen, die am häufigsten zu einem Abbruch der Brivaracetam-Therapie führten, waren:
- Schwindel (0,8%)
- Konvulsion (0,8%)
Wechselwirkungen
Brivaracetam wird über mehrere Stoffwechselwege abgebaut (einschließlich renale Exkretion, CYP-unabhängige Hydrolyse und CYP-vermittelte Oxidation), weshalb in diesem Zusammenhang potenzielle Wechselwirkungen berücksichtigt werden müssen.
Pharmakokinetische Wechselwirkungen
- In vitro ist Brivaracetam kein Substrat des humanen P-Glykoproteins (P-gp), der Multi-Drug-Resistance-Proteine (MRP) 1 und 2 und der Organischen Anionen-Transporter-Polypeptide 1B1 (OATP1B1) und OATP1B3.
- In-vitro-Untersuchungen haben gezeigt, dass die Verfügbarkeit von Brivaracetam durch CYP-Inhibitoren (z. B. CYP1A, CYP2C8, CYP2C9, CYP2D6 und CYP3A4) nicht signifikant beeinflusst werden sollte.
- Brivaracetam hemmt in vitro nicht CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2D6, CYP3A4 oder die Transporter P-gp, BCRP, BSEP MRP2, MATE-K, MATE-1, OATP1B1, OATP1B3, OAT1 und OCT1 in klinisch relevanten Konzentrationen.
- Brivaracetam 200 mg/Tag kann die Plasmakonzentration von Arzneimitteln, die über OAT3 transportiert werden, erhöhen (in vitro hemmt Brivaracetam OAT3 mit einer mittleren inhibitorischen Konzentration, die 42-fach höher ist als die cmax der klinisch höchsten Dosis).
- Brivaracetam kann die Plasmakonzentration von Arzneimitteln, die über CYP2C19 metabolisiert werden (z.B. Lansoprazol, Omeprazol, Diazepam), erhöhen.
- Brivaracetam kann die Plasmakonzentration von Arzneimitteln, die über CYP2B6 metabolisiert werden (z.B. Efavirenz), erniedrigen.
- Brivaracetam-Plasmakonzentrationen können ansteigen, wenn Brivaracetam gleichzeitig mit starken CYP2C19-Inhibitoren wie Fluconazol und Fluvoxamin angewendet wird (das Risiko einer klinisch bedeutsamen CYP2C19-vermittelten Wechselwirkung wird jedoch als gering betrachtet).
- Es gibt begrenzte klinische Daten, die nahelegen, dass die gleichzeitige Gabe von Cannabidiol die Brivaracetam-Plasmaexposition erhöhen kann (dies geschieht möglicherweise durch die Hemmung von CYP2C19, wobei die klinische Relevanz unklar ist).
- Die gleichzeitige Anwendung mit dem starken Enzyminduktor Rifampicin (600 mg/Tag über 5 Tage) reduziert bei gesunden Probanden die Brivaracetam-AUC um 45%, weshalb der behandelnde Arzt eine Anpassung der Brivaracetam-Dosis in Erwägung ziehen sollte, sobald Patienten eine Behandlung mit Rifampicin beginnen oder beenden.
- Andere starke Enzyminduktoren wie Johanniskraut (Hypericum perforatum) können ebenfalls die systemische Brivaracetam-Konzentration reduzieren, weshalb eine Behandlung mit Johanniskraut mit Vorsicht begonnen bzw. beendet werden sollte.
- Wenn Brivaracetam gleichzeitig mit stark enzyminduzierenden Antiepileptika (Carbamazepin, Phenobarbital, Phenytoin) angewendet wird, sinkt die Brivaracetam-Plasmakonzentration (eine Dosisanpassung ist jedoch nicht erforderlich).
Alkohol
- In einer pharmakokinetischen und pharmakodynamischen Wechselwirkungsstudie zwischen einer Einzeldosis Brivaracetam 200 mg und einer Dauerinfusion von Ethanol 0,6 g/L bei gesunden Probanden trat keine pharmakokinetische Wechselwirkung auf.
- Allerdings verdoppelte Brivaracetam in etwa die Wirkung von Alkohol auf Psychomotorik, Aufmerksamkeit und Gedächtnis, weshalb die gleichzeitige Einnahme von Brivaracetam und Alkohol nicht empfohlen wird.
Andere Antiepileptika
- Mögliche Wechselwirkungen zwischen Brivaracetam (50 mg/Tag bis 200 mg/Tag) und anderen Antiepileptika wurden in einer zusammenfassenden Analyse von Plasma-Arzneimittelkonzentrationen aus sämtlichen Phase 2-3-Studien, in einer Analyse der Populations-Pharmakokinetik der placebokontrollierten klinischen Phase 2-3-Studien und in Arzneimittelinteraktionsstudien (für die Antiepileptika Carbamazepin, Lamotrigin, Phenytoin und Topiramat) untersucht und sind in der Fachinformation tabellarisch zusammengefasst.
- Brivaracetam ist ein mittelstarker, reversibler Inhibitor der Epoxidhydrolase, was zu einer erhöhten Konzentration von Carbamazepinepoxid, einem aktiven Metaboliten von Carbamazepin, führt (in kontrollierten klinischen Studien stieg die Carbamazepinepoxid-Konzentration im Plasma bei geringer Schwankungsbreite im Mittel um 37%, 62% und 98% mit Brivaracetam-Dosen von jeweils 50 mg/Tag, 100 mg/Tag bzw. 200 mg/Tag, wobei keine sicherheitsrelevanten Risiken beobachtet wurden).
Kontraindikationen
Brivaracetam ist kontraindiziert bei Überempfindlichkeit gegen den Wirkstoff, andere Pyrrolidon-Derivate oder sonstige Bestandteile des Arzneimittels.
Schwangerschaft
Risiko in Bezug auf Epilepsie und Antiepileptika im Allgemeinen
- Für alle Antiepileptika wurde gezeigt, dass bei behandelten Frauen mit Epilepsie die Prävalenz von Missbildungen bei Kindern 2-3x höher ist als die entsprechende Zahl von etwa 3% in der Allgemeinbevölkerung.
- In der behandelten Gruppe wurde unter Polytherapie ein Anstieg an Missbildungen festgestellt, wobei jedoch nicht geklärt ist, in welchem Ausmaß die Behandlung und/oder die Grunderkrankung dafür verantwortlich ist.
- Das Absetzen einer antiepileptischen Behandlung kann zu einer Verschlimmerung der Erkrankung führen, die schädlich für die Mutter und das Ungeborene sein könnte.
Risiko in Bezug auf Brivaracetam
- Es liegen nur begrenzte Erfahrungen mit der Anwendung von Brivaracetam bei Schwangeren vor.
- Außerdem liegen keine Erfahrungen zum Plazentatransfer beim Menschen vor (bei Ratten wurde allerdings gezeigt, dass Brivaracetam die Plazenta leicht durchdringt).
- Das potenzielle Risiko für den Menschen ist nicht bekannt.
- Tierexperimentelle Studien ergaben keine Hinweise auf ein teratogenes Potenzial von Brivaracetam.
- Brivaracetam wurde als Zusatzbehandlung in klinischen Studien eingesetzt und bei gleichzeitiger Anwendung mit Carbamazepin führte es zu einer dosisabhängigen Zunahme des aktiven Metaboliten Carbamazepinepoxid (die Datenlage ist zu gering, um die klinische Signifikanz dieser Wirkung auf die Schwangerschaft zu bestimmen).
- Aus Vorsichtsgründen sollte Brivaracetam während der Schwangerschaft nicht angewendet werden, es sei denn, es ist klinisch erforderlich (z.B. wenn der Nutzen für die Mutter eindeutig das potenzielle Risiko für den Fetus übersteigt).
Stillzeit
Es ist nicht bekannt, ob Brivaracetam beim Menschen in die Muttermilch übergeht. Untersuchungen an Ratten haben allerdings gezeigt, dass Brivaracetam in die Milch übergeht. Demnach muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen oder ob die Behandlung mit Brivaracetam zu beenden ist. Dabei ist der Nutzen des Arzneimittels für die Mutter zu berücksichtigen. Im Fall einer gleichzeitigen Anwendung von Brivaracetam und Carbamazepin kann sich die Konzentration des aktiven Metaboliten Carbamazepinepoxid, der in die Muttermilch abgegeben wird, erhöhen (die Datenlage ist zu gering, um die klinische Signifikanz zu bestimmen).
Verkehrstüchtigkeit
Brivaracetam hat einen geringen bzw. mäßigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Wegen möglicher patientenindividueller Unterschiede können bei manchen Patienten Somnolenz, Schwindel und/oder andere Symptome des ZNS auftreten. Daher ist Patienten zu raten, nicht aktiv am Straßenverkehr teilzunehmen oder möglicherweise gefährliche Maschinen zu bedienen, bis sie mit den (Neben-)Wirkungen von Brivaracetam vertraut sind.
Anwendungshinweise
Suizidgedanken und -verhalten
- Suizidgedanken und -verhalten wurden bei Patienten berichtet, die mit Antiepileptika einschließlich Brivaracetam für verschiedene Indikationen behandelt wurden.
- In einer Metaanalyse randomisierter placebokontrollierter klinischer Studien mit Antiepileptika wurde ebenfalls ein leicht erhöhtes Risiko für Suizidgedanken und -verhalten festgestellt.
- Der Mechanismus dieses Risikos ist nicht geklärt und anhand der vorliegenden Daten kann die Möglichkeit eines erhöhten Risikos unter Brivaracetam nicht ausgeschlossen werden.
- Patienten sollten hinsichtlich Anzeichen von Suizidgedanken und -verhalten überwacht und eine geeignete Therapie sollte in Erwägung gezogen werden.
- Patienten (und deren Betreuern) sollte geraten werden, ärztlichen Rat einzuholen, sobald Anzeichen von Suizidgedanken oder -verhalten auftreten.
Eingeschränkte Leberfunktion
- Die Datenlage zur Anwendung von Brivaracetam bei Patienten mit einer vorbestehenden eingeschränkten Leberfunktion ist gering.
- Bei Patienten mit einer eingeschränkten Leberfunktion werden Dosisanpassungen empfohlen (siehe Dosierung und Fachinformation).
Alternativen
Die medikamentösen Therapiealternativen richten sich nach dem Indikationsgebiet bzw. der Anfallsform und sind darüber hinaus abhängig von patientenindividuellen Faktoren wie dem Alter der Patienten, Komorbiditäten oder dem Schweregrad der Erkrankung. Die Pharmakotherapie von Epilepsien bzw. epileptischen Anfällen bietet ein breites Spektrum an alternativen antikonvulsiven Wirkstoffen:
- Benzodiazepine wie Midazolam, Clobazam und Clonazepam
- Carbamazepin, Oxcarbazepin
- Ethosuximid, Mesuximid
- Felbamat
- Gabapentin, Pregabalin
- Lacosamid
- Levetiracetam
- Lamotrigin
- Perampanel
- Phenobarbital
- Phenytoin
- Piracetam
- Primidon
- Rufinamid
- Stiripentol
- Sultiam
- Topiramat
- Valproinsäure
- Vigabatrin
- Zonisamid
Weitere Informationen können der Fachinformation entnommen werden.
Wirkstoff-Informationen
- EMA: Fachinformation Briviact
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- AWMF: Leitlinie Erster epileptischer Anfall und Epilepsien im Erwachsenenalter (2017)
- Feyissa AM. Brivaracetam in the treatment of epilepsy: a review of clinical trial data. Neuropsychiatr Dis Treat. 2019 Sep 9;15:2587-2600. doi: 10.2147/NDT.S143548.
-
Briviact® 10 mg Filmtabletten
UCB Pharma GmbH
-
Briviact® 10 mg/ml Injektions-/Infusionslösung, 5 ml
UCB Pharma GmbH
-
Briviact® 10 mg/ml Lösung zum Einnehmen
UCB Pharma GmbH
-
Briviact® 25 mg Filmtabletten
UCB Pharma GmbH
-
Briviact® 50 mg Filmtabletten
UCB Pharma GmbH
-
Briviact® 75 mg Filmtabletten
UCB Pharma GmbH
-
Briviact® 100 mg Filmtabletten
UCB Pharma GmbH












