Cenobamat
Das Antikonvulsivum Cenobamat wird bei Erwachsenen als adjunktive Behandlung bei fokaler Epilepsie angewendet. Cenobamat wurde in Deutschland zunächst im Härtefallprogramm angewendet und ist seit Juni 2021 regulär in der EU zugelassen.
Cenobamat: Übersicht
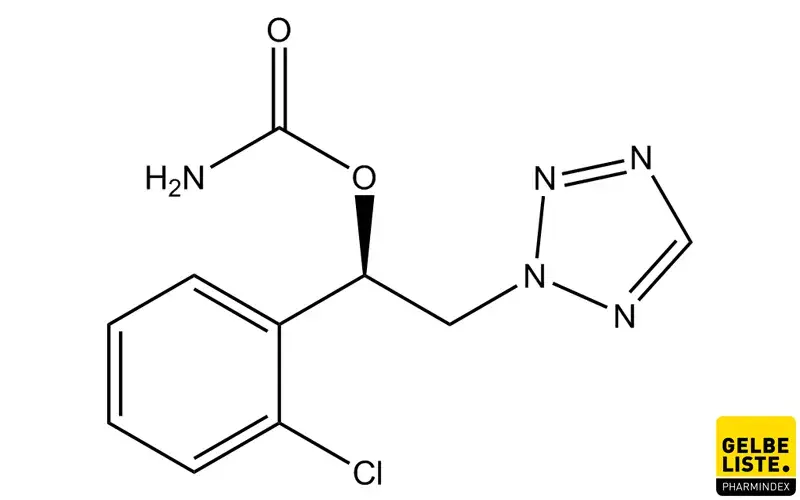
Anwendung
Cenobamat ist ein Antiepileptikum, dass zur adjunktiven Behandlung fokaler Anfälle mit oder ohne sekundäre Generalisierung bei Erwachsenen angewendet wird, die trotz einer vorangegangenen Therapie mit mindestens zwei Antiepileptika nicht ausreichend kontrolliert sind.
Anwendungsart
Das Arzneimittel steht in Form von Tabletten zum Einnehmen zur Verfügung, die in sechs verschiedenen Stärken (12,5 mg, 25 mg, 50 mg, 100 mg, 150 mg, 200 mg) angeboten werden. Cenobamat sollte einmal täglich zu einem beliebigen, aber vorzugsweise immer gleichen Zeitpunkt mit einem Glas Wasser eingenommen werden. Die Anwendung ist unabhängig von der Nahrungsaufnahme. Der Hersteller weist darauf hin, dass die Tabletten nicht dosisgleich teilbar sind.
Wirkmechanismus
Cenobamat hat einen dualen Wirkmechanismus, die genaue therapeutische Wirkung bei fokalen Anfällen ist jedoch nicht bekannt. Der Wirkstoff ist zum einen ein allosterischer Modulator von Subtypen des γ-Aminobuttersäure (GABAA)-Ionenkanals außerhalb der Benzodiazepin-Bindestelle. Zum anderen reduziert Cenobamat das wiederholte neuronale Feuer durch verstärkte Hemmung von Natriumkanälen.
Pharmakokinetik
Resorption
Cenobamat wird nach der Einnahme zu mindestens 88% resorbiert. Die maximalen Plasmakonzentrationen werden innerhalb von 2 bis 4 Stunden erreicht.
Die orale Applikation mit fettreichen Mahlzeiten hat keine signifikante Auswirkung auf das Ausmaß sowie die Rate der Resorption.
Verteilung (Distribution)
Cenobamat wird unabhängig von der Konzentration zu etwa 60% an Plasmaproteine gebunden, primär an humanes Albumin-Protein. Das Verteilungsvolumen nach oraler Anwendung liegt bei 40 bis 50 L.
Metabolismus (Biotransformation)
Cenobamat wird stark metabolisiert. Der primäre Stoffwechselweg ist die Glucuronidierung über UGT2B7 und in geringerem Maße über UGT2B4. Ein kleinerer Anteil des Wirkstoffs wird über das Cytochrom-P450-System metabolisiert. Zu den beteiligten Enzymen zählen CYP2E1, CYP2A6 und CYP2B6 sowie in geringerem Maße CYP2C19 und CYP3A4/5.
Elimination
Cenobamat und seine Metaboliten werden hauptsächlich renal und nur zu etwa 5,2% über die Fäzes eliminiert. Die terminale Halbwertszeit liegt bei 50 bis 60 Stunden. Der Steady State wird nach 14 Tagen erreicht.
Dosierung
Die empfohlene Anfangsdosis von Cenobamat beträgt 12,5 mg täglich und wird alle zwei Wochen schrittweise verdoppelt. Ist eine Dosierung von 100 mg erreicht, wird in 50 mg-Schritten alle zwei Wochen erhöht, bis die empfohlene Zieldosis von 200 mg erreicht ist. Wird keine optimale Anfallskontrolle erreicht, kann auf eine Maximaldosis von 400 mg täglich (Dosiserhöhung 50 mg/Tag alle zwei Wochen) erhöht werden. Der empfohlene Titrationsplan sollte nicht überschritten werden, um schwerwiegende Nebenwirkungen zu vermeiden.
Nieren- und Leberfunktionsstörungen
Patienten mit leichten bis schweren Nierenfunktionsstörungen sollten eine Dosierung von maximal 300 mg Cenobamat erhalten, die Zieldosis muss gegebenenfalls reduziert werden. Patienten mit leichten bis mittelschweren Leberfunktionsstörungen sollten maximal 200 mg Cenobamat täglich erhalten, die Zieldosis muss eventuell um bis zu 50% reduziert werden.
Starke Gewichtsveränderung
Bei Patienten, bei denen Gewichtsveränderungen von ≥30% ihres ursprünglichen Körpergewichts auftreten, müssen möglicherweise Anpassungen der Cenobamat-Dosis in Betracht gezogen werden.
Nebenwirkungen
Die folgenden Nebenwirkungen könnten bei der Behandlung mit Cenobamat häufig (≥1/100, <1/10) bis sehr häufig (≥ 1/10) auftreten.
- Somnolenz, Anomalien der Koordination und des Gangs, Kopfschmerzen
- Verwirrtheitszustand, Reizbarkeit
- Dysarthrie, Nystagmus, Aphasie, eingeschränktes Erinnerungsvermögen
- Obstipation, Diarrhoe, Übelkeit, Erbrechen, Mundtrockenheit
- Ausschlag
- Erhöhte Leberenzyme
Wechselwirkungen
Die folgenden Wechselwirkungen sollten bei der Anwendung von Cenobamat berücksichtigt werden.
- ZNS-Depressiva wie Benzodiazepine, Barbiturate, Alkohol u.a.: erhöhtes Risiko neurologischer Nebenwirkungen, wenn möglich Dosisreduktion der Hypnotika
Wechselwirkungen mit anderen Antiepileptika
- Phenytoin, Phenobarbital: erhöhte Plasmaspiegel möglich, Überwachung der Konzentration bei Titration von Cenobamat und evtl. Dosisreduktion
- Clobazam: erhöhte Exposition des aktiven Clobazam-Metaboliten möglich durch CYP3A4-Induktion und CYP2C19-Hemmung, evtl. Dosisreduktion
- Lamotrigin: ggf. Dosiserhöhung von Cenobamat nötig
Die gleichzeitige Anwendung mit anderen als den oben genannten Antiepileptika (Valproinsäure, Lacosamid, Levetiracetam, Oxcarbazepin) wurde in pharmakometrischen Analysen untersucht. Es konnte keine klinisch relevante Wechselwirkung mit Cenobamat festgestellt werden.
Wechselwirkungen durch Interaktion mit Enzymen und Transportern
- CYP3A4- und CYP2B6-Substrate: es kann eine Erhöhung der Dosis der Substrate erforderlich sein, bei Einnahme oraler Kontrazeptiva sollte Frauen eine zusätzliche oder alternative nicht-hormonelle Verhütungsmethode anwenden
- CYP2C19-Substrate: es kann eine Dosisreduktion bei gleichzeitiger Anwendung mit Cenobamat erforderlich sein
- OAT3-Substrate (Baricitinib, Cefaclor, Empagliflozin, Benzylpenicillin, Ritobegron, Sitagliptin u.a.): Hemmung des OAT3-Transporters durch Cenobamat, daher erhöhte Exposition der Substrate möglich
Kontraindikation
Die Behandlung mit Cenobamat ist in den folgenden Fällen kontraindiziert.
- Überempfindlichkeit gegen den Wirkstoff
- Familiäres Short-QT-Syndrom
Bei terminaler Niereninsuffizienz, Hämodialyse und schweren Leberfunktionsstörungen sollte Cenobamat nicht angewendet werden.
Schwangerschaft
Bisher liegen nur sehr wenige Daten zur Anwendung von Cenobamat in der Schwangerschaft vor. Die Prävalenz für Missbildungen der Neugeborenen ist bei Frauen unter antikonvulsiver Therapie ist mit 3% etwa dreimal so hoch, wie in der Allgemeinbevölkerung. Ob die Ursache dabei in der Erkrankung oder der Medikation liegt, ist bisher nicht eindeutig geklärt. Ein Abbruch der Therapie kann zu einer Verschlimmerung der Epilepsie führen, was für Mutter und Kind schädlich sein kann. Tierexperimentelle Studien zeigten die Plazentagängigkeit und Reproduktionstoxizität von Cenobamat. Der Wirkstoff darf daher in der Schwangerschaft nicht angewendet werden, es sei denn der klinische Zustand der Mutter macht dies erforderlich.
Stillzeit
Es ist nicht bekannt, ob Cenobamat in die menschliche Muttermilch übergeht, allerdings wurde die Exkretion in die Muttermilch in Tierstudien beobachtet. Aus diesem Grund kann ein Risiko für den Säugling nicht ausgeschlossen werden. Bei der Behandlung mit Cenobamat sollte das Stillen daher unterbrochen werden.
Verkehrstüchtigkeit
Cenobamat hat einen mäßigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Unter der Therapie können unerwünschte Wirkungen wie Schläfrigkeit, Schwindel, Müdigkeit, Sehstörungen und andere ZNS-Symptome verursacht werden, die die Verkehrstüchtigkeit einschränken können. Den Patienten wird daher empfohlen, kein Fahrzeug zu führen, keine komplexen Maschinen zu bedienen oder anderen potenziell gefährlichen Tätigkeiten nachzugehen, bis bekannt ist, ob Cenobamat ihre Fähigkeit zur Ausführung dieser Aufgaben beeinträchtigt.
Anwendungshinweise
Frauen im gebärfähigen Alter müssen während der Behandlung mit Cenobamat und bis zu 4 Wochen nach Beendigung der Behandlung eine zuverlässige Verhütungsmethode anwenden.
DRESS
Selten kann das Syndrom der Arzneimittelreaktionen mit Eosinophilie und systemischen Symptomen (Drug Rash with Eosinophilia and Systemic Symptoms, DRESS) auftreten. Dies wurde innerhalb der ersten zwei bis vier Wochen nach Beginn der Cenobamat-Einnahme mit hohen Anfangsdosen (50 mg oder 100 mg einmal täglich) sowie wöchentlicher oder schnellerer Titration in drei Fällen beobachtet. In einer offenen Sicherheitsstudie mit 1340 Patienten, in der mit der niedrigsten Dosis begonnen und der Wirkstoff alle zwei Wochen titriert wurde, konnten keine Fälle von DRESS beobachtet werden. Dennoch sollten Patienten zu Beginn der Therapie auf die Symptome von DRESS aufmerksam gemacht und engmaschig auf Hautreaktionen überwacht werden.
Suizidgedanken
Die Möglichkeit eines erhöhten Risikos für Suizidgedanken und suizidales Verhalten unter der Therapie mit Cenobamat kann nicht ausgeschlossen werden. Pateinten und deren Betreuer sollten daher ärztlichen Rat einholen, falls entsprechende Anzeichen auftreten.
Alternativen
Die meisten Antiepileptika unterschieden sich nicht wesentlich in ihrer Wirksamkeit, weshalb die Auswahl des Wirkstoffs bei fokalen Epilepsien vor allem anhand der individuellen Situation eines Patienten erfolgt. Mittel der ersten Wahl sind Lamotrigin und Levetiracetam, wobei letzteres bei unzureichender Wirksamkeit mit allen zugelassenen Antikonvulsiva kombiniert werden kann. In anderen Fällen müssen Wechselwirkungen, insbesondere in Bezug auf Enzyminduktion und -hemmung beachtet werden. Können die Anfälle durch die erste Monotherapie nicht ausreichend kontrolliert werden, wird entweder eine weitere Mono- oder eine Kombinationstherapie durchgeführt. Neben Cenobamat stehen bei fokalen Anfällen die folgenden Antiepileptika als Add-on-Therapie zur Verfügung.
- Brivaracetam
- Eslicarbazepinacetat
- Perampanel
- Pregabalin
- Acetazolamid
- Mesuximid
- Retigabin
- Sultiam
- Vigabatrin
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
- EMA: Fachinformation Ontozry
- Elger C.E., Berkenfeld R. (geteilte Erstautorenschaft) et al. S1-Leitlinie Erster epileptischer Anfall und Epilepsien im Erwachsenenalter. 2017. In: Deutsche Gesellschaft für Neurologie, Hrsg. Leitlinien für Diagnostik und Therapie in der Neurologie (abgerufen am 13.07.2021)
- Geisslinger, Menzel, Gundermann, Hinz, Ruth (2020) Mutschler Arzneimittelwirkungen, 11. Auflage, Wissenschaftliche Verlagsgesellschaft Stuttgart
-
Ontozry 12,5 mg Tabletten + 25 mg Filmtabletten CC Pharma Starterpackung
CC Pharma GmbH
-
Ontozry 12,5 mg Tabletten + 25 mg Filmtabletten Eurim, Starterpackung
Eurim-Pharm Arzneimittel GmbH
-
Ontozry 12,5 mg Tabletten + 25 mg Filmtabletten kohlpharma, Starterpackung
kohlpharma GmbH
-
Ontozry 12,5 mg Tabletten + 25 mg Filmtabletten Orifarm, Starterpackung
Orifarm GmbH
-
Ontozry 12,5 mg Tabletten + 25 mg Filmtabletten, Starterpackung
Angelini Pharma S.p.A.
-
Ontozry 50 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Ontozry 50 mg Emra Filmtabletten
Emra-Med Arzneimittel GmbH
-
Ontozry 50 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
Ontozry 50 mg Filmtabletten
Angelini Pharma S.p.A.
-
Ontozry 50 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Ontozry 50 mg Orifarm Filmtabletten
Orifarm GmbH
-
Ontozry 100 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Ontozry 100 mg Emra Filmtabletten
Emra-Med Arzneimittel GmbH
-
Ontozry 100 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
Ontozry 100 mg Filmtabletten
Angelini Pharma S.p.A.
-
Ontozry 100 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Ontozry 150 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
Ontozry 150 mg Filmtabletten
Angelini Pharma S.p.A.
-
Ontozry 150 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Ontozry 150 mg Orifarm Filmtabletten
Orifarm GmbH
-
Ontozry 200 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Ontozry 200 mg Emra Filmtabletten
Emra-Med Arzneimittel GmbH
-
Ontozry 200 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
Ontozry 200 mg Filmtabletten
Angelini Pharma S.p.A.
-
Ontozry 200 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Ontozry 200 mg Orifarm Filmtabletten
Orifarm GmbH











