Dabrafenib
Der Wirkstoff Dabrafenib ist ein selektiver, reversibler Inhibitor der RAF-Kinasen und wird angewendet als Monotherapie oder in Kombination mit Trametinib zur Behandlung eines nicht-resezierbaren oder metastasierten Melanoms sowie zur Behandlung des fortgeschrittenen nicht-kleinzelligen Lungenkarzinoms.
Dabrafenib: Übersicht
Anwendung
Dabrafenib (Tafinlar) besitzt folgende Indikationen:
- Monotherapie oder in Kombination mit Trametinib (Mekinist) zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation
- in Kombination mit Trametinib zur adjuvanten Behandlung von erwachsenen Melanom-Patienten im Stadium III mit einer BRAF-V600-Mutation nach vollständiger Resektion
- in Kombination mit Trametinib zur Behandlung von erwachsenen Patienten mit fortgeschrittenem nicht-kleinzelligen Lungenkarzinom mit einer BRAF-V600-Mutation.
Wirkmechanismus
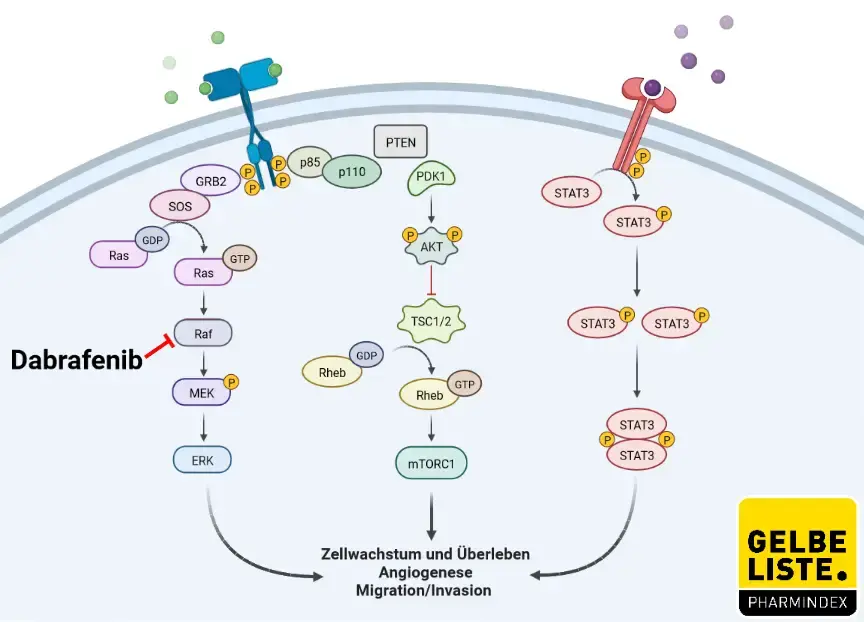
Dabrafenib ist ein selektiver, reversibler Inhibitor der RAF-Kinasen, einer Familie von Proteinkinasen, welche die Isoformen A-Raf, B-Raf und C-Raf umfasst. RAF-Kinasen sind an der RAS-RAF-MEK-ERK-Signaltransduktionskaskade beteiligt, die auch als MAPK-Kaskade (Mitogen-Activated Protein Kinase) bezeichnet wird. Onkogene Mutationen im B-RAF-Protein führen zu einer konstitutiven Aktivierung der RAS-RAF-MEK-ERK-Signaltransduktionskaskade und werden sehr häufig bei spezifischen Tumoren identifiziert, einschließlich bei ungefähr 50% der Melanome. V600E ist die am häufigsten beobachtete B-RAF-Mutation, die für ungefähr 90% aller B-RAF-Mutationen steht, die bei Melanomen gesehen wurden. Die B-RAF-Mutation ist zudem bei 1–2% aller nicht-kleinzelligen Lungenkarzinome (NSCLC) zu finden und am häufigsten in Codon 600 lokalisiert.
Während Dabrafenib die BRAF-Kinase selbst inhibiert, greift Trametinib an deren Substrat an: den Mitogen-aktivierten, über extrazelluläre Signale regulierten Kinasen (MEK1 und MEK2).
Der Wirkmechanismus der Dabrafenib-Trametinib-Kombination unterscheidet sich von dem aller anderen für das NSCLC zugelassenen Therapien: Während die Dabrafenib-Trametinib-Kombinationstherapie direkt, zielgerichtet und selektiv auf BRAF-V600-mutierte Tumorzellen wirkt, greifen andere zugelassene Therapien entweder unspezifisch alle proliferierenden Zellen an (Chemotherapeutika) oder wirken über eine indirekte Hemmung der Tumorangiogenese (Nintedanib, Ramucirumab) bzw. die gegen den Tumor gerichtete Immunreaktion (Nivolumab, Pembrolizumab).
Pharmakokinetik
Resorption
Dabrafenib wird mit einer medianen Zeit bis zur maximalen Plasmakonzentration von 2 Stunden nach Gabe oral resorbiert. Die mittlere absolute Bioverfügbarkeit von oral gegebenem Dabrafenib beträgt 95% (90 %-KI: 81; 110). Die Dabrafenib-Exposition (Cmax und AUC) steigt nach Einzelgabe von 12 bis 300 mg Dosisproportional an, der Anstieg nach wiederholter zweimal täglicher Gabe ist allerdings geringer als dosisproportional. Eine Abnahme der Exposition wurde nach wiederholter Gabe beobachtet, wahrscheinlich durch Induktion der eigenen Metabolisierung. Die mittlere Akkumulation anhand des AUC-Verhältnisses am Tag 18/Tag 1 betrug 0,73. Nach Gabe von 150 mg zweimal täglich betrugen die geometrischen Mittel von Cmax, AUC(0-τ) und die Konzentration vor der nächsten Dosis (Cτ) 1478 ng/ml, 4341 ng*h/ml bzw. 26 ng/ml.
Die Gabe von Dabrafenib mit dem Essen verringerte die Bioverfügbarkeit (Cmax und AUC fielen um 51% bzw. 31% ab) und verzögerte die Resorption von Dabrafenib-Kapseln im Vergleich zur Nüchtern-Gabe.
Verteilung
Dabrafenib bindet zu 99,7% an menschliche Plasmaproteine. Das Verteilungsvolumen im Steady State beträgt 46 l nach Gabe einer intravenösen Mikrodosis.
Biotransformation
Die Verstoffwechselung von Dabrafenib verläuft primär über CYP2C8 und CYP3A4 unter Bildung von Hydroxy-Dabrafenib, das weiter zum Carboxy-Dabrafenib über CYP3A4 oxidiert wird. Carboxy-Dabrafenib kann zum Desmethyl-Dabrafenib über einen nicht-enzymatischen Prozess decarboxyliert werden. Carboxy-Dabrafenib wird sowohl über die Galle als auch über den Urin ausgeschieden.
Desmethyl-Dabrafenib kann auch im Darm gebildet und rückresorbiert werden. Desmethyl-Dabrafenib wird durch CYP3A4 zu oxidativen Metaboliten verstoffwechselt. Die terminale Halbwertszeit von Hydroxy-Dabrafenib entspricht der der Muttersubstanz mit einer Halbwertszeit von 10 h, während die Carboxy- und Desmethyl-Metaboliten längere Halbwertszeiten (21 bis 22 Stunden) vorweisen. Die mittleren AUC-Verhältnisse von Metaboliten zur Muttersubstanz nach wiederholter Gabe betrugen 0,9,11 und 0,7 für Hydroxy-, Carboxy- und Desmethyl-Dabrafenib. Basierend auf der Exposition, der relativen Wirkstärke und den pharmakokinetischen Eigenschaften tragen sowohl Hydroxy- als auch Desmethyl-Dabrafenib wahrscheinlich zur klinischen Aktivität von Dabrafenib bei, dagegen entfaltet Carboxy-Dabrafenib wahrscheinlich keine signifikante Aktivität.
Elimination
Die terminale Halbwertszeit von Dabrafenib nach einer einzelnen intravenösen Mikrodosis beträgt 2,6 Stunden. Die terminale Halbwertszeit von Dabrafenib nach einer oralen Einzeldosis beträgt 8 Stunden auf Grund einer resorptionsbegrenzenden Elimination nach oraler Gabe („Flip-Flop“-Pharmakokinetik). Die Plasma-Clearance nach intravenöser Gabe beträgt 12 l/h. Nach einer oralen Dosis läuft der Haupteliminationsweg von Dabrafenib über die Metabolisierung via CYP3A4 und CYP2C8. Von Dabrafenib abstammendes Material wird vorwiegend über den Stuhl ausgeschieden, wobei 71% einer oralen Dosis im Stuhl wiedergefunden wurden; 23% der Dosis wurde nur in Form von Metaboliten im Urin wiedergefunden.
Dosierung
Die empfohlene Dosis von Dabrafenib, sowohl in der Monotherapie als auch in Kombination mit Trametinib, beträgt 150 mg (zwei 75-mg-Kapseln) zweimal täglich (entsprechend einer Tagesgesamtdosis von 300 mg). Die empfohlene Trametinib-Dosis in Kombination mit Dabrafenib beträgt 2 mg einmal täglich.
Wegen des Nahrungseinflusses auf die Resorption von Dabrafenib sollte Dabrafenib in Kombination mit Trametinib mindestens eine Stunde vor oder frühestens zwei Stunden nach einer Mahlzeit eingenommen werden.
Nebenwirkungen
Zu den häufigsten Nebenwirkungen von Dabrafenib gehören Befindlichkeitsstörungen wie grippeähnliche Symptome und Magen-Darm-Beschwerden sowie Kopfschmerzen, Schwindel, Haarausfall, Muskel- und Gelenkschmerzen. Schwerwiegendere gelegentlich auftretende Nebenwirkungen von Dabrafenib sind Hautkrebs-Formen wie Plattenepithelkarzinome und Basalzellkarzinome, Nieren- und Lebenfunktionsstörungen Augapfelentzündungen, Bauchspeicheldrüsenentzündungen und Herzrhythmusstörungen (QT-Verlängerungen).
Wechselwirkungen
Wirkungen anderer Arzneimittel auf Dabrafenib
Dabrafenib ist ein Substrat der metabolisierenden Enzyme CYP2C8 und CYP3A4, während die aktiven Metaboliten Hydroxy-Dabrafenib und Desmethyl-Dabrafenib CYP3A4-Substrate sind. Arzneimittel, die starke Inhibitoren oder Induktoren von CYP2C8 und CYP3A4 sind, können wahrscheinlich die Dabrafenib-Konzentration entsprechend erhöhen bzw. erniedrigen.
Arzneimittel wie Protonenpumpeninhibitoren, die die Magensäuresekretion hemmen und damit den pH-Wert im Magen erhöhen, können die Löslichkeit von Dabrafenib verringern und seine Bioverfügbarkeit reduzieren.
Wirkungen von Dabrafenib auf andere Arzneimittel
Dabrafenib ist ein starker Enzyminduktor und erhöht die Synthese vieler Arzneimittel-metabolisierender Enzyme, wie CYP3A4, die CYP2C und CYP2B6, sowie Transportproteine. Dies führt zu erniedrigten Plasmakonzentrationen vieler über diese Enzyme verstoffwechselter Arzneimittel und kann den Transport einiger Arzneimittel beeinflussen. Die Reduktion der Plasmakonzentrationen kann zum Verlust oder zu einer verringerten klinischen Wirkung dieser Arzneimittel führen. Es gibt auch ein Risiko einer verstärkten Bildung aktiver Metaboliten dieser Arzneimittel. Enzyme, die induziert werden können, umfassen CYP3A in Leber und Darm, CYP2B6, CYP2C8, CYP2C9, CYP2C19 und UGTs (Glucuronid-konjugierende Enzyme). Das Transportprotein P-gp kann ebenfalls induziert werden, wie auch andere Transportproteine wie z. B. MRP-2. Eine Induktion von OATP1B1/1B3 und BCRP ist anhand von Beobachtungen in einer klinischen Studie mit Rosuvastatin unwahrscheinlich.
Die Gabe von 150 mg Dabrafenib zweimal täglich mit Warfarin führte zu einer Verringerung der AUC von S- und R-Warfarin von 37% beziehungsweise 33% im Vergleich zur alleinigen Gabe von Warfarin. Die Cmax von S- und R-Warfarin stieg um 18% beziehungsweise 19% an.
Wechselwirkungen sind mit vielen Arzneimitteln zu erwarten, die über Verstoffwechselung oder mittels aktiven Transports eliminiert werden. Falls deren therapeutische Wirkung von großer Bedeutung für den Patienten ist und Dosisanpassungen nicht einfach auf Basis der Überwachung der Wirksamkeit oder von Plasmakonzentrationen durchgeführt werden können, sind diese Arzneimittel zu vermeiden oder nur mit Vorsicht anzuwenden.
Es wird vermutet, dass das Risiko für eine Leberschädigung nach Gabe von Paracetamol möglicherweise bei Patienten höher ist, die gleichzeitig mit Enzyminduktoren behandelt werden.
Die Zahl der von möglichen Wechselwirkungen betroffenen Arzneimittel wird als sehr hoch eingeschätzt, obwohl die Größenordnung der Wechselwirkungen variieren kann.
Gruppen von möglicherweise betroffenen Arzneimitteln beinhalten, sind aber nicht beschränkt auf:
- Analgetika (z.B. Fentanyl, Methadon)
- Antibiotika (z.B. Clarithromycin, Doxycyclin)
- Antineoplastische Arzneimittel (z.B. Cabazitaxel)
- Antikoagulanzien (z.B. Acenocoumarol, Warfarin)
- Antiepileptika (z.B. Carbamazepin, Phenytoin, Primidon, Valproinsäure)
- Antipsychotika (z.B. Haloperidol)
- Kalziumkanalblocker (z.B. Diltiazem, Felodipin, Nicardipin, Nifedipin, Verapamil)
- Herzglykoside (z.B. Digoxin)
- Kortikosteroide (z.B. Dexamethason, Methylprednisolon)
- Antivirale Mittel gegen HIV (z.B. Amprenavir, Atazanavir, Darunavir, Delavirdin, Efavirenz, Fosamprenavir, Indinavir, Lopinavir, Nelfinavir, Saquinavir, Tipranavir)
- Hormonelle Kontrazeptiva
- Hypnotika (z.B. Diazepam, Midazolam, Zolpidem)
- Immunsuppressiva (z.B. Ciclosporin, Tacrolimus, Sirolimus)
- Statine, die über CYP3A4 verstoffwechselt werden (z.B. Atorvastatin, Simvastatin)
Wirkung von Dabrafenib auf Stoff-Transportsysteme
Dabrafenib ist in vitro ein Inhibitor der humanen Transport-Polypeptide für organische Anionen (OATP) 1B1 (OATP1B1), OATP1B3 und BCRP. Nach gemeinsamer Anwendung einer Einzeldosis Rosuvastatin (einem OATP1B1-, OATP1B3- und BCRP-Substrat) mit wiederholten Dosen Dabrafenib 150 mg zweimal täglich bei 16 Patienten war Cmax von Rosuvastatin auf das 2,6-Fache erhöht, während die AUC nur minimal verändert war (Anstieg um 7%). Es ist unwahrscheinlich, dass der Anstieg der Cmax von Rosuvastatin klinisch relevant ist.
Einfluss von Nahrung auf Dabrafenib
Wegen des Nahrungseinflusses auf die Resorption von Dabrafenib sollten Patienten Dabrafenib sowohl als Monotherapie als auch in Kombination mit Trametinib mindestens eine Stunde vor oder frühestens zwei Stunden nach einer Mahlzeit einnehmen.
Kontraindikationen
Dabrafenib darf nicht bei bekannter Überempfindlichkeit gegen den Wirkstoff eingenommen werden.
Schwangerschaft
Frauen im gebärfähigen Alter müssen während und bis 4 Wochen nach Beendigung der Behandlung mit Dabrafenib und bis 4 Monate nach der letzten Dosis von Trametinib bei Gabe in Kombination mit Dabrafenib eine zuverlässige Verhütungsmethode anwenden. Dabrafenib kann die Wirksamkeit hormoneller Kontrazeptiva verringern, daher sollte eine andere Verhütungsmethode wie eine Barrieremethode angewendet werden.
Es liegen keine Erfahrungen mit der Anwendung von Dabrafenib bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität und ungünstige Wirkungen auf die embryofötale Entwicklung einschließlich teratogener Wirkungen gezeigt. Dabrafenib darf während der Schwangerschaft nicht angewendet werden, es sei denn, der mögliche Nutzen für die Mutter überwiegt das mögliche Risiko für den Fötus. Sollte die Patientin unter der Behandlung mit Dabrafenib schwanger werden, muss die Patientin über das potenzielle Risiko für den Fötus informiert werden.
Stillzeit
Es ist nicht bekannt, ob Dabrafenib in die Muttermilch übergeht. Ein Risiko für den Säugling kann nicht ausgeschlossen werden. Es muss eine Entscheidung getroffen werden, ob das Stillen zu unterbrechen ist oder ob die Behandlung mit Dabrafenib zu unterbrechen ist. Dabei soll sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Mutter berücksichtigt werden.
Verkehrstüchtigkeit
Dabrafenib hat einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Der klinische Zustand des Patienten und das Nebenwirkungsprofil von Dabrafenib sollten bei der Beurteilung der Fähigkeit des Patienten, Tätigkeiten zu verrichten, die Urteilsvermögen, motorische oder kognitive Fertigkeiten erfordern, in Betracht gezogen werden. Die Patienten sollten darauf hingewiesen werden, dass das mögliche Auftreten von Abgeschlagenheit und Augenproblemen diese Aktivitäten beeinträchtigen kann.
Anwendungshinweise
Bei Auftreten folgender Nebenwirkungen/Zustände sind Überwachungsmaßnahmen, ggf. mit Dosisreduktion, Unterbrechung oder Abbruch der Behandlung, erforderlich:
- Kutanes Plattenepithelkarzinom
- Neue primäre Melanome
- Nicht kutane maligne Erkrankungen
- Blutungen
- Sehstörungen
- Pyrexie
- Verringerung der LVEF/ linksventrikuläre Dysfunktion
- Nierenversagen
- Hepatische Ereignisse
- Bluthochdruck
- ILK/ Pneumonitis
- Hautausschlag
- Rhabdomyolyse
- Pankreatitis
- Tiefe Venenthrombose/ Lungenembolie
- Fachinformation Tafinlar
- IQWIG: Melanom: Dabrafenib und Trametinib haben Zusatznutzen
Abbildung
Adapted from „ PI3K/Akt, RAS/MAPK, JAK/STAT Signaling”, by BioRender.com
-
Finlee® 10 mg Tabletten zur Herstellung einer Suspension zum Einnehmen
Novartis Pharma GmbH
-
Tafinlar® 50 mg Hartkapseln
Novartis Pharma GmbH
-
Tafinlar 75 mg Abacus Hartkapseln
Abacus Medicine A/S
-
Tafinlar 75 mg CC-Pharma Hartkapseln
CC Pharma GmbH
-
Tafinlar® 75 mg Hartkapseln
Novartis Pharma GmbH
-
Tafinlar 75 mg kohlpharma Hartkapseln
kohlpharma GmbH
-
Tafinlar 75 mg Orifarm Hartkapseln
Orifarm GmbH












