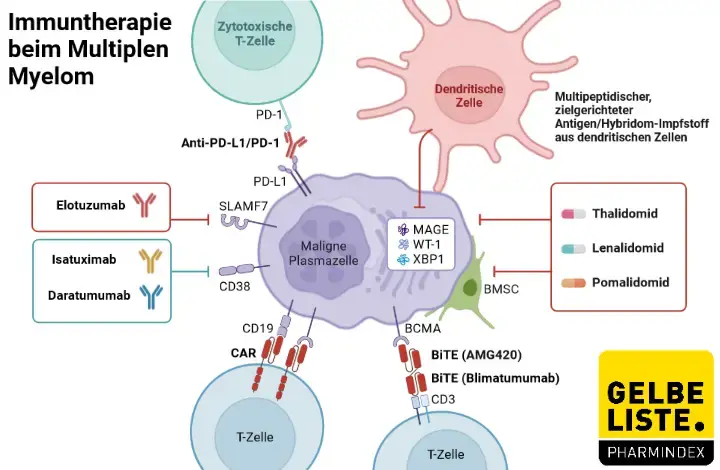
Daratumumab
Daratumumab ist ein monoklonaler Antikörper, der zur Behandlung von Patienten mit der seltenen Erkrankung multiples Myelom eingesetzt wird. Der Wirkstoff bindet an das Glykoprotein CD38 auf Tumorzellen wodurch über verschiedene Mechanismen ein Zelltod ausgelöst wird.
Daratumumab : Übersicht
Anwendung
Der Antikörper Daratumumab wird angewendet für die Behandlung erwachsener Patienten mit:
- neu diagnostiziertem multiplen Myelom in Kombination mit Bortezomib, Melphalan und Prednison, die für eine autologe Stammzelltransplantation nicht geeignet sind.
- rezidiviertem und refraktärem multiplen Myelom als Monotherapie, die bereits mit einem Proteasom-Inhibitor und einem Immunmodulator behandelt wurden und die während der letzten Therapie eine Krankheitsprogression zeigten.
- multiplem Myelom in Kombination mit Lenalidomid und Dexamethason oder Bortezomib und Dexamethason, die bereits mindestens eine Therapie erhalten haben.
Daratumumab soll nur von medizinischem Fachpersonal verabreicht werden und auch nur dann, wenn eine Ausrüstung zur Wiederbelebung verfügbar ist. Vor und nach der Infusion von Daratumumab soll eine entsprechende Medikation zur Risikoreduktion infusionsbedingter Reaktionen mit Antihistaminika, Antipyretika und Kortikoiden durchgeführt werden.
Wirkmechanismus
Daratumumab ist ein humaner monoklonaler IgG1κ-Antikörper (mAb). Der Wirkstoff bindet an das Glykoprotein CD38, das auf den Tumorzellen des multiplen Myeloms überexprimiert wird. Das CD38-Protein spielt eine Rolle bei der rezeptorvermittelten Zelladhäsion, Signalübertragung und der enzymatischen Aktivität. Eine Bindung von Daratumumab führt schließlich über mehrere Mechanismen zum Tod der Tumorzellen.
Pharmakokinetik
Die maximalen Serumkonzentrationen (Cmax) stiegen in den Kohorten mit 1 bis 24 mg/kg Körpergewicht nach der ersten Dosis proportional zur Dosis an. Das Verteilungsvolumen war konsistent mit einer initialen Verteilung in das Plasmakompartiment. Aufgrund der Zielstruktur-vermittelten Arzneimittelverteilung stieg die cmax mehr als dosisproportional an. Die Area under the Curve (AUC) war mehr als dosisproportional und die Clearance nahm mit steigender Dosis ab. Diese Beobachtungen sind ein Hinweis darauf, dass CD38 in höheren Dosen möglicherweise gesättigt wird, wodurch der Einfluss der Zielstruktur-Bindung auf die Clearance minimiert wird und sich die Daratumumab-Clearance der linearen Clearance von endogenem IgG1 nähert. Bei wiederholten Dosen nahm die Clearance ab, vermutlich aufgrund der Abnahme der Tumorlast. Mit steigender Dosis und wiederholter Gabe nahm außerdem die terminale Halbwertszeit zu. Die Halbwertszeit lag bei etwa 18 Tagen.
Dosierung
Je nach Indikation bestehen unterschiedliche Dosierungsempfehlungen, die der jeweiligen Fachinformation entnommen werden können.
Nebenwirkungen
Die häufigsten Nebenwirkungen (≥ 20 Prozent) in klinischen Studien waren:
- infusionsbedingte Reaktionen
- Fatigue
- Übelkeit
- Diarrhö
- Muskelspasmen
- Pyrexie
- Husten
- Neutropenie
- Thrombozytopenie
- Anämie
- periphere sensorische Neuropathie
- Infektion der oberen Atemwege
Schwerwiegende Nebenwirkungen waren:
- Pneumonie
- Infektion der oberen Atemwege
- Lungenödem
- Influenza
- Pyrexie
- Diarrhö
- Vorhofflimmern
Infusionsbedingte Reaktionen
Daratumumab kann schwere infusionsbedingte Reaktionen einschließlich anaphylaktischer Reaktionen auslösen. Vier Prozent aller Patienten hatten bei mehr als einer Infusion eine IRR. Zu den schweren IRR zählten:
- Bronchospasmus
- Hypoxie
- Dyspnoe
- Hypertonie
- Larynxödem
- Lungenödem
Symptome waren hauptsächlich:
- verstopfte Nase
- Husten
- Rachenreizung
- Schüttelfrost
- Erbrechen
- Übelkeit
Wechselwirkungen
Bei einer Anwendung von Daratumumab kann es zu Wechselwirkungen kommen mit:
- indirektem Antiglobulin-Test (Coombs-Test) > Daratumumab bindet an CD38 auf Erythrozyten und beeinflusst Kompatibilitätstests, einschließlich Antikörperscreening und Kreuzproben.
- Serum-Protein Elektrophorese (SPE) und Immunfixations-Assays (IFE) > Daratumumab kann durch SPE und IFE detektiert werden, die zur Überwachung krankheitsbedingter monoklonaler Immunglobuline angewendet werden. Es kann zu falsch positiven Ergebnissen der SPE und IFE-Assays bei Patienten mit IgGkappa-Myelomprotein kommen, was die initiale Bewertung des vollständigen Ansprechens nach den Kriterien der International Myeloma Working Group (IMWG) beeinflusst.
Es ist nicht zu erwarten, dass Arzneimittel mit Einfluss auf metabolisierende Enzyme die Elimination von Daratumumab beeinträchtigen.
Es gibt keine Hinweise darauf, dass zwischen Daratumumab, Pomalidomid, Thalidomid und Bortezomib pharmakokinetische Arzneimittelwechselwirkungen bestehen.
Schwangerschaft
Es ist bekannt, ob monoklonale IgG1-Antikörper nach dem ersten Schwangerschaftstrimester die Plazentaschranke passieren. Deshalb darf Daratumumab während der Schwangerschaft nicht angewendet werden, es sei denn der Nutzen für die Frau überwiegt das potentielle Risiko für den Fötus.
Stillzeit
Es ist bekannt, dass humanes IgG in die Muttermilch übergeht. Es ist allerdings nicht bekannt, ob Daratumumab Auswirkungen auf Säuglinge hat. Es muss deshalb eine Entscheidung darüber getroffen werden, ob das Stillen oder ob die Behandlung zu unterbrechen ist.
Verkehrstüchtigkeit
Daratumumab hat keinen oder einen zu vernachlässigbaren Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Eine Anwendung kann allerdings zu Fatigue führen, was beim Fahren oder beim Bedienen von Maschinen zu berücksichtigen ist.
Fachinformation Darzalex
-
DARZALEX® 20 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 5 ml
Janssen-Cilag GmbH
-
DARZALEX® 20 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 20 ml
Janssen-Cilag GmbH
-
Darzalex 1800 mg Abacus Injektionslösung, 15 ml
Abacus Medicine A/S
-
DARZALEX® 1800 mg Injektionslösung, 15 ml
Janssen-Cilag GmbH














