Decitabin
Decitabin ist ein synthetisches Pyrimidin-Analogon aus der Gruppe der Antimetaboliten, das durch Hemmung der DNA-Methyltransferase genomische Hypomethylierungen induziert. Diese epigenetischen Veränderungen werden zur Therapie von akuten myeloischen Leukämien genutzt.
Decitabin: Übersicht
Anwendung
Decitabin ist indiziert zur Behandlung Erwachsener mit neu diagnostizierter oder sekundärer akuter myeloischer Leukämie (AML), wenn eine Standard-Induktionstherapie nicht in Frage kommt.
Anwendungsart
Decitabin ist in der Darreichungsform Pulver für ein Konzentrat zur Herstellung einer Infusionslösung (Pulver zur Herstellung einer Infusionslösung) erhältlich. Jede Durchstechflasche mit Pulver für ein Konzentrat zur Herstellung einer Infusionslösung enthält 50 mg Decitabin, wobei nach Rekonstitution mit 10 mL Wasser eine Infusionslösung mit 5 mg/mL entsteht.
Wirkmechanismus
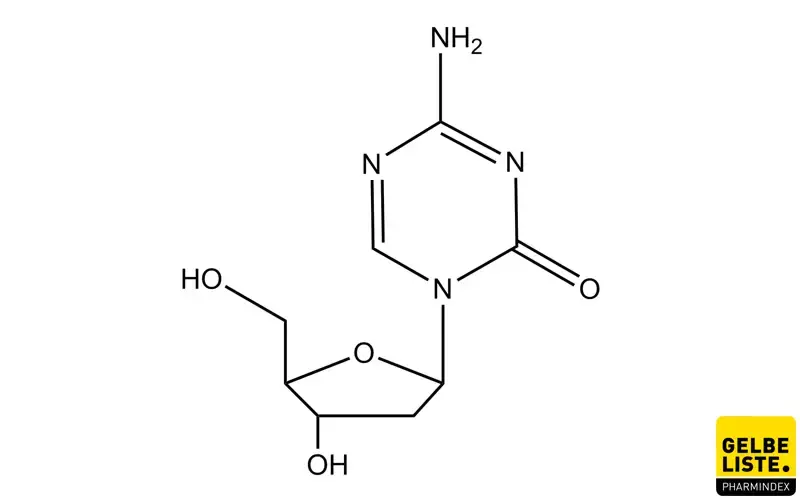
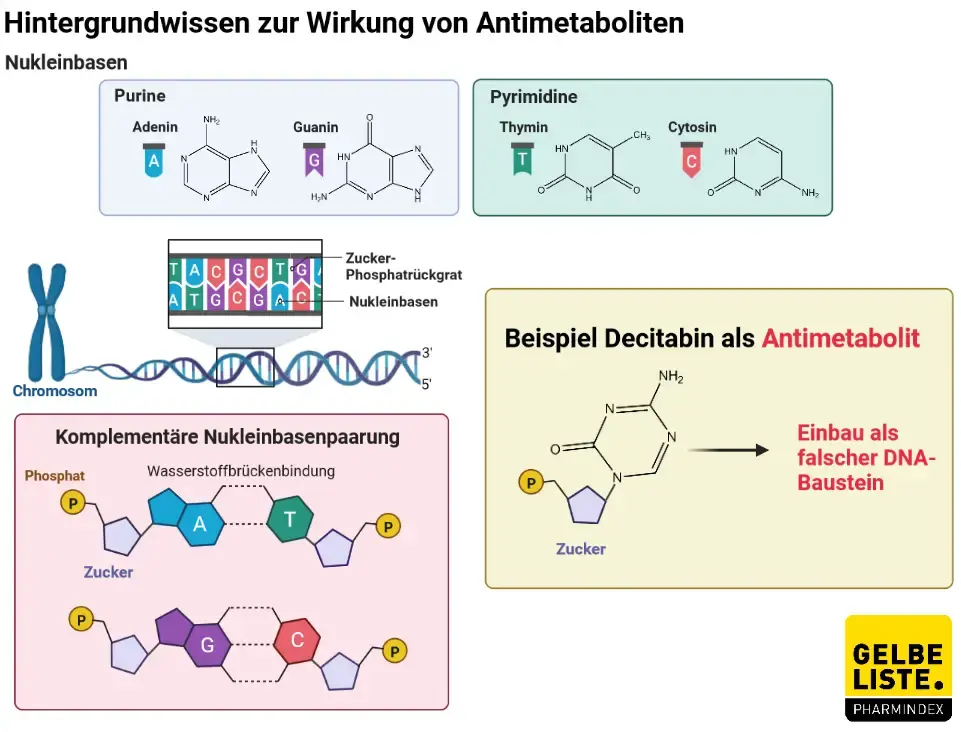
Decitabin ist ein Cytidin-Analogon (5-Aza-2‘-desoxycytidin) und ein sog. Antimetabolit, der durch kovalente Bindung an DNA-Methyltransferasen deren Aktivität inhibiert und dadurch zu einer Gen-Promotor-Hypomethylierung führt. DNA-Methyltransferasen (DNMTs) können die DNA methylieren und damit die Genexpression auf epigenetischer Ebene regulieren. Liegen bestimmte Genabschnitte (insbesondere Promotorregionen) methyliert vor, wird die Genexpression inhibiert.
Tumorzellen haben ein verändertes epigenetisches Methylierungsmuster, das häufig mit Hypermethylierungen einhergeht (z.B. Promotor-Methylierung von Tumorsuppressorgenen). Infolgedessen ist die Aktivität von Tumorsuppressoren sowie anderer Gene, die an der Induktion der Zelldifferenzierung oder der Zellseneszenz beteiligt sind, reduziert. Durch die Decitabin-vermittelte Hemmung von DNMTs kommt es zu DNA- Hypomethylierungen. Die tumorspezifischen epigenetischen Veränderungen (Hypermethylierungen) werden somit teilweise rückgängig gemacht, wodurch die Genexpression modifiziert wird.
Die aktive Wirkform von Decitabin ist das Triphosphat (DAC-TP). DAC-TP ist darüber hinaus auch ein Substrat des Enzyms SAMHD1, welches DAC-TP inaktiviert und damit die pharmakologische Wirksamkeit der Decitabin-Therapie beeinträchtigen kann. Die SAMHD1 bedingte Inaktivierung tritt bei dem Strukturanalogon 5-Azacitidin-Triphosphat (AZA-TP) nicht auf, weshalb 5-Azacitidin eine Wirkstoffalternative zu Decitabin darstellt. Die aktive Wirkform AZA-TP wirkt im Gegensatz zu DAC-TP nicht nur auf DNA-Ebene über Hemmung der DNMTs, sondern vorwiegend auf RNA-Ebene, indem es als Cytidin-Ribonukleotid-Analogon in die RNA integriert wird.
Pharmakokinetik
Verteilung
- Decitabin zeigt eine lineare Pharmakokinetik nach intravenöser Infusion.
- Die Pharmakokinetik wird als lineares Zwei-Kompartiment-Modell beschrieben, das durch eine rasche Elimination aus dem zentralen Kompartiment und einer relativ langsamen Verteilung aus dem peripheren Kompartiment charakterisiert ist.
- Steady-State-Konzentrationen werden innerhalb von 0,5 Stunden erreicht.
- Wird das Dosierungsschema eingehalten, treten keine Akkumulationseffekte auf.
- Die Plasmaproteinbindung von Decitabin ist mit < 1% vernachlässigbar.
- Das Verteilungsvolumen im Steady-State (Vdss) ist groß und deutet auf eine Verteilung in periphere Gewebe hin.
Metabolisierung
- Decitabin wird intrazellulär durch sequenzielle Phosphorylierung in die aktive Wirkform Decitabin-Triphosphat (DAC-TP) umgewandelt, welches wiederum durch die DNA-Polymerase inkorporiert wird.
- Das Cytochrom-P-450-Enzymsystem ist nicht an der Metabolisierung von Decitabin beteiligt.
- Decitabin wird wahrscheinlich über die Cytidindesaminase in Leber, Niere, intestinalem Epithel und Blut desaminiert.
- Die Hauptmetaboliten von Decitabin zeigen keine pharmakologische Aktivität.
Elimination
- Die mittlere Plasma-Clearance nach intravenöser Applikation beträgt > 200 L/h mit interindividueller Variabilität.
- Etwa 90% der applizierten Decitabin-Dosis (4% unveränderter Wirkstoff) werden renal eliminiert.
Dosierung
Standarddosierung
- Die standardmäßige Dosierung beträgt 20 mg/m² Körperoberfläche täglich.
- Diese wird an 5 aufeinanderfolgenden Tagen appliziert (somit beträgt die verabreichte Gesamtdosis Decitabin pro 5-tägigen Behandlungszyklus 100 mg/m²).
- Die tägliche Gesamtdosis (20 mg/m²) sowie die Gesamtdosis des Behandlungszyklus (100 mg/m²) dürfen nicht überschritten werden.
- Im Falle einer versäumten Dosis sollte die Behandlung möglichst zeitnah wieder fortgesetzt werden.
- Die Behandlungszyklen sollten, in Abhängigkeit des klinischen Ansprechens und der beobachteten Toxizität, alle 4 Wochen wiederholt werden.
- Generell werden mindestens 4 Behandlungszyklen empfohlen, allerdings können für eine (partielle) Remission auch mehr als 4 Behandlungszyklen erforderlich sein.
- Die Therapie mit Decitabin kann beliebig lange fortgesetzt werden, solange der klinische Nutzen überwiegt oder ein Therapieansprechen bzw. eine Stabilisierung der Krankheit aufzuweisen ist.
-
Sollten nach 4 Behandlungszyklen die hämatologischen Werte (z.B. Thrombozytenzahl oder absolute Neutrophilenzahl) nicht dem Ausgangswert vor der Behandlung entsprechen oder im Falle einer
Krankheitsprogression (Ansteigen der peripheren Blastenzahlen oder Verschlechterung der Blastenzahlen im Knochenmark), kann der Patient als Non-Responder eingestuft und andere Therapiemöglichkeiten als Alternative in Erwägung gezogen werden. - Die präventive Gabe von Antiemetika wird standardmäßig nicht empfohlen, ist jedoch bei Bedarf möglich.
Myelosuppression
Sollte es bei Patienten mit AML vor oder während der Decitabin-Therapie zu einer Myelosuppression (Thrombozytopenie, Anämie, Neutropenie) und damit verbundenen Komplikationen (Infektionen, Blutungen) kommen, kann im Ermessen des behandelnden Arztes der Behandlungsbeginn verschoben werden.
Die Decitabin-Behandlung sollte verschoben werden, wenn nachfolgende Komplikationen bestehen:
- Febrile Neutropenie (Körpertemperatur ≥ 38,5°C und absolute Neutrophilenzahl < 1.000/μl)
- Aktive virale, bakterielle oder Pilzinfektion (die eine Behandlung mit intravenösen Antiinfektiva oder andere umfangreiche unterstützende Behandlung erfordern)
- Blutungen (gastrointestinal, urogenital, pulmonal mit Thrombozytenzahlen < 25.000/μl oder Blutungen innerhalb des zentralen Nervensystems)
Eine Fortsetzung der Decitabin-Therapie sollte erst erfolgen, wenn sich die genannten Komplikationen gebessert oder stabilisiert haben (z.B. durch Antiinfektiva, Transfusionen oder Wachstumsfaktoren). In klinischen Studien benötigte etwa ein Drittel der Patienten eine Dosisverzögerung, wobei eine Dosisreduktion nicht empfohlen wird.
Nebenwirkungen
Die häufigsten Nebenwirkungen unter Decitabin-Therapie sind hämatologische Nebenwirkungen wie Anämie, Thrombozytopenie, (febrile) Neutropenie oder Leukopenie sowie Pyrexie und Pneumonie. Darüber hinaus können schwere im Zusammenhang mit einer Blutung stehende Nebenwirkungen (davon einige mit letalem Ausgang) wie etwa zentralnervöse (ZNS) Blutung (2%) und gastrointestinale (GI) Blutung (2%) auftreten (zusammen mit einer schweren Thrombozytopenie).
Schwerwiegende Nebenwirkungen erfordern eine Unterbrechung oder einen Abbruch der Therapie. Die Inzidenz für einen Behandlungsabbruch ist bei Frauen höher als bei Männern (43% versus 34%). Generell werden routinemäßige Überwachungen des Differentialblutbildes zur Vermeidung hämatologischer Nebenwirkungen empfohlen. Zudem sollten unterstützende Therapien zur Abwendung von Komplikationen (z.B. prophylaktische Gabe von Antibiotika und/oder Wachstumsfaktoren, Transfusionen) zeitnah angewendet werden.
Weitere häufige Nebenwirkungen umfassen:
- Sepsis
- Septischer Schock
- Hyperglykämie
- Kopfschmerzen
- Überempfindlichkeit einschließlich anaphylaktischer Reaktionen
- Epistaxis
- Diarrhö
- Erbrechen
- Übelkeit
- Stomatitis
- Anomale Leberfunktion
- Hyperbilirubinämie
Wechselwirkungen
Es wurden keine klinischen Studien zur Erfassung von Wechselwirkungen mit Decitabin durchgeführt. Theoretisch besteht die Möglichkeit von Wechselwirkungen mit Wirkstoffen, die ebenfalls durch sequenzielle Phosphorylierungen aktiviert oder über Decitabin-inaktivierende Enzyme metabolisiert werden. Wechselwirkungen mit dem CYP-P450-Enzymsystem sind allerdings nicht zu erwarten.
Die geringe Plasmaproteinbindung von Decitabin macht eine Verdrängung anderer Wirkstoffe aus deren Plasmaproteinbindung unwahrscheinlich.
Kontraindikationen
Decitabin darf nicht bei Überempfindlichkeit gegen den Wirkstoff oder während der Stillzeit angewendet werden.
Schwangerschaft
Decitabin darf während der Schwangerschaft aufgrund seines in Tierstudien nachgewiesenen teratogenen Risikos nicht angewendet werden. Vor Beginn der Decitabin-Therapie sollte ein Schwangerschaftstest durchgeführt werden. Im Falle einer Anwendung während der Schwangerschaft oder einer eintretenden Schwangerschaft während der Behandlung ist die Patientin über die potenzielle Gefährdung für den Fetus aufzuklären.
Frauen im gebärfähigen Alter müssen aufgrund des genotoxischen Potenzials von Decitabin während der Therapie bis 6 Monate nach Ende der Therapie eine zuverlässige Verhütungsmethode zur Vermeidung einer Schwangerschaft anwenden (die gleichzeitige Anwendung von Decitabin mit hormonalen Kontrazeptiva wurde nicht untersucht).
Männer sollen während der Behandlung und bis 3 Monate nach Ende der Therapie eine zuverlässige Verhütungsmethode anwenden.
Stillzeit
Es ist nicht bekannt, ob Decitabin oder seine Metaboliten in die Muttermilch übergehen. Aus diesem Grund ist Decitabin während der Stillzeit kontraindiziert. Sollte die Behandlung mit Decitabin jedoch unumgänglich sein, muss das Stillen unterbrochen werden
Verkehrstüchtigkeit
Unter Decitabin-Therapie auftretende Nebenwirkungen (z.B. Anämien) können mäßigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben. Daher ist in diesem Zusammenhang Vorsicht geboten.
Anwendungshinweise
Myelosuppression
- Myelosuppressionen können bei Patienten mit AML auftreten und unter Decitabin-Therapie verstärkt werden.
- Da das Risiko für schwere Infektionen mit potenziell letalem Ausgang bei bestehender Myelosuppression erhöht ist, sollten Patienten auf Anzeichen einer Infektion überwacht und sofort behandelt werden.
- Bestimmungen des Differentialblutbildes einschließlich der Thrombozytenzahl sollten routinemäßig, bei klinischer Notwendigkeit und vor Beginn jedes Behandlungszyklus durchgeführt werden.
-
Bei Vorliegen einer Myelosuppression oder einer ihrer
Komplikationen kann die Behandlung mit Decitabin unterbrochen und/oder unterstützende Maßnahmen eingeleitet werden.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
- Unter Therapie mit Decitabin kann es zu interstitiellen Lungenerkrankungen (ILD) einschließlich Lungeninfiltrate, organisierende Pneumonie und Lungenfibrose ohne infektiöse Ursache kommen.
- Patienten mit akut einsetzenden oder sich verschlechternden Lungensymptomen sollten auf ILD untersucht werden.
- Bei bestätigter ILD sollte eine angemessene Behandlung eingeleitet werden.
Leberfunktionsstörung
- Es liegen keine systematischen Untersuchungen einer Decitabin-Anwendung bei Patienten mit Leberfunktionsstörungen vor.
- Anzeichen, die auf eine Entwicklung von Leberfunktionsstörungen hindeuten, sollten wahrgenommen werden.
- Vor Behandlungs- oder Zyklusbeginn sollen Leberfunktionstests durchgeführt werden.
Nierenfunktionsstörung
- Es liegen keine systematischen Untersuchungen einer Decitabin-Anwendung bei Patienten mit Nierenfunktionsstörungen vor.
- Bei der Anwendung von Decitabin bei Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance [CrCl] < 30 mL/min) ist entsprechende Vorsicht geboten.
- Vor Behandlungs- oder Zyklusbeginn sollen Nierenfunktionstests durchgeführt werden.
Kardiale Erkrankungen
- Patienten mit schwerer dekompensierter Herzinsuffizienz oder klinisch instabilen kardialen Erkrankungen in der Anamnese waren von den klinischen Studien ausgeschlossen, sodass Sicherheit und Wirksamkeit von Decitabin bei diesen Patienten nicht untersucht wurden.
- Unter Decitabin-Therapie kam es zu Fällen von Kardiomyopathien mit Herzdekompensation, die nach Behandlungsabbruch oder Dosisreduktion reversibel waren.
- Patienten (insbesondere solche mit kardialen Erkrankungen in der Anamnese) sollen auf Symptome einer Herzinsuffizienz überwacht werden.
Differenzierungssyndrom
- In einigen Fällen trat unter Decitabin-Therapie ein Differenzierungssyndrom (Retinsäuresyndrom) auf.
- Da das Differenzierungssyndrom tödlich sein kann, sollten bei ersten Anzeichen eines Differenzierungssyndroms eine Behandlung mit hochdosierten intravenösen Kortikosteroiden und eine hämodynamische Überwachung in Erwägung gezogen werden.
- Eine Unterbrechung der Behandlung mit Decitabin sollte bis zum Abklingen der Symptome in Betracht gezogen werden.
- Bei Fortsetzung der Decitabin-Therapie ist Vorsicht geboten.
Wirkstoff-Informationen
- EMA: Fachinformation Dacogen
- Stresemann C, Lyko F. Modes of action of the DNA methyltransferase inhibitors azacytidine and decitabine. Int J Cancer 23(1):8-13 (2008). doi:10.1002/ijc.23607
- Oellerich, T., Schneider, C., Thomas, D. et al. Selective inactivation of hypomethylating agents by SAMHD1 provides a rationale for therapeutic stratification in AML. Nat Commun 10, 3475 (2019).
- Onkopedia: AML
Abbildung
Created with Biorender
-
Dacogen 50 mg Orifarm Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Orifarm GmbH
-
Dacogen® 50 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Janssen-Cilag GmbH
-
Inaqovi 35 mg/100 mg Filmtabletten
Otsuka Pharma GmbH
-
Inaqovi 35 mg/100 mg Orifarm Filmtabletten
Orifarm GmbH











