Denosumab
Denosumab ist ein humaner monoklonaler Antikörper, der sich gegen das Protein RANK-Ligand (RANKL) richtet und primär zur Behandlung der Osteoporose indiziert ist. Darüber hinaus ist der Antikörper auch bei (Knochen-)Krebserkrankungen und Knochenbefall zugelassen.
Denosumab: Übersicht
Anwendung
Der Anti-RANKL-Antikörper Denosumab (Xgeva, Prolia) ist indiziert zur Behandlung von:
- Osteoporose bei postmenopausalen Frauen und bei Männern mit erhöhtem Frakturrisiko (bei postmenopausalen Frauen vermindert Denosumab signifikant das Risiko für vertebrale, nicht-vertebrale und Hüftfrakturen)
- Knochenschwund im Zusammenhang mit Hormonablation bei Männern mit Prostatakarzinom mit erhöhtem Frakturrisiko (Denosumab vermindert bei Männern mit Prostatakarzinom unter Hormonablationstherapie signifikant das Risiko für vertebrale Frakturen)
- Knochenschwund im Zusammenhang mit systemischer Glucocorticoid-Langzeittherapie bei erwachsenen Patienten mit erhöhtem Frakturrisiko
- Skelettbezogenen Komplikationen (pathologische Fraktur, Bestrahlung des Knochens, Rückenmarkkompression oder operative Eingriffe am Knochen) bei Erwachsenen mit fortgeschrittenen Krebserkrankungen und Knochenbefall (Prävention)
- Erwachsenen und skelettal ausgereiften Jugendlichen mit Riesenzelltumoren des Knochens, die nicht resezierbar sind oder bei denen eine operative Resektion wahrscheinlich zu einer schweren Morbidität führt
Wirkmechanismus
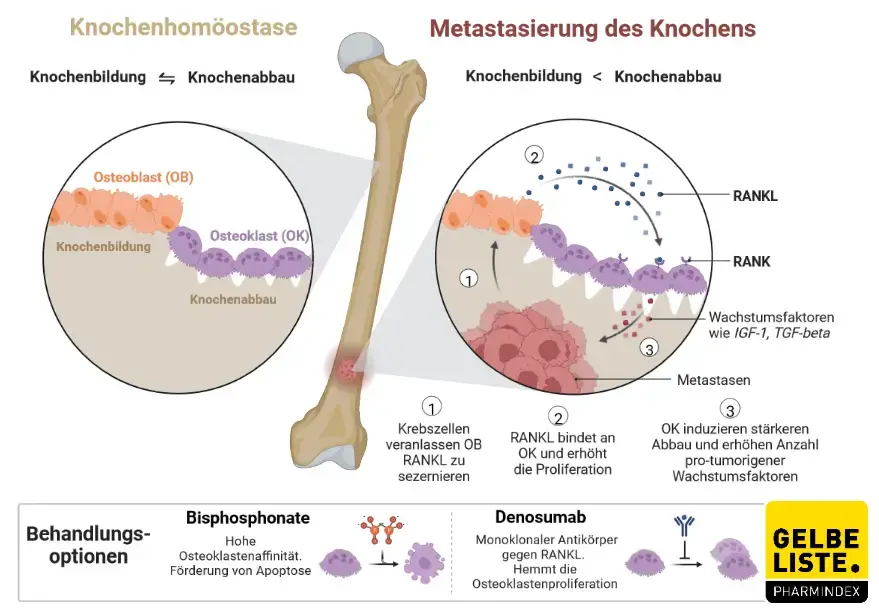
Denosumab ist ein vollständig humaner monoklonaler IgG2-Antikörper, was durch die Endung „umab“ gekennzeichnet wird. Der Antikörper bindet spezifisch und mit hoher Affinität an den „receptor activator of NF-κB“- (RANK-)Liganden (RANKL), wodurch dessen Interaktion mit seinem Rezeptor RANK unterbunden wird. Folglich wird die Aktivierung des Rezeptors RANK verhindert, der auf Osteoklasten und deren Vorläuferzellen exprimiert wird und die Bildung, die Funktion und das Überleben der Osteoklasten vermittelt. Demnach reduziert Denosumab die Osteoklasten-vermittelte Knochenresorption und damit einhergehend den Knochenabbau.
Eine erhöhte Osteoklastenaktivität, die durch RANKL stimuliert wird, ist ein Schlüsselmediator des Knochenabbaus bei Knochenmetastasen und Multiplem Myelom.
Riesenzelltumoren des Knochens charakterisieren sich durch neoplastische Stromazellen, die RANKL exprimieren, und Osteoklasten-ähnliche Riesenzellen, die RANK exprimieren.
Denosumab bindet bei Patienten mit Riesenzelltumoren des Knochens an RANKL und reduziert oder eliminiert signifikant Osteoklasten-ähnliche Riesenzellen. Infolgedessen wird die Osteolyse vermindert und proliferatives Tumorstroma durch nicht-proliferativen, differenzierten, dicht gewobenen neuen Knochen ersetzt.
Dosierung
Osteoporose
Die empfohlene Dosis beträgt 60 mg Denosumab. Diese wird einmal alle 6 Monate als einzelne subkutane Injektion in den Oberschenkel, die Bauchregion oder den Oberarm angewendet.
Prävention skelettbezogener Komplikationen bei Erwachsenen mit fortgeschrittenen Krebserkrankungen und Knochenbefall
Die empfohlene Dosis beträgt 120 mg. Diese wird einmal alle 4 Wochen als einzelne subkutane Injektion in den Oberschenkel, die Bauchregion oder den Oberarm angewendet.
Riesenzelltumoren des Knochens
Die empfohlene Dosis beträgt 120 mg. Diese wird einmal alle 4 Wochen und in zusätzlichen Dosen von 120 mg an den Tagen 8 und 15 des ersten Behandlungsmonats als einzelne subkutane Injektion in den Oberschenkel, die Bauchregion oder den Oberarm angewendet.
Nebenwirkungen
Die häufigsten Nebenwirkungen von Denosumab (bei mehr als einem von zehn Patienten beobachtet) sind:
- Muskuloskelettale Schmerzen
- Schmerzen in den Extremitäten
Kontraindikationen
Denosumab darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff
- Schwere, unbehandelte Hypokalzämie
- Nicht verheilte Läsionen aus Zahnoperationen oder Operationen im Mundbereich (für Xgeva)
Schwangerschaft
Tierexperimentelle Studien mit Denosumab haben eine Reproduktionstoxizität gezeigt. Frauen müssen vor der Behandlung darauf hingewiesen werden mindestens 5 Monate nach der Behandlung nicht schwanger zu werden. Jegliche Wirkung von Denosumab ist während des zweiten und dritten Trimesters der Schwangerschaft wahrscheinlich größer, da monoklonale Antikörper auf lineare Weise durch die Plazenta transportiert werden, während die Schwangerschaft fortschreitet. Die höchste Menge wird während des dritten Trimesters transferiert.
Stillzeit
Es ist nicht bekannt, ob Denosumab in die Muttermilch übergeht. Ein Risiko für das Neugeborene/Kind kann nicht ausgeschlossen werden. Studien mit Knockout-Mäusen weisen darauf hin, dass das Fehlen von RANKL während der Schwangerschaft die Reifung der Brustdrüsen und damit die Milchproduktion nach der Geburt beeinträchtigen kann. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung verzichtet werden soll. Dabei sind sowohl der Nutzen des Stillens für das Neugeborene/Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
Verkehrstüchtigkeit
Denosumab hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Anwendungshinweise
Ergänzend zur Therapie mit Denosumab müssen alle Patienten täglich mindestens 500 mg Calcium und 400 IE Vitamin D erhalten, außer bei bestehender Hyperkalzämie.
Alternativen
Die medikamentösen Alternativen richten sich nach dem jeweiligen Indikationsgebiet und sind darüber hinaus abhängig von patientenindividuellen Faktoren wie dem Alter und Geschlecht der Patienten, Komorbiditäten oder dem Schweregrad der Erkrankung.
Osteoporose
- Calcium und Vitamin D
- Bisphosphonate wie Alendronat und Ibandronat
- Derivate des Parathormons (PTH) wie Teriparatid
- Estrogene oder SERMs wie Bazedoxifen und Raloxifen
Wirkstoff-Informationen
- EMA: Fachinformation Prolia
- EMA: Fachinformation Xgeva
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- Hanley et al., Denosumab: mechanism of action and clinical outcomes, Int J Clin Pract, 2012; 66(12): 1139-1146. doi: 10.1111/ijcp.12022
- AWMF: Leitlinie Prophylaxe, Diagnostik und Therapie der Osteoporose (2017)
Abbildung
Adapted from „ Metastasis to Bone Disrupts Bone Homeostasis”, by BioRender.com
-
Acvybra 60 mg Injektionslösung in einer Fertigspritze
betapharm Arzneimittel GmbH
-
Bildyos 60 mg Injektionslösung in einer Fertigspritze
Organon Healthcare GmbH
-
Bilprevda 120 mg Injektionslösung
Organon Healthcare GmbH
-
Bomyntra 120 mg Injektionslösung in einer Durchstechflasche
FRESENIUS KABI Deutschland GmbH
-
Bomyntra 120 mg Injektionslösung in einer Fertigspritze
FRESENIUS KABI Deutschland GmbH
-
Conexxence 60 mg Injektionslösung in einer Fertigspritze
FRESENIUS KABI Deutschland GmbH
-
Degevma 120 mg Injektionslösung
ratiopharm GmbH
-
Denbrayce 120 mg Injektionslösung
Heumann Pharma GmbH & Co. Generica KG
-
Enwylma 120 mg Injektionslösung
Zentiva Pharma GmbH
-
Evfraxy 60 mg Injektionslösung in einer Fertigspritze
Biocon Biologics Germany GmbH
-
Izamby 60 mg Injektionslösung in einer Fertigspritze
Heumann Pharma GmbH & Co. Generica KG
-
Jubbonti® 60 mg Injektionslösung in einer Fertigspritze
Hexal AG
-
Jubereq 120 mg Injektionslösung
Accord Healthcare GmbH
-
Junod 60 mg Injektionslösung in einer Fertigspritze
Gedeon Richter Pharma GmbH
-
Kefdensis® 60 mg Injektionslösung in einer Fertigspritze
STADAPHARM GmbH
-
Obodence 60 mg Injektionslösung in einer Fertigspritze
Samsung Bioepis NL B.V.
-
Osenvelt® 120 mg Injektionslösung
Celltrion Healthcare Deutschland GmbH
-
Osvyrti 60 mg Injektionslösung in einer Fertigspritze
Accord Healthcare GmbH
-
Ponlimsi 60 mg Injektionslösung in einer Fertigspritze
ratiopharm GmbH
-
Prolia 60 mg 1 4U Pharma Injektionslösung in einer Fertigspritze
1 4 U Pharma GmbH
-
Prolia 60 mg 101 Carefarm Injektionslösung in einer Fertigspritze
1 0 1 Carefarm GmbH
-
Prolia 60 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
Prolia 60 mg ACA Injektionslösung in einer Fertigspritze
A.C.A. Müller ADAG Pharma AG
-
Prolia 60 mg Allomedic Injektionslösung in einer Fertigspritze
Allomedic GmbH
-
Prolia 60 mg axicorp Injektionslösung in einer Fertigspritze
axicorp Pharma B.V.
-
Prolia 60 mg BB Farma Injektionslösung in einer Fertigspritze
BB Farma S.R.L.
-
Prolia 60 mg CC Pharma Injektionslösung in einer Fertigspritze
CC Pharma GmbH
-
Prolia 60 mg Eurim Injektionslösung in einer Fertigspritze
Eurim-Pharm Arzneimittel GmbH
-
Prolia 60 mg European Injektionslösung in einer Fertigspritze
European Pharma B.V.
-
Prolia 60 mg Haemato-Pharm Injektionslösung in einer Fertigspritze
HAEMATO PHARM GmbH
-
Prolia® 60 mg Injektionslösung in einer Fertigspritze
Amgen GmbH
-
Prolia 60 mg kohlpharma Injektionslösung in einer Fertigspritze
kohlpharma GmbH
-
Prolia 60 mg Medicopharm Injektionslösung in einer Fertigspritze
Medicopharm AG
-
Prolia 60 mg Mpa Pharma Injektionslösung in einer Fertigspritze
Mpa Pharma GmbH
-
Prolia 60 mg NMG Pharma Injektionslösung in einer Fertigspritze
NMG Pharma GmbH
-
Prolia 60 mg Orifarm Injektionslösung in einer Fertigspritze
Orifarm GmbH
-
Prolia 60 mg Originalis Injektionslösung in einer Fertigspritze
Originalis B.V.
-
Stoboclo® 60 mg Injektionslösung in einer Fertigspritze
Celltrion Healthcare Deutschland GmbH
-
Vysribli 60 mg Injektionslösung in einer Fertigspritze
ALTAMEDICS GmbH
-
Wyost® 120 mg Injektionslösung
Hexal AG
-
Xbonzy 120 mg Injektionslösung
betapharm Arzneimittel GmbH
-
Xbryk 120 mg Injektionslösung
Samsung Bioepis NL B.V.
-
XGEVA 120 mg 1 4U Pharma Injektionslösung
1 4 U Pharma GmbH
-
Xgeva 120 mg Abacus Injektionslösung
Abacus Medicine A/S
-
Xgeva 120 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
Xgeva 120 mg Axicorp Injektionslösung
axicorp Pharma GmbH
-
Xgeva 120 mg axicorp Injektionslösung in einer Fertigspritze
axicorp Pharma GmbH
-
Xgeva 120 mg CC Pharma Injektionslösung
CC Pharma GmbH
-
Xgeva 120 mg CC Pharma Injektionslösung in einer Fertigspritze
CC Pharma GmbH
-
Xgeva 120 mg Eurim Injektionslösung
Eurim-Pharm Arzneimittel GmbH