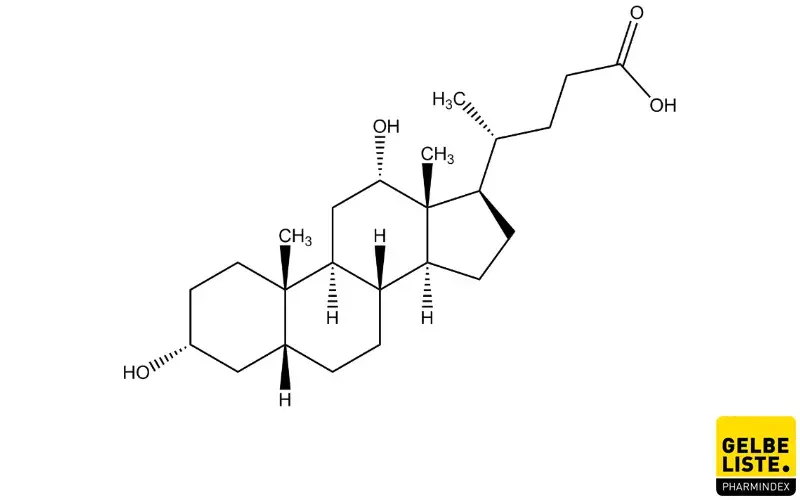
Desoxycholsäure
Desoxycholsäure ist eine sekundäre Gallensäure mit struktureller Verwandtschaft zu den Steroidhormonen, die aufgrund ihrer zytolytischen Eigenschaften zur Behandlung eines Doppelkinns zugelassen ist.
Desoxycholsäure: Übersicht
Anwendung
Desoxycholsäure ist unter dem Handelsnamen Kybella zugelassen und zerstört bei Injektion in lokalisiertes Subkutanfett die Zellmembran der Adipozyten. Das Arzneimittel ist zugelassen zur Behandlung von Erwachsenen mit mittlerer bis schwerer Wölbung oder Fülle aufgrund von submentalem Fett (Doppelkinn), wenn dieses eine erhebliche psychologische Belastung für den Patienten darstellt.
Anwendungsart
Der Wirkstoff ist mittig in das preplatysmale subkutane Fettgewebe (zwischen Dermis und Platysma) im submentalen Bereich zu injizieren. Intradermale, intramuskuläre oder intravaskuläre Injektionen sind zu vermeiden. Die Anwendung einer falschen Injektionstechnik kann das Risiko von Hautulzerationen oder Nekrosen erhöhen.
Wirkmechanismus
Desoxycholsäure ist eine sekundären Gallensäure und somit ein zytolytischer Wirkstoff, der bei Injektion in lokalisiertes Subkutanfett die Zellmembran der Adipozyten zerstört. Die Zerstörung der Adipozyten löst eine Reaktion des Gewebes aus, bei der Makrophagen von dieser Region angezogen werden, um Zellreste und Lipide zu beseitigen und durch natürliche Prozesse abzubauen. Anschließend kommt es zur Einwanderung von Fibroblasten und es ist eine Verdickung der faserförmigen Septen zu beobachten, was auf eine Erhöhung des Gesamtkollagens (d. h. eine Neo-Collagenese) schließen lässt.
Pharmakokinetik
Resorption
Desoxycholsäure wird nach subkutaner Injektion schnell resorbiert. Maximale Plasmakonzentrationen wurden nach einmaliger Behandlung mit 100 mg Desoxycholsäure etwa 6 Minuten nach der Injektion beobachtet. Bei der empfohlenen Maximaldosis für eine einmalige Behandlung (100 mg) betrug die Desoxycholsäure-Exposition (AUC0–24) weniger als das 2-Fache der endogenen Exposition. Die Plasma-AUC0-24 stieg proportional zur Dosis bis auf 100 mg. Nach der Behandlung sanken die Desoxycholsäure-Plasmaspiegel innerhalb von 24 Stunden wieder auf das endogene Niveau. Bei der empfohlenen Behandlungshäufigkeit ist keine Akkumulation zu erwarten.
Verteilung
Das Verteilungsvolumen wurde auf 193 l geschätzt und ist unabhängig von der Dosis. Desoxycholsäure weist eine sehr hohe Plasmaproteinbindung von 98% auf.
Elimination
Endogene Desoxycholsäure ist ein Produkt des Cholesterinstoffwechsels und wird mit dem Stuhl intakt ausgeschieden. Die in Arzneimitteln enthaltene Desoxycholsäure wird in den endogenen Gallensäure-Pool aufgenommen und zusammen mit der endogenen Desoxycholsäure ausgeschieden. Sie wird über hepatische Transportproteine aus dem Blut in die Galle eliminiert, ohne wesentlich zum Stoffwechsel beizutragen.
Dosierung
Das zu injizierende Gesamtvolumen und die Anzahl der Behandlungssitzungen müssen sich nach dem submentalen Fettanteil und den Behandlungszielen des jeweiligen Patienten richten. Die maximale Dosis von 10 ml (100 mg, entspricht 50 Injektionen) darf innerhalb von einer Behandlungssitzung nicht überschritten werden.
Nebenwirkungen
Zu den häufig (≥ 1/100 bis <1/10) aufgetretenen Nebenwirkungen, die im Rahmen von klinischen Studien mit Desoxycholsäure bei Patienten auftraten zählen:
- Kopfschmerzen
- Dysphagie, Übelkeit
- Spannen der Haut
- Reaktionen an der Injektionsstelle
- Nervenverletzung an der Injektionsstelle
Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen mit Desoxycholsäure durchgeführt.
Kontraindikation
Desoxycholsäure darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder Vorliegen einer Infektion an den geplanten Injektionsstellen.
Schwangerschaft
Es wurden Reproduktionsstudien an Ratten und Kaninchen mit Verabreichung einer bis zu 1,8-fachen Dosis (Ratten) bzw. 12-fachen Dosis (Kaninchen) der für Menschen empfohlenen Maximaldosis durchgeführt. Zwar ließen sich keine direkten oder indirekten schädlichen Auswirkungen bezüglich der Reproduktionstoxizität nachweisen, die Untersuchung zur embryonalen und fetalen Toxizität wies jedoch bei Kaninchen uneindeutige Befunde von fehlenden mittleren Lungenlappen auf. Da zudem keine angemessenen und gut kontrollierten Studien mit Schwangeren durchgeführt wurden, ist Desoxycholsäure während der Schwangerschaft vorsorglich nicht anzuwenden.
Stillzeit
Es liegen keine Daten über das Vorhandensein von Desoxycholsäure in der Muttermilch, über Auswirkungen des Arzneimittels auf den gestillten Säugling oder über die Auswirkungen des Arzneimittels auf die Milchproduktion vor. Da keine Studien mit stillenden Müttern durchgeführt wurden, ist Desoxycholsäure bei stillenden Müttern mit Vorsicht anzuwenden.
Verkehrstüchtigkeit
Es ist nicht zu erwarten, dass bei Anwendung von Desoxycholsäure die Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen beeinträchtigt wird.
Anwendungshinweise
Nach der Markteinführung wurden Fälle von Ulzerationen und Nekrosen an der Injektionsstelle gemeldet. In einigen dieser Fälle wurde explizit über schwerwiegenden Nekrosen und über Arteriennekrosen an der Injektionsstelle berichtet. In den meisten Fällen traten die ersten Symptome bzw. die Nekrosen innerhalb von einer Woche nach der Injektion auf. Wenn Ulzerationen oder Nekrosen an der Injektionsstelle auftreten, darf bei dem Patienten nie wieder eine Behandlung mit Desoxycholsäure erfolgen. Die Anwendung einer falschen Injektionstechnik kann das Risiko von Hautulzerationen oder Nekrosen erhöhen.
Studienlage
In vier randomisierten, multizentrischen, doppelblinden, placebokontrollierten Phase-III-Studien wurde Desoxycholsäure bei der Behandlung der Konvexität oder der Fülle aufgrund von submentalem Fett (SMF) und derdamit verbundenen psychologischen Belastungen untersucht. Die primären Endpunkte wurden bei jeder Studie 12 Wochen nach der letzten Behandlung gemessen. Jede Phase-III-Studie erreichte ihre primären Wirksamkeitsendpunkte und zeigte eine Verbesserung der psychologischen Belastungen gegenüber der Placebo-Gruppe.
In den Studien nahmen Erwachsene (im Alter von 19 bis 65 Jahren) teil, die gemäß der Beurteilung der Ärzte und der Patienten selbst an mittlerer bis starker Konvexität oder Fülle aufgrund von SMF litten. Die Patienten der Studien in der EU erhielten bis zu vier, die Patienten der Studien in Nordamerika bis zu 6 Behandlungen mit Desoxycholsäure (n=757 bei allen 4 Studien) oder Placebo (n=746) in Abständen von jeweils 28 Tagen. Bei Erreichen des gewünschten Ergebnisses wurde die Behandlung gestoppt.
Das Injektionsvolumen pro Injektionsstelle betrug 0,2 ml und wurde in einem Abstand von 1 cm in das SMF-Gewebe injiziert (Dosis pro Bereich 2 mg/cm).Die maximal erlaubte Dosis einer Behandlungssitzung und für den gesamten behandelten Bereich betrug 100 mg (10 ml).
Ergebnisse
90% der an den EU-Studien und 92% der an den USA/Kanada-Studien teilnehmenden Patienten wiesen eine Reduktion des SMF-Volumens auf. Davon nahmen 68,9% bzw. 70,5% der Patienten 12 Wochen nach der letzten Behandlung im Vergleich zur Baseline keine Veränderung und 21,6 % bzw. 22,9 % der Patienten eine Verbesserung der Wirksamkeit gegen Hauterschlaffung wahr.
Die langfristige Sicherheit und Erhaltung des Behandlungseffekts wurde nach der Behandlung mit Desoxycholsäure untersucht: Eine Untergruppe der auf die Behandlung angesprochen Patienten, nahm an diesen Nachbeobachtungsstudien teil. Hierbei konnte die Erhaltung des Behandlungseffekts bis zu 5 Jahre nachgewiesen werden.











