Dostarlimab
Dostarlimab ist ein Checkpoint-Inhibitor, der zur Therapie des rezidivierenden oder fortgeschrittenen Endometriumkarzinoms angewendet wird. Der Wirkstoff wird als Monotherapie intravenös infundiert.
Dostarlimab: Übersicht
Anwendung
Dostarlimab ist als Monotherapie zur Behandlung erwachsener Patientinnen mit rezidivierendem oder fortgeschrittenem Endometriumkarzinom mit Mismatch-Reparatur-Defizienz (dMMR)/hoher Mikrosatelliteninstabilität (MSI-H) angezeigt, das während oder nach einer vorherigen Behandlung mit einer Platin-basierten Therapie progredient ist.
Anwendungsart
Das Arzneimittel ist als steriles Konzentrat zur Herstellung einer Infusionslösung auf dem Markt. Die leicht opaleszierende, farblose bis gelbe Lösung wird nach Verdünnung mit 0,9%iger Natriumchlorid- oder 5%iger Glucose-Injektionslösung mit einer intravenösen Infusionspumpe über einen Zeitraum von 30 Minuten verabreicht. Dostarlimab darf nicht als schnelle intravenöse Infusion oder Bolusinjektion appliziert werden. Die Therapie sollte von Fachärzten mit Erfahrung in der Behandlung von Krebs eingeleitet und überwacht werden.
Wirkmechanismus
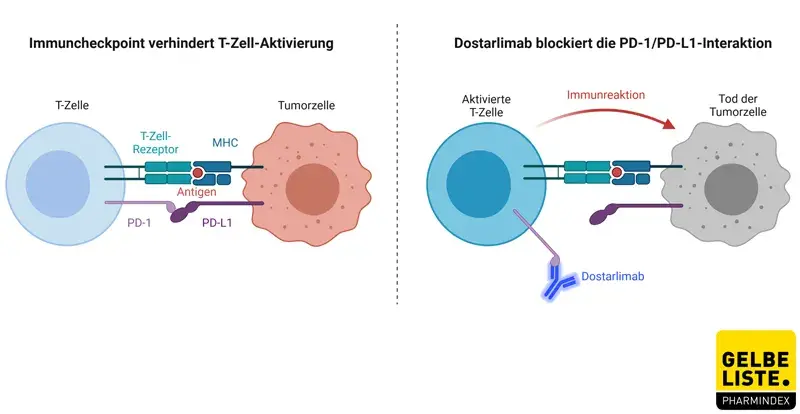
Bei Dostarlimab handelt es sich um einen sogenannten Checkpoint-Inhibitor. Der Wirkstoff ist ein humanisierter monoklonaler IgG4-Antikörper, der an PD-1 (programmed death 1)-Rezeptoren auf T-Lymphozyten bindet und deren Interaktion mit den Liganden PD-L1 und PD-L2 blockiert.
PD-1 ist als negativer Regulator der T-Zell-Aktivierung ein Immuncheckpoint und wesentlich an der Kontrolle T-Zell-vermittelter Reaktionen beteiligt. Die Rezeptor-Liganden-Interaktion führt zur Hemmung von T-Zell-Funktionen, wie Proliferation, Zytokin-Produktion und zytotoxischer Aktivität.
Bestimmte Tumorzellen exprimieren die Liganden PD-L1 und PD-L2, um die Immunreaktion der T-Zellen zu unterdrücken. Die Hemmung des PD-1-Signalwegs durch Dostarlimab verstärkt daher die patienteneigenen T-Zell-Antworten, einschließlich der antitumoralen Aktivität. In syngenen Maus-Tumormodellen führte das Blockieren der PD-1-Aktivität zu einem verminderten Tumorwachstum.
Pharmakokinetik
Resorption
Dostarlimab wird intravenös verabreicht.
Verteilung (Distribution)
Das mittleere Verteilungsvolumen von Dostarlimab beträgt im Steady-State etwa 5,3 L.
Metabolismus (Biotransformation)
Da es sich bei Dostarlimab um einen monoklonalen IgG4-Antikörper handelt, ist zu erwarten, dass der Wirkstoff durch Lysosomen mittels flüssigphasen- oder rezeptorvermittelter Endozytose in kleine Peptide, Aminosäuren und kleine Kohlenhydrate abgebaut wird. Diese Abbauprodukte werden durch renale Exkretion ausgeschieden oder kehren ohne biologische Effekte in den Nährstoffpool zurück.
Elimination
Die mittlere Steady-State-Clearance von Dostarlimab beträgt 0,007 L/h und die Halbwertszeit etwa 25,4 Tage. Bei einer Dosierung mit der empfohlenen therapeutischen Dosis zeigt Dostarlimab eine etwa zweifache Akkumulation ab Zyklus 4 bis Zyklus 12, die mit der terminalen Halbwertszeit konsistent ist.
Dosierung
Die empfohlene Dosis von Dostarlimab als Monotherapie beträgt 500 mg alle 3 Wochen für vier Zyklen, gefolgt von 1.000 mg alle 6 Wochen in allen nachfolgenden Zyklen. Die Verabreichung von Dostarlimab sollte gemäß dem empfohlenen Schema bis zur Krankheitsprogression oder inakzeptabler Toxizität fortgesetzt werden. Beim Auftreten immunvermittelter Nebenwirkungen oder infusionsbedingter Reaktionen muss die Behandlung entsprechend den Angaben der Fachinformation zeitweise oder vollständig abgebrochen werden.
Nebenwirkungen
Die folgenden Nebenwirkungen können unter der Therapie mit Dostarlimab häufig (≥1/100 bis <1/10) bis sehr häufig (≥1/10) auftreten.
- Anämie
- Hypothyreose
- Übelkeit, Erbrechen, Diarrhoe
- Pruritus, Hautausschlag
- Arthralgie
- Fieber
- Erhöhte Transaminase-Werte
- Hyperthyreose, Nebenniereninsuffizienz
- Kolitis, Pankreatitis
- Myalgie
- Schüttelfrost
- Infusionsbedingte Reaktionen
- Pneumonitis
Wechselwirkungen
Es wurden keine Studien zur Untersuchung von Wechselwirkungen von Dostarlimab durchgeführt. Bei monoklonalen Antikörpern wie Dostarlimab sind keine Wechselwirkungen mit Cytochrom-P450-Enzymen, Wirkstoff-Transportern, Zytokinen oder kleinmolekularen Wirkstoffen zu erwarten.
Schwangerschaft
Bisher liegen nur sehr begrenzte Erfahrungen zur Anwendung von Dostarlimab bei Schwangeren vor. Es wurden keine Tierstudien zur Reproduktionstoxizität durchgeführt. Die Hemmung des PD-1/PD-L1-Signalwegs kann jedoch zu einem erhöhten Risiko für immunvermittelte Abstoßung des sich entwickelnden Fötus und damit zum fetalen Tod führen. Es ist zudem bekannt, dass humane Immunglobuline (IgG4) die Plazenta passieren. Aus diesem Grund wird die Anwendung von Dostarlimab während der Schwangerschaft nicht empfohlen.
Stillzeit
Es ist nicht bekannt, ob Dostarlimab oder seine Metabolite in die Muttermilch übergehen, daher kann ein Risiko für den Säugling nicht ausgeschlossen werden. Dostarlimab sollte während der Stillzeit nicht angewendet werden und das Stillen für mindestens 4 Monate nach der letzten Dostarlimab-Dosis vermieden werden.
Verkehrstüchtigkeit
Dostarlimab hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Anwendungshinweise
Tumorstatus bestimmen
Der dMMR-/MSI-H-Tumorstatus sollte vor der Behandlung anhand einer validierten Untersuchungsmethode wie Immunhistochemie (IHC), Polymerase-Kettenreaktion (polymerase chain reaction, PCR) oder Next-generation sequencing (NGS) bestimmt werden.
Haltbarkeit nach Verdünnung
Die chemische und physikalische Stabilität während der Anwendung wurde für 24 Stunden bei 2°C bis 8°C und für 6 Stunden bei Raumtemperatur (bis zu 25°C) ab dem Zeitpunkt der Vorbereitung/der Verdünnung bis zum Ende der Verabreichung nachgewiesen.
Infusionsbedingte Reaktionen
Dostarlimab kann infusionsbedingte Reaktionen verursachen, die schwerwiegend (Grad3) oder lebensbedrohlich (Grad4) sein können. Treten solche Reaktionen auf, sollte die Infusion abgebrochen und die Behandlung dauerhaft abgesetzt werden.
Immunvermittelte Nebenwirkungen
Bei Patientinnen, die mit Antikörpern behandelt werden, die den PD-1/PD-L1-Signalweg blockieren, können immunvermittelte Nebenwirkungen auftreten, die schwerwiegend oder tödlich sein können. Die frühzeitige Erkennung und Behandlung dieser unerwünschten Wirkungen ist wichtig, um die sichere Anwendung von Anti-PD-1/PD-L1-Antikörpern zu gewährleisten. Die Patientinnen sollten auf Anzeichen und Symptome immunvermittelter Nebenwirkungen überwacht werden. Klinische Chemie, einschließlich Lebertestsund Schilddrüsenfunktionstests, sollten zu Beginn und regelmäßig während der Behandlung beurteilt werden. Im Falle des Verdachts auf immunvermittelte Nebenwirkungen sollte eine adäquate Beurteilung, einschließlich Beratung durch einen Facharzt, gewährleistet werden. Basierend auf dem Schweregrad der Nebenwirkung, sollte die Behandlung mit Dostarlimab unterbrochen oder dauerhaft beendet werden und Kortikosteroide (1 bis 2mg/kg/Tag Prednison o.ä.) oder eine andere angemessene Therapie verabreicht werden.
Alternativen
Bei lokalen Rezidiven kann je nach Art der Primärbehandlung eine Strahlentherapie/ Brachytherapie mit oder ohne Tumorresektion in Betracht gezogen werden. Weiterhin ist bei Rezidiven eine endokrine Therapie mit Medroxyprogesteronacetat, Megestrolacetat oder Tamoxifen möglich. Höhere Ansprechraten mit Medroxyprogesteronacetat werden insbesondere erzielt, wenn eine Progesteron- oder Östrogenrezeptorexpression oder eine gut bis mittelgradige Differenzierung des Tumors nachweisbar sind. Eine systemische Chemotherapie kann bei Frauen mit nicht lokal therapierbarem Rezidiv oder bei Fernmetastasierung mit Plantinsalzen, Anthrazyklinen oder Taxanen durchgeführt werden.
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
- EMA: Fachinformation Jemperli
- Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge der Patientinnen mit Endometriumkarzinom, Langversion1.0, 2018, AWMF Registernummer: 032/034-OL (abgerufen am: 21.06.2021)
- Geisslinger, Menzel, Gundermann, Hinz, Ruth (2020) Mutschler Arzneimittelwirkungen, 11. Auflage, Wissenschaftliche Verlagsgesellschaft Stuttgart
- Abbildung: Adapted from „Immune Checkpoint Inhibitor Against Tumor Cell”, by BioRender.com












