Dronedaron
Dronedaron ist ein Klasse III Antiarrhythmikum, das zur Behandlung von klinisch stabilen Patienten mit nicht permanentem Vorhofflimmern zugelassen ist. Der Wirkstoff übt seine antiarrhythmische Wirkung durch Mehrkanalblockade von Natrium-, Kalium- und Calciumkanälen aus. Aufgrund seines Sicherheitsprofils sollte Dronedaron jedoch nur angewendet werden, nachdem alternative Behandlungsoptionen in Betracht gezogen wurden.
Dronedaron: Übersicht
Anwendung
Dronedaron ist ein Klasse III Antiarrhythmikum, das zur Aufrechterhaltung des Sinusrhythmus nach erfolgreicher Kardioversion bei erwachsenen, klinisch stabilen Patienten mit paroxysmalem oder persistierendem Vorhofflimmern indiziert ist.
Nach den aktuellen ESC-Leitlinien ist Dronedaron insbesondere bei Patienten mit Koronarer Herzerkrankheit, Hypertonie mit Linksherzhypertrophie oder stabiler Herzinsuffizienz (NYHA I–II) angezeigt.
Anwendungsart
Dronedaron ist in Form von Tabletten mit 400 mg unter dem Präparatenamen Multaq oder Generika erhältlich.
Wirkmechanismus
Dronedaron ist ein synthetisches Derivat von Amiodaron, einem Benzofuran-Derivat, das ein Strukturanalogon der Schilddrüsenhormone ist. Im Gegensatz zu Amiodaron und Thyroxin ist Dronedaron jedoch nicht jodiert und wurde speziell entwickelt, um einige der mit der Anwendung von Amiodaron verbundenen Nebenwirkungen zu vermeiden.
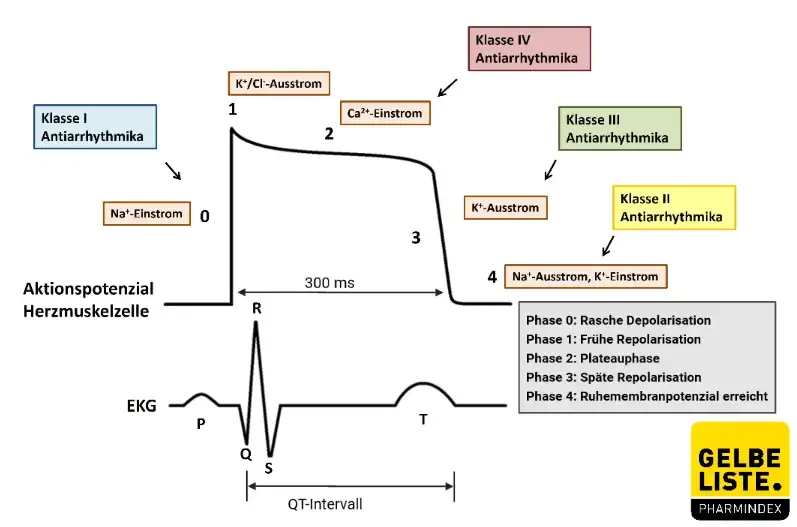
Klasse III Antiarrhythmika, wie Dronedaron, blockieren den hERG (human Ether-A-Go-Go Related Gen)-Kanal, was zu einer Verlangsamung des Herzschlages und einer Verlängerung des Aktionspotenzials führt. Im EKG kommt es zu einer Verlängerung der QT-Zeit.
Darüber hinaus bewirkt Dronedaron wie Amiodaron eine Hemmung von Natrium- und langsamer Calciumkanäle vom L-Typ.
Pharmakokinetik
- Dronedaron wird nach oraler Verabreichung gut resorbiert (70% - 94%)
- Die Resorption steigt um das 2- bis 3-fache, wenn der Wirkstoff zusammen mit Nahrung eingenommen wird.
- Dronedaron unterliegt einem signifikanten First-Pass-Metabolismus, der seine Netto-Bioverfügbarkeit auf 15% reduziert.
- Bei anhaltender Gabe von 400 mg zweimal täglich werden innerhalb von 7 Tagen Steady-State-Plasmakonzentrationen von 84 bis 167 ng/ml erreicht.
- Die Clearance erfolgt hauptsächlich nicht-renal mit einer terminalen Halbwertszeit von 24 Stunden.
- Dronedaron ist ein Substrat und ein moderater Inhibitor von CYP3A4.
Nebenwirkungen
Zu den Nebenwirkungen von Dronedaron gehören Magen-Darm-Störungen, Übelkeit, Durchfall, Kopfschmerzen und leichte Erhöhungen des Serumkreatinins. Jüngste große Langzeitstudien mit Dronedaron haben gezeigt, dass seine Anwendung mit einem erhöhten Risiko für kardiovaskuläre Ereignisse wie Herzinsuffizienz, Schlaganfälle und Todesfälle in bestimmten Bevölkerungsgruppen verbunden ist.
Wechselwirkungen
- Dronedaron ist ein Substrat und ein moderater Inhibitor von CYP3A4. Folglich sollte der Wirkstoff nicht zusammen mit starken CYP3A4-Inhibitoren wie Antimykotika, Makrolid-Antibiotika oder Protease-Inhibitoren sowie Verapamil und Diltiazem verabreicht werden.
- Die gleichzeitige Anwendung von Dronedaron und Digoxin führt zu einem 1,7- bis 2,5-fachen Anstieg der Digoxinkonzentration im Serum, wahrscheinlich aufgrund einer P-Glykoprotein-vermittelten Wechselwirkung.
- Die gleichzeitige Verabreichung von Dronedaron und Simvastatin, einem CYP3A4-Substrat, führt zu einem 2- bis 4-fachen Anstieg der Simvastatinspiegel und dem Potenzial für eine Statin-induzierte Myopathie.
- Dronedaron ist ein CYP2D6-Inhibitor und bewirkt eine mäßige Erhöhung der Bioverfügbarkeit von Metoprolol bei schnellen CYP2D6-Metabolisierern.
- Dronedaron verursacht eine teilweise Hemmung des tubulären Kreatinintransports, was zu einer Erhöhung der Serumkreatininkonzentration führt, die nicht mit einer verringerten glomerulären Filtration zusammenhängt.
Kontraindikationen
Dronedaron darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff
- Atrioventrikulärem Block zweiten oder dritten Grades, komplettem Schenkelblock, distalem Block, Sinusknotendysfunktion, atrialen Leitungsstörungen oder Sick-Sinus-Syndrom (außer bei Verwendung in Verbindung mit einem funktionierenden Schrittmacher)
- Bradykardie <50 Schläge pro Minute (bpm)
- Permanentem Vorhofflimmern mit einer Vorhofflimmern-Dauer ≥6 Monate (oder Dauer unbekannt) und Versuchen, den Sinusrhythmus wiederherzustellen, werden vom Arzt nicht mehr berücksichtigt
- instabilen hämodynamischen Zuständen
- Vorgeschichte oder aktueller Herzinsuffizienz oder linksventrikulärer systolischer Dysfunktion
- Leber- und Lungentoxizität im Zusammenhang mit der vorherigen Anwendung von Amiodaron
- Anwendung von starken Cytochrom P 450 (CYP) 3A4-Hemmern wie Ketoconazol, Itraconazol, Voriconazol, Posaconazol, Telithromycin, Clarithromycin, Nefazodon und Ritonavir
- Anwendung von Arzneimittel, die Torsade de Pointes induzieren, wie Phenothiazine, Cisaprid, Bepridil, trizyklische Antidepressiva, Terfenadin und bestimmte orale Makrolide (wie Erythromycin), Antiarrhythmika der Klassen I und III
- QTc-Bazett-Intervall ≥500 Millisekunden
- Schwerer Leberfunktionsstörung
- Schwerer Nierenfunktionsstörung (CrCl < 30 ml/min)
- Anwendung von Dabigatran
Schwangerschaft
Bisher liegen keine oder nur sehr begrenzte Erfahrungen mit der Anwendung von Dronedaron bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt, weshalb die Anwendung während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die nicht verhüten, nicht empfohlen wird.
Stillzeit
Es ist nicht bekannt, ob Dronedaron und seine Metaboliten beim Menschen in die Muttermilch übergehen. Die zur Verfügung stehenden pharmakodynamischen/toxikologischen Daten vom Tier zeigten, dass Dronedaron und seine Metaboliten in die Milch ausgeschieden werden. Da ein Risiko für das Neugeborene/Kind kann nicht ausgeschlossen werden kann, muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Dronedaron verzichtet bzw. die Behandlung unterbrochen werden soll. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
Verkehrstüchtigkeit
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Anwendungshinweise
- Während der Verabreichung von Dronedaron wird eine sorgfältige Überwachung durch regelmäßige Überprüfung der Herz-, Leber- und Lungenfunktion empfohlen.
- Wenn Vorhofflimmern erneut auftritt, sollte ein Absetzen von Dronedaron in Erwägung gezogen werden.
- Eine Überwachung von gleichzeitig verabreichten Arzneimitteln wie Digoxin und Antikoagulantien ist erforderlich.
- Eine klinische Studie bei Patienten mit permanentem VHF (VHF-Dauer von mindestens 6 Monaten) und kardiovaskulären Risikofaktoren wurde vorzeitig abgebrochen, da bei Patienten, die Dronedaron erhielten, vermehrt kardiovaskuläre Todesfälle, Schlaganfälle und Herzinsuffizienz auftraten. Es wird empfohlen, EKGs seriell durchzuführen, mindestens alle 6 Monate. Wenn mit Dronedaron behandelte Patienten dauerhaftes Vorhofflimmern entwickeln, sollte die Behandlung mit Dronedaron abgebrochen werden.
- Dronedaron ist kontraindiziert bei Patienten mit instabilem hämodynamischem Zustand, mit anamnestisch bekannter oder bestehender Herzinsuffizienz oder linksventrikulärer systolischer Dysfunktion.
- Patienten sollten sorgfältig auf Symptome einer dekompensierten Herzinsuffizienz untersucht werden. Während der Behandlung mit Dronedaron wurden spontan Fälle von neu aufgetretener oder sich verschlechternder Herzinsuffizienz berichtet. Patienten sollten angewiesen werden, einen Arzt zu konsultieren, wenn sie Anzeichen oder Symptome einer Herzinsuffizienz, wie Gewichtszunahme, abhängige Ödeme oder verstärkte Dyspnoe, entwickeln.
- Wenn sich eine Herzinsuffizienz entwickelt, sollte die Behandlung mit Dronedaron abgebrochen werden. Die Patienten sollten während der Behandlung auf die Entwicklung einer linksventrikulären systolischen Dysfunktion überwacht werden.
- Wenn sich eine linksventrikuläre systolische Dysfunktion entwickelt, sollte die Behandlung mit Dronedaron abgebrochen werden.
Wirkstoff-Informationen
- Steinhilber, Schubert, Zsilavecz, Roth "Medizinische Chemie", 2. Auflage 2010
- Mutschler Mutschler Arzneimittelwirkungen, Pharmakologie – Klinische Pharmakologie – Toxikologie, Begründet von Ernst Mutschler, 11., Auflage 2020, Wissenschaftliche Verlagsgesellschaft Stuttgart
- Fachinformation MULTAQ
- LiverTox: Clinical and Research Information on Drug-Induced Liver Injury, Dronedarone, Last Update: January 5, 2018
- Bostanitis I and Tsalidou M (2010). Pharmacokinetics of dronedarone. Front. Pharmacol. Conference Abstract: 8th Southeast European Congress on Xenobiotic Metabolism and Toxicity - XEMET 2010. doi: 10.3389/conf.fphar.2010.60.00108
-
Dronedaron AL 400 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Dronedaron Aristo 400 mg Filmtabletten
Aristo Pharma GmbH
-
Dronedaron beta 400 mg Filmtabletten
betapharm Arzneimittel GmbH
-
Dronedaron Puren 400 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Dronedaron-ratiopharm® 400 mg Filmtabletten
ratiopharm GmbH
-
Multaq 400 mg Abacus Filmtabletten
Abacus Medicine A/S
-
Multaq 400 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Multaq 400 mg Emra Filmtabletten
Emra-Med Arzneimittel GmbH
-
Multaq 400 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
MULTAQ® 400 mg Filmtabletten
Sanofi-Aventis Deutschland GmbH
-
Multaq 400 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Multaq 400 mg Orifarm Filmtabletten
Orifarm GmbH











