Durvalumab
Durvalumab ist ein monoklonaler Antikörper der zur Therapie von Lungenkrebs zugelassen ist. Das Immuntherapeutikum bindet an Krebszellen, die das so genannte PD-1 Oberflächenprotein exprimieren und ermöglicht so die Elimination durch körpereigene Immunzellen.
Durvalumab: Übersicht
Anwendung
Der monoklonale Antikörper Durvalumab (Imfinzi) wird bei lokal fortgeschrittenem inoperablem nicht kleinzelligen Lungenkarzinom (NSCLC) angewendet, das in ≥ 1 Prozent der Zellen PD-L1 (programmed death ligand 1) exprimiert. Für eine Anwendung darf die Erkrankung nach platinbasierter Radiochemotherapie nicht progredient gewesen sein.
In Kombination mit Gemcitabin und Cisplatin ist Durvalumab außerdem angezeigt für die Erstlinienbehandlung von Erwachsenen mit inoperablem oder metastasiertem Gallengangskarzinom.
Wirkmechanismus
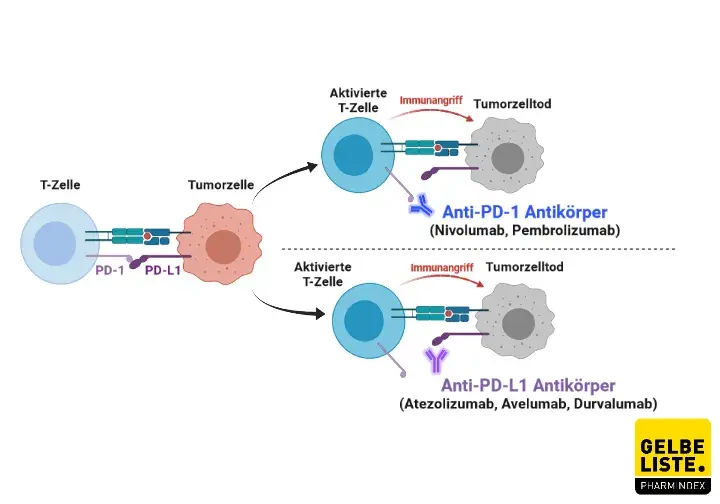
Der Checkpoint-Inhibitor Durvalumab bindet als PD-L1-Inhibitor an PD-L1, den Liganden des Oberflächenproteins PD-1. Durvalumab verhindert somit die Interaktion von PD-L1 mit PD-1 und dem CD80- Antigen der T-Zellen. Hierdurch werden Tumorzellen, die sich mithilfe von PD-1 dem Angriff des Immunsystems entziehen, einer Elimination durch körpereigene Immunzellen zugänglich gemacht.
Pharmakokinetik
- Bei Dosen < 3 mg/kg erhöhte sich in Studien die Exposition überdosisproportional und folgte somit einer nichtlinearen Pharmakokinetik. Bei Dosen ≥ 3 mg/kg lag eine dosisproportionale lineare Pharmakokinetik vor.
- Nach ca. 16 Wochen wurde der Steady-State erreicht.
- Bei einem Dosisbereich ≥ 10 mg/kg alle 2 Wochen betrug der geometrische Mittelwert des Verteilungsvolumens im Steady-State 5,64 l. Die Clearance verringerte sich mit der Zeit, was jedoch als nicht klinisch relevant angesehen wurde und erreichte an Tag 365 einen geometrischen Mittelwert im Steady-State von 8,16 ml/h.
- Die terminale Halbwertzeit betrug etwa 18 Tage. Durvalumab wird über Proteinkatabolismus über das retikuloendotheliale System oder über Elimination des Antikörper-Zielprotein-Komplexes ausgeschieden.
Dosierung
Die empfohlene Dosis beträgt 10 mg/kg Körpergewicht, die alle 2 Wochen als intravenöse Infusion über einen Zeitraum von 60 Minuten gegeben werden soll.
Die Behandlung erfolgt:
- bis zur Krankheitsprogression oder
- einer inakzeptablen Toxizität oder
- über maximal 12 Monate
Nebenwirkungen
Die häufigsten in klinischen Studien beschriebenen Nebenwirkungen waren (bei ≥ 20% Patienten):
- Husten
- Fatigue
- Dyspnoe
- radiogene Pneumonitis
15,4% der Patienten brachen die Therapie aufgrund von unerwünschten Ereignissen ab; Bei den mit Placebo behandelten Patienten waren es 9,8%.
Wechselwirkungen
Bei gleichzeitiger Anwendung von systemisch wirkenden Kortikosteroiden (Ausnahme systemische Kortikosteroide in physiologischer Dosis ≤10 mg/Tag Prednison oder ein entsprechendes Äquivalent) oder von Immunsuppressiva kann es zu einer Beeinflussung der pharmakodynamischen Aktivität und der Wirksamkeit von Durvalumab kommen.
Da Durvalumab durch Proteinkatabolismus über das retikuloendotheliale System oder die Zielstruktur-vermittelte Disposition eliminiert wird, werden keine metabolischen Arzneimittelwechselwirkungen erwartet.
Kontraindikation
Durvalumab darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff.
Schwangerschaft
Eine Therapie mit Durvalumab kann Auswirkungen auf die Aufrechterhaltung einer Schwangerschaft haben. In allogenen Trächtigkeitsmodellen der Maus führte eine Unterbrechung des PD-L1-Signalwegs zu einer Erhöhung der Abortrate. Tierexperimentelle Studien ergaben keine Hinweise auf eine Reproduktionstoxizität. In Tierstudien wurde außerdem die Plazentagängigkeit von Durvalumab nachgewiesen. Durvalumab kann deshalb möglicherweise den Fötus schaden. Eine Anwendung von Durvalumab sollte während der Schwangerschaft und bei Frauen im gebährfähigen Alter, die während der Behandlung und mindestens 3 Monate nach der letzten Dosis kein zuverlässiges Verhütungsmittel verwenden, nicht erfolgen.
Stillzeit
Es ist nicht bekannt, ob Durvalumab in die Muttermilch übergeht. Verfügbare toxikologische Daten von Cynomolgus-Affen haben niedrige Durvalumab-Konzentrationen in der Muttermilch an Tag 28 nach der Geburt gezeigt. Beim Menschen können Antikörper bekanntermaßen in die Muttermilch übergehen, jedoch ist das Potenzial für eine Resorption und Schädigung des Neugeborenen unbekannt.
Da ein Risiko für das gestillte Kind nicht ausgeschlossen werden kann, muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist, oder ob auf die Behandlung mit Durvalumab verzichtet werden sollte. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Behandlung für die Mutter zu berücksichtigen
Verkehrstüchtigkeit
Durvalumab hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Wirkstoff-Informationen
- EMA: Fachinformation Imfinzi
- Syed, Yahiya Y. "Durvalumab: first global approval." Drugs 77.12 (2017): 1369-1376.
- EMA: Summary of opinion (post authorisation) Imfinzi, 10 November 2022