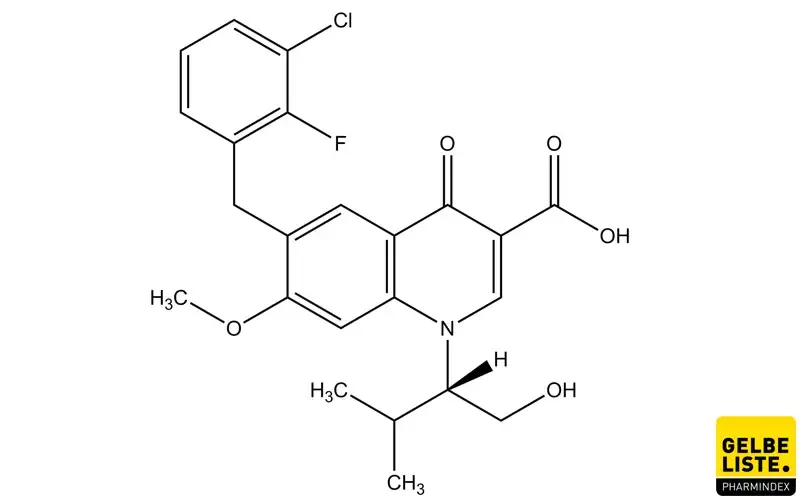
Elvitegravir
Elvitegravir ist ein Integrase-Inhibitor des humanen Immundefizienz-Virus Typ 1 (HIV-1), der innerhalb einer Kombinationsbehandlung einer HIV-1-Infektion bei antiretroviral vorbehandelten Erwachsenen angewendet wird.
Elvitegravir: Übersicht
Anwendung
Elvitegravir ist in Kombination mit Cobicistat, Emtricitabin und Tenofoviralafenamid zur Behandlung von HIV-1 bei antiretroviral vorbehandelten Erwachsenen indiziert.
Wirkmechanismus
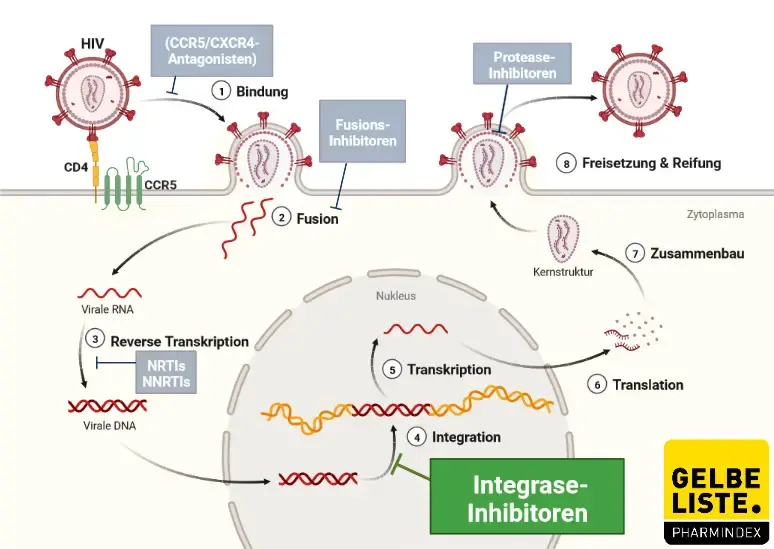
Elvitegravir ist ein HIV-1-Integrase-Inhibitor (INSTI). Integrase ist ein HIV-1-codiertes Enzym, das für die Virusreplikation erforderlich ist. Die Hemmung der Integrase verhindert die Integration von HIV-1-DNA in die genomische Wirts-DNA, blockiert die Bildung des HIV-1-Provirus und die Ausbreitung der Virusinfektion. Elvitegravir hemmt nicht die humanen Topoisomerasen I oder II.
Der Metabolismus von Elvitegravir wird hauptsächlich über intestinale und hepatische Cytochrom P450 (CYP) 3A-Enzyme vermittelt, weshalb die Pharmakoenhancer Ritonavir oder Cobicistat, beides CYP3A-Inhibitoren, bei gleichzeitiger Gabe eine hohe systemische Exposition und eine lange Eliminationshalbwertszeit (t1/2) von Elvitegravir verursachen, was eine einmal tägliche Dosierung ermöglicht.
Cobicistat besitzt hierbei ein besseres Nebenwirkungsprofil als Ritonavir und weist keine antivirale Aktivität auf, was der Entwicklung einer Resistenz gegenüber Protease-Inhibitoren entgegenwirken soll.
Pharmakokinetik
Resorption
- Nach oraler Einnahme mit Nahrung erreicht geboostertes Elvitegravir seine Cmax etwa 4,0–4,5 Stunden nach der Einnahme, was auf eine langsame Resorption hindeutet (Lag-Time ∼0,84 Stunden).
- Durch die löslichkeitsbegrenzte Auflösung aufgrund seiner geringen Wasserlöslichkeit zeigt Elvitegravir eine unterproportionale Exposition (AUCτ) über einen Dosisbereich von 50–300 mg.
- Die Resorption von Elvitegravir wird nicht durch pH-Änderungen im Gastrointestinaltrakt beeinflusst und wird durch hohe Konzentrationen zwei-/dreiwertiger Kationen, die in Antazida enthalten sind, vermutlich durch lokale Komplexierung, verringert.
- In-vitro-Studien haben eine minimale Rolle von P-Glykoprotein (Pgp) bei der Permeabilität und Resorption von Elvitegravir gezeigt; Darüber hinaus ist Elvitegravir ein schwacher Inhibitor von Pgp.
Verteilung
- Elvitegravir wird zu 99,4% an menschliche Plasmaproteine gebunden , wobei die Bindung an Albumin gegenüber saurem α1-Glykoprotein bevorzugt wird.
- Bei HIV-infizierten Patienten und gesunden Probanden (jeweils eine klinische Studie) war Elvitegravir stark an Proteine gebunden, mit Plasma-freien Anteilen von ∼1,0%.
- In einer Massenbilanzstudie beim Menschen betrug das Blut-Plasma-Verhältnis von Elvitegravir 0,73, was darauf hindeutet, dass es weitgehend auf das Plasma beschränkt ist und sich relativ mäßig in die zellulären Bestandteile des Blutes verteilt.
- Das Eindringen von Elvitegravir in HIV-Reservoirs wie Liquor, Sperma oder den weiblichen Genitaltrakt wurde nicht klinisch untersucht.
Metabolisierung
- Die Biotransformation von Elvitegravir erfolgt hauptsächlich über CYP-vermittelte aromatische und aliphatische Hydroxylierung und/oder primäre oder sekundäre Glucuronidierung.
- Bei ungeboosterter Verabreichung gibt es zwei primäre Metaboliten, M1 (GS-9202), produziert von CYP3A4, und deren Bildung fast vollständig gehemmt wird, wenn es mit Ritonavir oder Cobicistat verabreicht wird (typischerweise unterhalb der unteren Quantifizierungsgrenze in klinischen Studien), und M4 (GS -9200), produziert von der Uridindiphosphat-Glucuronosyltransferase (UGT) 1A1/3, deren Plasmaexposition (AUCτ) typischerweise <10% der für Elvitegravir beobachteten Plasmaexposition beträgt.
- Die M1- und M4-Metaboliten sind deutlich weniger wirksam (M1: 5- bis 18-fach und M4: 10- bis 38-fach in Tests zur antiviralen Aktivität) gegenüber der Ausgangssubstanz.
- Alle beobachteten Metaboliten, einschließlich mehrerer Nebenmetaboliten, machen beim Menschen eine relative systemische Exposition (AUCτ) der Muttersubstanz von <10% aus.
Elimination
- Nach Verabreichung von [14C] Elvitegravir/Ritonavir 50 mg/100 mg wurden 94,8% der Dosis im Stuhl wiedergefunden, was mit der hepatobiliären Ausscheidung von Elvitegravir übereinstimmt; 6,7% der verabreichten Dosis wurden im Urin wiedergefunden.
- Im Plasma war Elvitegravir die vorherrschende Spezies, die etwa 93% der zirkulierenden Radioaktivität ausmachte.
- Die mittleren (% Variationskoeffizient) CL/F-Werte von Elvitegravir nach oraler Mehrfachgabe ohne und mit Ritonavir betrugen 119 (30%) bzw. 4,8 (11%) l/h.
Dosierung
Die übliche Dosierung beträgt 50 mg Elvitegravir, 150 mg Cobicistat, 200 mg Emtricitabin und 10 mg Tenofoviralafenamid einmal täglich.
Nebenwirkungen
Die am häufigsten gemeldeten Nebenwirkungen der Kombinationstherapie in klinischen Studien waren:
- Übelkeit (11%)
- Diarrhoe (7%)
- Kopfschmerzen (6%)
Wechselwirkungen
In-vitro-Studien zum Elvitegravir-Metabolismus mit gereinigten humanen CYP-Enzymen haben gezeigt, dass Elvitegravir hauptsächlich durch CYP3A-Enzyme metabolisiert wird. Die Induktionsstärke von Elvitegravir auf Arzneimittel metabolisierende Enzyme in der Leber wurde durch Assays der Enzymaktivitäten (CYP1A2, CYP2C9, CYP2C19 und CYP3A) in frischen primär kultivierten humanen Hepatozyten untersucht. Elvitegravir erwies sich als dosisabhängiger Induktor von CYP3A mit Induktionsverhältnissen von 10.000 n/ml, die 41–56% derjenigen in der Rifampicin-positiven Kontroll-Expositionsgruppe. In ähnlicher Weise zeigte auch Elvitegravir eine dosisabhängige Induktion von CYP2C9 mit Induktionsverhältnissen bei 10.000 n/ml, die 47–63% derjenigen der Rifampicin-positiven Kontrolle. Elvitegravir schien die CYP1A2-Aktivität in den untersuchten Konzentrationen (bis zu 10.000 n/ml) nicht zu beeinflussen.
Kontraindikationen
Elvitegravir und seine Kombinationspartner dürfen nicht angewendet werden bei:
- Überempfindlichkeit gegen die Wirkstoffe
- Gleichzeitiger Anwendung von Arzneimitteln, deren Clearance stark von CYP3A abhängig ist und bei denen erhöhte Plasmakonzentrationen mit schwerwiegenden oder lebensbedrohlichen Nebenwirkungen assoziiert sind.
Zu diesen Arzneimitteln zählen:
- Alpha-1-Adrenozeptor-Antagonisten: Alfuzosin
- Antiarrhythmika: Amiodaron, Chinidin
- Ergotaminderivate: Dihydroergotamin, Ergometrin, Ergotamin
- Wirkstoffe zur Verbesserung der gastrointestinalen Motilität: Cisaprid
- HMG-CoA-Reduktasehemmer: Lovastatin, Simvastatin
- Lipidmodifizierender Wirkstoff: Lomitapid
- Neuroleptika/Antipsychotika: Pimozid, Lurasidon
- PDE-5-Hemmer: Sildenafil zur Behandlung der pulmonalen arteriellen Hypertonie
- Sedativa/Hypnotika: oral angewendetes Midazolam, Triazolam
- Starke CYP3A-Induktoren
- Antikonvulsiva: Carbamazepin, Phenobarbital, Phenytoin
- Antimykotika: Rifampicin
- Pflanzliche Präparate: Johanniskraut (Hypericum perforatum)
- Dabigatranetexilat (P-gp-Substrat)
Wirkstoff-Informationen
- Fachinformation Genvoya
- Ramanathan, Srinivasan, et al. "Clinical pharmacokinetic and pharmacodynamic profile of the HIV integrase inhibitor elvitegravir." Clinical pharmacokinetics 50.4 (2011): 229-244.
Abbildung
Adapted from „HIV Sites for Therapeutic Intervention”, by BioRender.com











