Emicizumab
Emicizumab ist ein bispezifischer Antikörper, der zur Behandlung von Blutungsereignissen bei Patienten mit angeborenen Faktor-VIII-Mangel (Hämophilie A) und Faktor-VIII-Antikörpern angewendet wird. Das Biological wird subkutan appliziert und führt zu einer signifikanten Reduktion behandlungsbedürftiger Blutungen.
Emicizumab: Übersicht
Anwendung
Der monoklonale Antikörper Emicizumab ist zur subkutanen Gabe als Routineprophylaxe von Blutungsereignissen bei Patienten mit Hämophilie A und Faktor-VIII-Hemmkörpern in allen Altersgruppen zugelassen.
Wirkmechanismus
Emicizumab ist ein chimärer, bispezifischer, humanisierter monoklonaler Antikörper, der die Aktivierung von Faktor-IXa und Faktor-X vermittelt. Diese Aktivierung erfolgt ist in der Regel durch den Gerinnungsfaktor VIII, der bei Hämophilie-A-Patienten jedoch fehlt.
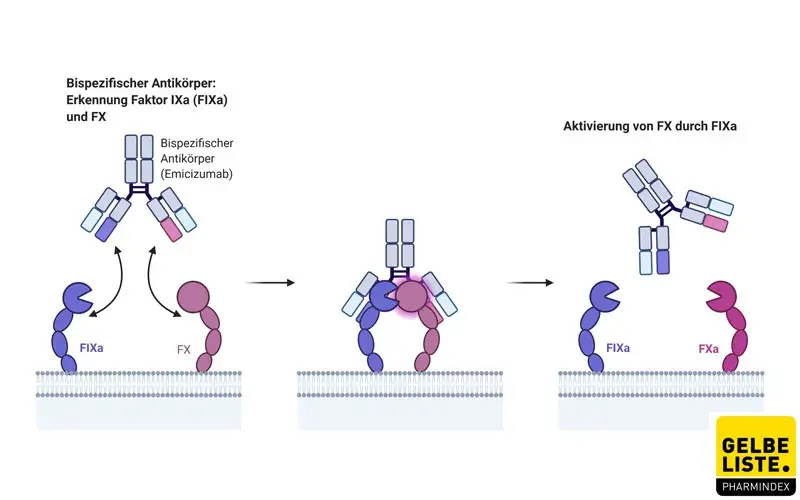
Pharmakokinetik
- Die Resorptionshalbwertszeit betrug nach subkutaner Applikation 1,7 Tage.
- Die absolute Bioverfügbarkeit nach subkutaner Verabreichung von 1 mg/kg lag in Abhängigkeit von der Injektionsstelle zwischen 80,4 % und 93,1 %.
- Nach einer einzelnen intravenösen Dosis von 0,25 mg/kg Emicizumab betrug das Verteilungsvolumen im Steady State 106 ml/kg (d.h. 7,4 l bei einem Erwachsenen mit einem Körpergewicht von 70 kg).
- Der Abbau von IgG-Antikörpern erfolgt hauptsächlich durch lysosomale Proteolyse
- Die Gesamt- Clearance von Emicizumab lag nach intravenöser Applikation von 0,25 mg/kg bei 3,26 ml/kg/Tag (d.h. 0,228 l/Tag bei einem Erwachsenen mit einem Körpergewicht von 70 kg); Die mittlere terminale Halbwertszeit betrug 26,7 Tage.
- Nach einer einzelnen subkutanen Injektion lag die Eliminations- Halbwertszeit bei etwa 4 bis 5 Wochen.
- Nach mehreren subkutanen Injektionen bei Patienten mit Hämophilie A betrug die scheinbare Clearance 0,244 l/Tag und die scheinbare Eliminations-Halbwertszeit lag bei 27,8 Tagen.
Dosierung
Die empfohlene Initialdosis beträgt 3 mg/kg einmal wöchentlich in den ersten 4 Wochen (Initialdosis). Danach folgt die Erhaltungsdosis von 1,5 mg/kg einmal wöchentlich.
Die Dosis des Patienten (in mg) und das Volumen (in ml) sollte wie folgt berechnet werden:
Initialdosis (3 mg/kg) einmal wöchentlich in den ersten 4 Wochen:
- Körpergewicht des Patienten (kg) x Dosis (3 mg/kg) = Gesamtmenge (mg) Emicizumab, die angewendet werden soll
Erhaltungsdosis (1,5 mg/kg) einmal wöchentlich ab Woche 5:
- Körpergewicht des Patienten (kg) x Dosis (1,5 mg/kg) = Gesamtmenge (mg) Emicizumab, die angewendet werden soll.
Nebenwirkungen
Zu den häufigen Nebenwirkungen in klinischen Studien zählen:
- Reaktionen an der Injektionsstelle
- Kopfschmerzen
- Fieber
- Durchfall
- Myalgie
- Arthralgie
Zu den schwerwiegenden Nebenwirkungen zählen:
- thrombotische Mikroangiopathien und thrombotische Ereignisse einschließlich Thrombosen des Sinus cavernosus
- oberflächliche Thrombophlebitiden begleitet von Hautnekrosen
Wechselwirkungen
- Bei gleichzeitiger Gabe von Emicizumab und aPCC (activated prothrombin complex concentrates)/FEIBA (Factor eight inhibitor bypass activity) traten in klinischen Studien Fälle von thrombotischer Mikroangiopathie (TMA) sowie Thromboembolien auf. Aus diesem Grund sollte die gleichzeitige Anwendung vermieden werden.
- Da Emicizumab das Gerinnungspotenzial erhöht, kann die erforderliche Dosis eines Bypassing-Präparates niedriger sein als ohne Prophylaxe mit Emicizumab. Die Dosis und die Anwendungsdauer des Bypassing-Präparates hängen von der Lokalisation und dem Ausmaß der Blutung sowie dem klinischen Zustand des Patienten ab. Die Anwendung von aPCC (activated prothrombin complex concentrates) sollte vermieden werden, solange keine anderen Therapieoptionen zur Verfügung stehen.
- Eine Kombination der Gerinnungsfaktoren rFVIIa oder FVIII mit Emicizumab kann zu einer Hyperkoagulabilität führen.
- Eine Anwendung systemischer Antifibrinolytika in Kombination mit aPCC oder rFVIIa bei Patienten, die Emicizumab erhalten, kann das Auftretens thrombotischer Ereignisse begünstigen.
Kontraindikationen
Das Medikamenter darf nicht angewendet werden bei bekannter Überempfindlichkeit gegen den Antikörper.
Schwangerschaft
Es ist nicht bekannt, ob Emicizumab dem Fötus schadet oder die Reproduktionsfähigkeit beeinflusst. Für eine Anwendung sollte deshalb der zu erwartende Nutzen für die Mutter das mögliche Risiko für den Fötus übersteigen. Es soll beachtet werden, dass während der Schwangerschaft und nach der Entbindung ein erhöhtes Thromboserisiko vorliegt und dass verschiedene Schwangerschaftskomplikationen mit einem erhöhten Risiko für disseminierte intravasale Koagulopathie (DIC) verbunden sind.
Stillzeit
Es ist nicht bekannt, ob Emicizumab in die Muttermilch übergeht. Allerdings kommt humanes IgG in der Muttermilch vor. Es muss deshalb eine Entscheidung darüber getroffen werden, ob abgestillt oder die Therapie mit Emicizumab abgebrochen werden sollte. Eine Abwägung zwischen Nutzen und Risiko soll durchgeführt werden.
Verkehrstüchtigkeit
Emicizumab hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
[1] Fachinformation Hemlibra
Abbildung: Adapted from „Emicizumab Mechanism of Action”, by BioRender.com (2020)
-
Hemlibra® 30 mg/ml Injektionslösung, 0,4 ml
Roche Pharma AG
-
Hemlibra® 30 mg/ml Injektionslösung, 1 ml
Roche Pharma AG
-
Hemlibra® 150 mg/ml Injektionslösung, Durchstechfl. 0,4 ml
Roche Pharma AG
-
Hemlibra® 150 mg/ml Injektionslösung, Durchstechfl. 0,7 ml
Roche Pharma AG
-
Hemlibra® 150 mg/ml Injektionslösung, Durchstechfl. 1 ml
Roche Pharma AG











