Encorafenib
Encorafenib ist ein RAF-Kinase-Inhibitor, der in Kombination mit Binimetinib zur Behandlung von metastasiertem Melanom mit einer BRAF-V600-Mutation und in Kombination mit Cetuximab zur Behandlung von metastasiertem Kolorektalkarzinom mit einer BRAF-V600E-Mutation angewendet wird.
Encorafenib: Übersicht
Anwendung
Encorafenib ist angezeigt:
- in Kombination mit Binimetinib zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation.
- in Kombination mit Cetuximab zur Behandlung von erwachsenen Patienten mit metastasiertem Kolorektalkarzinom (CRC) mit einer BRAF-V600E-Mutation, die eine systemische Vortherapie erhalten haben.
Wirkmechanismus
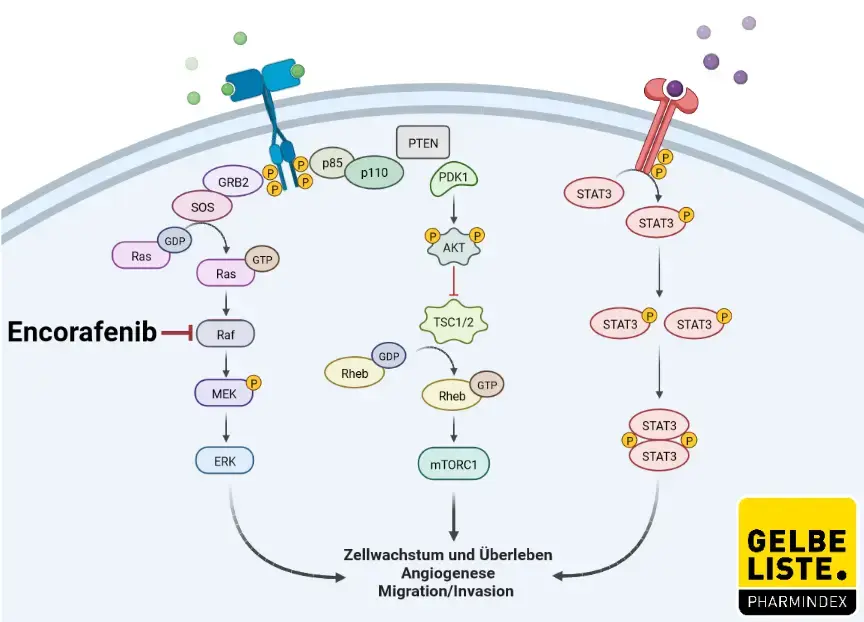
Encorafenib ist ein ATP-kompetitiver Kinase-Inhibitor, der spezifisch auf BRAF V600E sowie Wildtyp-BRAF und CRAF abzielt. Mutationen im BRAF-Gen, einschließlich BRAF V600E, führen zu aktivierten BRAF-Kinasen, die das Tumorzellwachstum stimulieren können. In Wirksamkeitsstudien hemmte Encorafenib das In-vitro-Zellwachstum von Tumorzelllinien, die BRAF-V600-E-, -D- und -K-Mutationen exprimieren. Bei Mäusen, denen Tumorzellen implantiert wurden, die die BRAF-V600E-Mutation exprimieren, induzierte Encorafenib Tumorregressionen, die mit einer Unterdrückung des RAF/MEK/ERK-Signalwegs einhergingen.
Kombination mit Binimetinib
Encorafenib und Binimetinib zielen auf zwei verschiedene Kinasen im RAS/RAF/MEK/ERK-Signalweg ab. Im Vergleich zu beiden Arzneimitteln allein führt die gleichzeitige Anwendung von Encorafenib und Binimetinib zu einer stärkeren antiproliferativen Aktivität und einer stärkeren Antitumoraktivität in Bezug auf die Hemmung des Tumorwachstums.
Kombination mit Cetuximab
Einer der Hauptmechanismen der Resistenz des BRAF-mutierten CRC gegenüber RAF-Inhibitoren ist die Reaktivierung von EGFR (Epidermal Growth Factor Receptor) unter Umgehung der Signaltransduktion über BRAF. Kombinationen aus einem BRAF-Inhibitor (z. B. Encorafenib) und gegen EGFR gerichteten Wirkstoffen (z. B. Cetuximab) haben in präklinischen Modellen eine verbesserte Antitumor-Wirksamkeit gezeigt.
Pharmakokinetik
- Oral angewendetes Encorafenib ist beim Menschen hochgradig bioverfügbar (ca. 85%) und wird schnell resorbiert, mit einer medianen Zeit bis zur Tmax von etwa 2 Stunden nach Einnahme.
- Die Plasmaeliminationshalbwertszeit von Encorafenib beträgt etwa 6 Stunden.
- Die Elimination von Encorafenib erfolgt hauptsächlich durch Metabolisierung über Cytochrom P450 (CYP)-Enzyme (CYP3A4, CYP2C19 und CYP2D6).
- Encorafenib wiederum wirkt als Induktor von CYP-Enzymen, was zu einer beständigen Abnahme der Exposition an Tag 15 um 30–60% im Vergleich zu Tag 1 führt.
- Etwa 20 verschiedene Metaboliten von Encorafenib wurden identifiziert und werden zu gleichen Teilen in Urin und Stuhl ausgeschieden.
- Etwa 2 bzw. 5% des resorbierten Encorafenib werden unverändert im Urin bzw. im Stuhl ausgeschieden.
- Nahrungsaufnahme verzögert die Resorption von Encorafenib, verändert aber nicht die Gesamtwirkstoffexposition, weshalb Encorafenib-Kapseln unabhängig von der Nahrungsaufnahme eingenommen werden können.
Dosierung
- Die empfohlene Dosis von Encorafenib bei der Behandlung des Melanoms beträgt 450 mg einmal täglich bei Einnahme in Kombination mit Binimetinib.
- Zur Behandlung des Kolorektalkarzinoms wird eine Dosis von 300 mg Encorafenib einmal täglich bei Anwendung in Kombination mit Cetuximab empfohlen.
Nebenwirkungen
Die häufigsten Nebenwirkungen (≥25%) unter Encorafenib sind:
- Hyperkeratose
- Alopezie
- Palmar-Plantares Erythrodysästhesie-Syndrom (PPES)
- Fatigue
- Hautausschlag
- Arthralgie
- trockene Haut
- Übelkeit
- Myalgie
- Kopfschmerzen
- Erbrechen
- Pruritus
Wechselwirkungen
Folgende Wechselwirkungen müssen bei der Anwendung von Encorafenib beachtet werden:
- CYP3A4-Inhibitoren: Da Encorafenib vorwiegend durch CYP3A4 metabolisiert wird, kann die gleichzeitige Anwendung von CYP3A4-Inhibitoren zu einer erhöhten Encorafenib-Exposition und einem Anstieg der Toxizität führen. Die gleichzeitige Anwendung von Encorafenib mit starken CYP3A4-Inhibitoren sollte vermieden werden und die gleichzeitige Anwendung von moderaten CYP3A4-Inhibitoren nur mit Vorsicht erfolgen.
- CYP3A4-Induktoren: Die gleichzeitige Anwendung von CYP3A4-Induktoren kann zu einer Verringerung der Encorafenib-Exposition führen und somit die Wirksamkeit beeinträchtigen.
- CYP-Substrate: Encorafenib ist sowohl ein Inhibitor als auch ein Induktor von CYP3A4. Die gleichzeitige Anwendung von CYP3A4-Substraten (z. B. hormonelle Kontrazeptiva) kann zu einer erhöhten Toxizität oder zum Wirksamkeitsverlust dieser Substanzen führen.
- Substrate von UGT1A1: Encorafenib ist ein UGT1A1-Inhibitor, weshalb bei gleichzeitiger Anwendung von UGT1A1-Substraten (z. B. Raltegravir, Atorvastatin, Dolutegravir), deren Exposition erhöht sein kann.
- Transporter Substrate: In vivo ist Encorafenib ein Inhibitor von OATP1B1, OATP1B3 und/oder BCRP. Die gleichzeitige Verabreichung von Encorafenib mit OATP1B1-, OATP1B3- oder BCRP-Substraten (wie Rosuvastatin, Atorvastatin oder Methotrexat) kann zu erhöhten Konzentrationen führen. Wirkstoffe, die Substrate der renalen Transporter OAT1, OAT3, OCT2 (wie Furosemid oder Penicillin), des hepatischen Transporters OCT1 (wie Bosentan) oder von P-gp (z. B. Posaconazol) sind, können ebenfalls eine erhöhte Exposition aufweisen.
Kontraindikationen
Encorafenib darf nicht bei Überempfindlichkeit gegen den Wirkstoff angewendet werden.
Schwangerschaft
Bisher liegen keine Erfahrungen mit der Anwendung von Encorafenib bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt. Encorafenib wird während der Schwangerschaft sowie bei gebärfähigen Frauen, die keine Kontrazeptiva anwenden, nicht empfohlen. Wenn Encorafenib während der Schwangerschaft angewendet wird oder die Patientin während der Behandlung mit Encorafenib schwanger wird, muss sie über die potenziellen Risiken für das ungeborene Kind aufgeklärt werden.
Stillzeit
Es ist nicht bekannt, ob Encorafenib oder seine Metabolite beim Menschen in die Muttermilch übergehen. Ein Risiko für Neugeborene/Säuglinge kann nicht ausgeschlossen werden. Es ist zu entscheiden, ob das Stillen beendet oder die Encorafenib-Therapie abgesetzt wird. Dabei sind sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Mutter in
Betracht zu ziehen.
Verkehrstüchtigkeit
Encorafenib hat geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. In klinischen Studien sind bei einigen Patienten unter Encorafenib Sehstörungen
aufgetreten. Die Patienten sollten darauf hingewiesen werden, keine Fahrzeuge zu lenken oder Maschinen zu bedienen, wenn bei ihnen Sehstörungen oder andere Nebenwirkungen auftreten, die ihre Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen können.
Wirkstoff-Informationen
- Fachinformation Braftovi
- Koelblinger P, Thuerigen O, Dummer R. Development of encorafenib for BRAF-mutated advanced melanoma. Curr Opin Oncol. 2018 Mar;30(2):125-133. doi: 10.1097/CCO.0000000000000426. PMID: 29356698; PMCID: PMC5815646.
Abbildung
Adapted from „ PI3K/Akt, RAS/MAPK, JAK/STAT Signaling”, by BioRender.com
-
Braftovi 50 mg Abacus Hartkapseln
Abacus Medicine A/S
-
Braftovi® 50 mg Hartkapseln
Pierre Fabre Pharma GmbH
-
Braftovi 75 mg Abacus Hartkapseln
Abacus Medicine A/S
-
Braftovi 75 mg axicorp Hartkapseln
axicorp Pharma B.V.
-
Braftovi 75 mg CC Pharma Hartkapseln
CC Pharma GmbH
-
Braftovi 75 mg Eurim Hartkapseln
Eurim-Pharm Arzneimittel GmbH
-
Braftovi® 75 mg Hartkapseln
Pierre Fabre Pharma GmbH
-
Braftovi 75 mg kohlpharma Hartkapseln
kohlpharma GmbH
-
Braftovi 75 mg Orifarm Hartkapseln
Orifarm GmbH













