Enfortumab vedotin
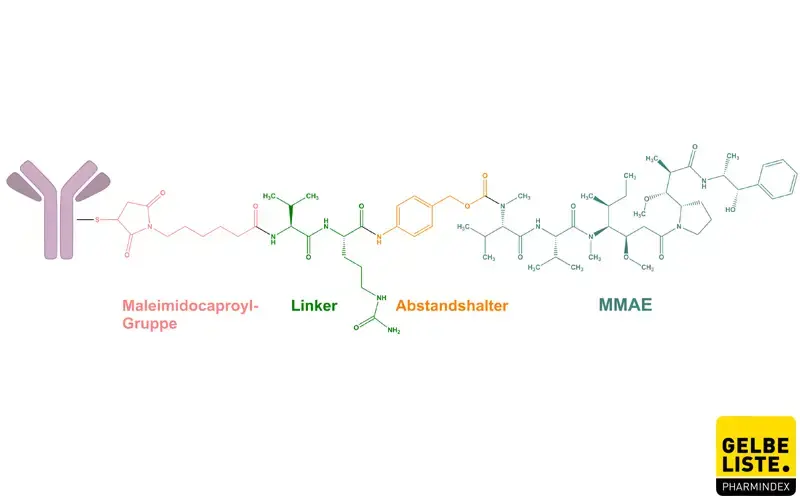
Enfortumab Vedotin ist ein gegen Nectin-4 gerichtetes Antikörper-Wirkstoff-Konjugat zur Behandlung von fortgeschrittenem oder metastasiertem Urothelkarzinom. Das Antikörper-Wirkstoff-Konjugat ist mit dem Anti-Mikrotubuli-Medikament Monomethylauristatin E konjugiert. Sobald der Antikörper die Nectin-4-exprimierende Zelle bindet, wird das Konjugat internalisiert und das Chemotherapeutikum freigesetzt.
Enfortumab Vedotin: Übersicht
Anwendung
Enfortumab Vedotin (Padcev) ist als Monotherapie angezeigt zur Behandlung von erwachsenen Patienten mit lokal fortgeschrittenem oder metastasiertem Urothelkarzinom, die zuvor eine platinhaltige Chemotherapie und einen PD-1- oder PD-L1-Inhibitor erhalten haben.
Anwendungsart
Padcev ist zur intravenösen Anwendung bestimmt. Die empfohlene Dosis muss als intravenöse Infusion über 30 Minuten verabreicht werden. Enfortumab Vedotin darf nicht als intravenöse Druck-oder Bolusinjektion verabreicht werden.
Wirkmechanismus
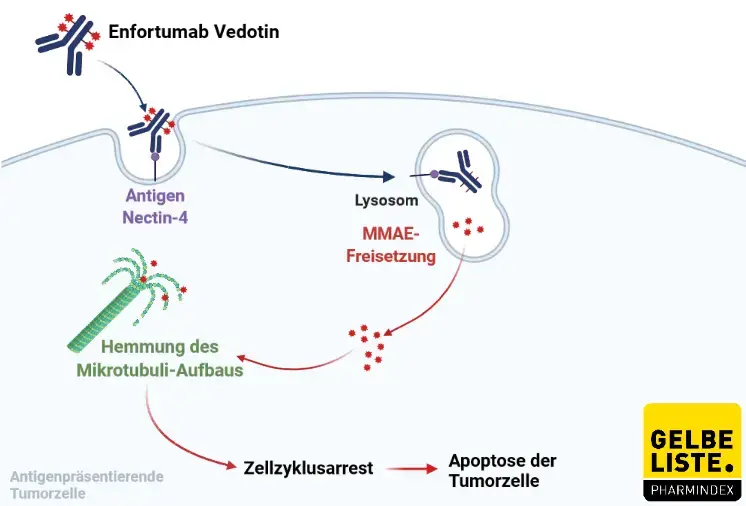
Enfortumab Vedotin (EV) besteht aus einem vollständig humanen monoklonalen Antikörper, der gegen Nectin-4 gerichtet ist, welches bei einer Reihe von Krebsarten überexprimiert ist (v.a. bei Urothelkarzinom, Colitis ulcerosa und Brustkrebs).
Der EV-Antikörper bindet mit hoher Affinität und Spezifität an Nectin-4-exprimierende Zellen, wodurch eine Kreuzreaktivität mit anderen Nectin-exprimierenden Zellen verhindert wird. Sobald gebundenes EV internalisiert wurde, führt dies zur intrazellulären Freisetzung des Mikrotubuli-störenden Wirkstoffs Monomethylauristatin E (MMAE), was schließlich zur Apoptose der Tumorzelle führt.
Pharmakokinetik
Verteilung
- Die mittlere Schätzung des Steady-State-Verteilungsvolumens von ADC betrug 12,8 l nach Verabreichung von 1,25 mg/kg Enfortumab Vedotin.
- In vitro reichte die Bindung von MMAE an menschliche Plasmaproteine von 68% bis 82%.
- Es ist unwahrscheinlich, dass MMAE stark proteingebundene Arzneimittel verdrängt oder von diesen verdrängt wird.
- In vitro-Studien weisen darauf hin, dass MMAE ein Substrat von P-Glykoprotein ist.
Biotransformation
- Ein kleiner Teil des aus Enfortumab Vedotin freigesetzten MMAE wird metabolisiert.
- In vitro-Daten weisen darauf hin, dass der Metabolismus von MMAE hauptsächlich mittels Oxidation durch CYP3A4 erfolgt.
Elimination
- Die mittlere Clearance von ADC bzw. unkonjugiertem MMAE bei Patienten betrug 0,11 l/h bzw. 2,11 l/h.
- Die ADC-Elimination zeigte einen multi-exponentiellen Abfall mit einer Halbwertszeit von 3,6 Tagen.
- Die Elimination von MMAE schien durch seine Freisetzungsrate aus Enfortumab Vedotin begrenzt zu sein.
- Die MMAE-Elimination zeigte einen multi-exponentiellen Abfall mit einer Halbwertszeit von 2,6 Tagen.
- Die Ausscheidung von MMAE erfolgt hauptsächlich mit den Fäzes und zu einem geringeren Anteil mit dem Urin.
- Nach einer Einzeldosis eines anderen ADC, das MMAE enthielt, wurden über einen Zeitraum von einer Woche ca. 24% des insgesamt verabreichten MMAE in Fäzes und Urin als unverändertes MMAE wiedergefunden.
- Der Großteil des wiedergefundenen MMAE wurde mit den Fäzes ausgeschieden (72%). Ein ähnliches Ausscheidungsprofil wird für MMAE erwartet.
Dosierung
Die empfohlene Dosis von Enfortumab Vedotin beträgt 1,25 mg/kg (bis zu einem Maximum von 125 mg für Patienten ≥ 100 kg), verabreicht als intravenöse Infusion über 30 Minuten an den Tagen 1, 8 und 15 eines 28-tägigen Zyklus bis zur Progression der Erkrankung oder bis zum Auftreten inakzeptabler Toxizität. Der Fachinformation kann eine Tabelle zu Dosisanpassungen und Dosisreduktionen entnommen werden.
Nebenwirkungen
Die häufigsten Nebenwirkungen mit Enfortumab Vedotin waren:
- Alopezie (48,8%)
- Fatigue (46,8%)
- verminderter Appetit (44,9%)
- periphere sensorische Neuropathie (38,7%)
- Diarrhoe (37,6%)
- Übelkeit (36%)
- Pruritus (33,4%)
- Dysgeusie (29,9%)
- Anämie (26,5%)
- erniedrigtes Gewicht (23,4%)
- makulopapulöser Ausschlag (22,9%)
- trockene Haut (21,6%)
- Erbrechen (18,4%)
- Erhöhte Aspartataminotransferase (15,3%)
- Hyperglykämie (13,1%)
- trockenes Auge (12,8%)
- erhöhte Alaninaminotransferase (12,1%)
- Ausschlag (10,4%)
Die häufigsten schwerwiegenden Nebenwirkungen waren Diarrhoe (2%) und Hyperglykämie (2%).
Wechselwirkungen
Es wurden keine Studien zur Erfassung von Arzneimittelwechselwirkungen mit Enfortumab Vedotin durchgeführt. Die gleichzeitige Anwendung von Enfortumab Vedotin und Arzneimitteln, die über CYP3A4 (Substrate) metabolisiert werden, birgt kein klinisch relevantes Risiko einer Induktion pharmakokinetischer Interaktionen.
Wirkung anderer Arzneimittel auf Enfortumab Vedotin
- CYP3A4-Inhibitoren, -Substrate oder -Induktoren: Die gleichzeitige Anwendung mit Ketoconazol (einem kombinierten P-Glykoprotein [P-gp]- und starken CYP3A-Inhibitor) erhöht voraussichtlich die cmax des unkonjugierten MMAE und AUC-Exposition in geringem Maße, wobei sich die Antikörper-Wirkstoff-Konjugat-Exposition nicht ändert.
- Bei einer gleichzeitigen Behandlung mit CYP3A4-Inhibitoren ist Vorsicht geboten.
- Patienten, die gleichzeitig starke CYP3A4-Inhibitoren erhalten (z. B. Boceprevir, Clarithromycin, Cobicistat, Indinavir, Itraconazol, Nefazodon, Nelfinavir, Posaconazol, Ritonavir, Saquinavir, Telaprevir, Telithromycin, Voriconazol) sollen engmaschiger auf Anzeichen für Toxizitäten überwacht werden.
- Unkonjugiertes MMAE wird voraussichtlich nicht die AUC von gleichzeitig angewendeten Arzneimitteln, die CYP3A4-Substrate sind (z. B. Midazolam), verändern.
- Starke CYP3A4-Induktoren (z. B. Rifampicin, Carbamazepin, Phenobarbital, Phenytoin, Johanniskraut [Hypericum perforatum]) können möglicherweise die Exposition von unkonjugiertem MMAE mit moderatem Effekt reduzieren.
Kontraindikationen
Enfortumab Vedotin darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels.
Schwangerschaft
Die Anwendung von Enfortumab Vedotin wird während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine wirksame Verhütungsmethode anwenden, nicht empfohlen, da Enfortumab Vedotin den Fetus schädigen kann. Studien zur Embryo-fetalen-Entwicklung an weiblichen Ratten haben gezeigt, dass die intravenöse Verabreichung von Enfortumab Vedotin zu einer verminderten Anzahl lebensfähiger Feten, einer reduzierten Wurfgröße und vermehrten frühen Resorptionen führte.
Stillzeit
Es ist nicht bekannt ob Enfortumab Vedotin in die Muttermilch übergeht. Da ein Risiko für gestillte Kinder nicht ausgeschlossen werden kann, soll das Stillen während der Behandlung und für mindestens 6 Monate nach der letzten Dosis unterbrochen werden.
Verkehrstüchtigkeit
Enfortumab Vedotin hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Alternativen
Der Behandlungsstandard für fortgeschrittenes Urothelkarzinom umfasst eine platinbasierte Chemotherapie und Inhibitoren des programmierten Zelltodproteins 1 (PD-1) oder des programmierten Zelltodliganden 1 (PD-L1). In der platinrefraktären Situation gilt der Immun-Checkpoint-Inhibitor (ICI) Pembrolizumab, der auf PD-1 abzielt, als Behandlungsstandard.
- EMA: Fachinformation Padcev
- Powles, Thomas, et al. Enfortumab vedotin in previously treated advanced urothelial carcinoma. New England Journal of Medicine 384.12 (2021): 1125-1135.
- Alt M, Stecca C, Tobin S, Jiang DM, Sridhar SS. Enfortumab Vedotin in urothelial cancer. Ther Adv Urol. 2020;12:1756287220980192. Published 2020 Dec 27. doi:10.1177/1756287220980192
Abbildung
Adapted from „Antibody-Drug Conjugate Drug Release”, by BioRender.com