Enfuvirtid
Der antiretrovirale Wirkstoff Enfuvirtid ist ein Fusionshemmer aus der Gruppe der Entry-Inhibitoren, der in Kombination mit anderen HIV-Therapeutika zur Therapie einer Infektion mit HI-Viren Typ-1 (HIV-1) eingesetzt wird.
Enfuvirtid: Übersicht

Anwendung
Der Fusionshemmer Enfuvirtid ist in Kombination mit anderen HIV-Therapeutika indiziert bei HIV-1-infizierten Patienten, die eine Behandlung erhalten und ein Therapieversagen gezeigt haben mit Regimen, welche zumindest je einen Wirkstoff aus jeder der antiretroviralen Substanzklassen Proteasehemmer, nicht-nukleosidische Reverse-Transkriptase-Hemmer und nukleosidische Reverse-Transkriptase-Hemmer enthielten, oder die eine Unverträglichkeit gegenüber vorangegangenen antiretroviralen Behandlungsregimen haben.
Bei der Entscheidung über ein neues Behandlungsregime für Patienten, die gegenüber einem antiretroviralen Regime ein Therapieversagen zeigten, sollen die patientenindividuelle Behandlungsgeschichte und die Mutationsmuster in Verbindung mit den verschiedenen Arzneimitteln besonders beachtet werden. Sofern verfügbar, können Resistenzuntersuchungen angemessen sein.
Anwendungsart
Enfuvirtid ist als Pulver und Lösungsmittel zur Herstellung einer Injektionslösung (90 mg/mL) erhältlich.
Die Therapie sollte nur durch einen Arzt eingeleitet werden, der in der Behandlung von HIV-Infektionen erfahren ist. Dabei ist Enfuvirtid ausschließlich zur subkutanen Injektion vorgesehen.
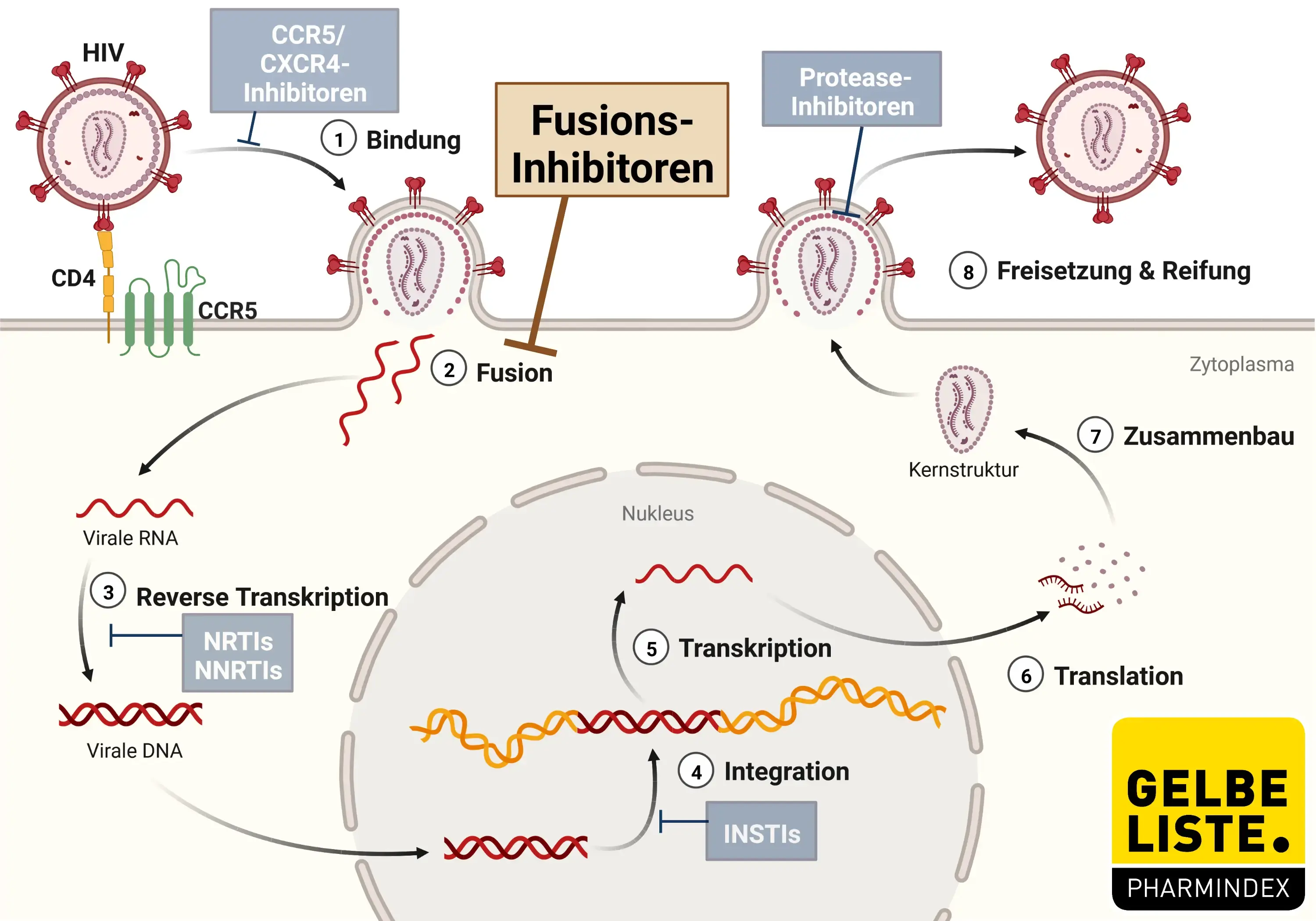
Wirkmechanismus
Enfuvirtid ist ein Fusionshemmer aus der Gruppe der Entry-Inhibitoren, die Bestandteil einer antiretroviralen Therapie (ART) sein können.
Humane Immundefizienz-Viren sind lymphotrope Lentiviren aus der Familie der Retroviren. Jedes individuelle Viruspartikel enthält zwei RNA-Stränge, die von einem Capsid-Protein (p24) und einer Lipidmembran mit Hüllproteinen (gp120, gp41) umschlossen sind.
Das Oberflächenprotein gp120 befähigt das HI-Virus, sich an das Oberflächenprotein CD4 der Zielzelle (überwiegend T-Helferzellen, aber auch Makrophagen) zu heften und unter Beteiligung von Korezeptoren (CCR5, CXCR4) auf der Zielzelle mit dieser zu fusionieren.
Enfuvirtid ist ein synthetisches Peptid, bestehend aus 36 Aminosäuren, dessen Sequenz sich von gp41 ableitet. Das Peptid inhibiert die räumliche Umstrukturierung von HIV-1-gp41 durch spezifische extrazelluläre Bindung an das Virusprotein, wodurch die Fusion zwischen der viralen Zellmembran und der Zellmembran der Zielzelle und folglich das Eindringen der viralen RNA in die Zielzelle unterbunden wird.
Pharmakokinetik
Resorption
- Die absolute Bioverfügbarkeit beträgt nach subkutaner Injektion von 90 mg Enfuvirtid in den Bauch 84,3 ± 15,5%.
- Der mittlere Wert (± SD) für cmax liegt bei 4,59 ± 1,5 μg/mL und für die AUC bei 55,8 ± 12,1 μg × h/mL.
- Die subkutane Resorption von Enfuvirtid ist innerhalb des Dosierungsbereiches von 45 bis 180 mg proportional zur applizierten Dosis.
- Für die 90-mg-Dosis ist die subkutane Resorption bei Injektion in Bauch, Oberschenkel oder Arm vergleichbar.
- Die mittlere minimale Steady-State-Plasmakonzentration („trough“-Konzentration) liegt zwischen 2,6 und 3,4 μg/mL.
Verteilung
- Das Verteilungsvolumen im Steady-State bei intravenöser Gabe einer 90-mg-Dosis von Enfuvirtid beträgt 5,5 ± 1,1 L.
- In HIV-infiziertem Plasma ist Enfuvirtid innerhalb eines Bereiches der Plasmakonzentration von 2 bis 10 μg/mL zu 92% an Plasmaproteine gebunden (überwiegend an Albumin und in geringerem Umfang an α-1-saures Glykoprotein).
- Bei HIV-Patienten ist über vernachlässigbare Enfuvirtid-Spiegel im Liquor cerebrospinalis berichtet worden.
Metabolismus
- Es wird angenommen, dass Enfuvirtid als Peptid in einem katabolen Prozess in seine einzelnen Aminosäuren verstoffwechselt wird, wobei nachfolgend eine Wiederverwertung der Aminosäuren in der Gesamtkörperbilanz erfolgt.
- In in-vitro-Studien mit menschlichen Mikrosomen und Hepatozyten führt die Hydrolyse der Amidgruppe der C-terminalen Aminosäure Phenylalanin zu einem deamidierten Metaboliten, wobei die Bildung
dieses Metaboliten nicht NADPH-abhängig ist.
Elimination
- Die Clearance von Enfuvirtid beträgt nach intravenöser Gabe von 90 mg 1,4 ± 0,28 L/h und die Eliminationshalbwertszeit 3,2 ± 0,42 Stunden.
- Nach einer subkutanen 90-mg-Dosis Enfuvirtid beträgt die Halbwertszeit von Enfuvirtid 3,8 ± 0,6 Stunden.
Dosierung
Erwachsene und Jugendliche ab 16 Jahren
- Empfohlene Tagesdosis: 2x täglich 90 mg als subkutane Injektion in den Oberarm, in den vorderen Oberschenkel oder in den Bauch
- Im Falle einer verpassten Dosis sollte der Patient angewiesen werden, diese so schnell wie möglich nachzuholen (wenn jedoch die Zeit bis zur nächsten regulären Dosis weniger als 6 Stunden beträgt, sollte die vergessene Dosis ausgelassen werden).
Kinder ab 6 Jahren und Jugendliche
- Die Dosierung sollte basierend auf dem Körpergewicht vorgenommen werden (detailliertes Dosierungsschema siehe Fachinformation).
- Enfuvirtid darf bei Kindern im Alter von unter 6 Jahren nicht angewendet werden, da Bedenken hinsichtlich der Sicherheit und Wirksamkeit bestehen.
Nebenwirkungen
Die häufigsten Nebenwirkungen, die im Zusammenhang mit Enfuvirtid auftreten können, sind:
- Reaktionen an der Injektionsstelle
- Diarrhö
- Übelkeit
- Infektionen (Sinusitis, Hautpapillom, Influenza, Pneumonie, Infektion des Ohres)
- Lymphadenopathie
- Anorexie, verminderter Appetit und Gewichtsverlust
- Hypertriglyzeridämie
- Diabetes mellitus
- Angstzustände und Albträume
- Reizbarkeit
- Periphere Neuropathie
- Hypästhesie
- Beeinträchtigung der Aufmerksamkeit
- Tremor
- Konjunktivitis
- Vertigo
- Nasale Kongestion
- Pankreatitis
- Gastroösophageale Refluxkrankheit
- Hauterkrankungen (trockene Haut, seborrhoisches Ekzem, Erythem, Akne)
- Muskelschmerzen
- Nierensteine
- Hämaturie
- Grippe-ähnliche Symptome
- Asthenie
Zu den schwerwiegenderen Nebenwirkungen zählen:
- Immunrekonstitutionssyndrom (entzündliche Reaktion auf asymptomatische oder residuale opportunistische Infektionen zum Zeitpunkt der Therapieeinleitung bei schwerem Immundefekt)
- Pneumonie
- Osteonekrose (bei Patienten mit Risikofaktoren, fortgeschrittener HIV-Erkrankung oder Langzeitanwendung einer antiretroviralen Therapie)
Wechselwirkungen
Eine antiretrovirale Therapie sollte immer aus einer Kombination mehrerer Wirkstoffe bestehen, wodurch sich allerdings auch das Wechselwirkungsrisiko erhöht.
In diesem Zusammenhang werden allerdings keine klinisch signifikanten pharmakokinetischen Wechselwirkungen zwischen Enfuvirtid und gleichzeitig gegebenen Arzneimitteln, die durch Cytochrom-P-450-Enzyme metabolisiert werden, erwartet.
Kontraindikationen
Enfuvirtid ist kontraindiziert bei Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels.
Schwangerschaft
Es liegen keine hinreichenden und gut kontrollierten Studien bei schwangeren Frauen vor. Tierexperimentelle Studien zeigen keine schädlichen Wirkungen in Bezug auf die fetale Entwicklung. Während einer Schwangerschaft soll Enfuvirtid nur dann eingesetzt werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fetus rechtfertigt.
Stillzeit
Es ist nicht bekannt, ob Enfuvirtid in die Muttermilch übergeht.
Generell wird empfohlen, dass HIV-infizierte Mütter ihre Kinder unter keinen Umständen stillen, um eine Übertragung von HIV zu vermeiden.
Verkehrstüchtigkeit
Es gibt keine Hinweise darauf, dass Enfuvirtid die Verkehrstüchtigkeit oder Fähigkeit zum Bedienen von Maschinen beeinträchtigen könnte. Dennoch sollte das Nebenwirkungsprofil von Enfuvirtid berücksichtigt werden.
Anwendungshinweise
HIV-Übertragung
- Obwohl es sich gezeigt hat, dass die erfolgreiche Virussuppression durch eine antiretrovirale Therapie das Risiko einer sexuellen Übertragung erheblich reduziert, kann ein Restrisiko nicht ausgeschlossen werden.
- Demnach sollten Vorsichtsmaßnahmen zur Vermeidung der Übertragung gemäß nationaler Leitlinien getroffen werden.
- Die Anwendung von Enfuvirtid bei Patienten, die nicht mit HIV-1 infiziert sind, kann die Bildung von Anti-Enfuvirtid-Antikörpern auslösen, die gegenüber HIV-gp41 kreuzreagieren (dies kann zu falsch positiven HIV-Testergebnissen beim anti-HIV-ELISA-Test führen).
Lebererkrankung
- Die Sicherheit und Wirksamkeit von Enfuvirtid wurde bei Patienten mit signifikanten Leberfunktionsstörungen nicht speziell untersucht.
- Patienten mit chronischer Hepatitis B und C, die mit einer antiretroviralen Therapie behandelt werden, unterliegen einem erhöhten Risiko für schwere und potenziell tödliche unerwünschte hepatische Ereignisse.
- Einige Patienten der Phase-III-Studien waren gleichzeitig mit Hepatitis B/C infiziert, wobei bei diesen Patienten die zusätzliche Gabe von Enfuvirtid nicht zu einem Anstieg der Inzidenz der hepatischen Ereignisse führte.
Immunrekonstitutionssyndrom
- Bei HIV-infizierten Patienten mit schwerem Immundefekt kann sich zum Zeitpunkt der Einleitung einer antiretroviralen Kombinationstherapie (CART) eine entzündliche Reaktion auf asymptomatische oder residuale opportunistische Pathogene entwickeln, die zu schweren klinischen Zuständen oder Verschlechterung von Symptomen führt (typischerweise werden solche Reaktionen innerhalb der ersten Wochen oder Monate nach Beginn der CART beobachtet).
- Entsprechende Beispiele sind CMV-Retinitis, disseminierte und/oder lokalisierte mykobakterielle Infektionen und Pneumonien durch Pneumocystis jiroveci (früher bekannt als Pneumocystis carinii).
- Jedes Entzündungssymptom ist zu bewerten und, falls notwendig, eine geeignete Behandlung einzuleiten.
- Es liegen auch Berichte über Autoimmunerkrankungen (wie z.B. Morbus Basedow und Autoimmunhepatitis) vor, die im Rahmen einer Immun-Reaktivierung auftraten (allerdings ist der Zeitpunkt des Auftretens sehr variabel und diese Ereignisse können viele Monate nach Beginn der Behandlung auftreten).
Osteonekrose
- Obwohl von einer multifaktoriellen Ätiologie (einschließlich Anwendung von Kortikoiden, Alkoholkonsum, ausgeprägte Immunsuppression und erhöhtem Body-Mass-Index) ausgegangen wird, wurden insbesonders bei Patienten mit fortgeschrittener HIV-Infektion und/oder langdauernder antiretroviraler Kombinationstherapie (CART) Fälle von Osteonekrose berichtet.
- Die Patienten müssen darauf hingewiesen werden, dass sie beim Auftreten von Gelenkbeschwerden und -schmerzen, bei Gelenksteifigkeit oder Bewegungseinschränkungen ihren Arzt aufsuchen sollen.
Auswirkungen auf das Immunsystem
- Tierstudien haben gezeigt, dass Enfuvirtid einige der Immunfunktionen beeinträchtigen kann.
- Bei Patienten, die in klinischen Studien mit Enfuvirtid behandelt wurden, zeigte sich eine erhöhte Rate bakterieller Infektionen (vor allem eine höhere Rate an Pneumonien).
- Epidemiologische Daten konnten allerdings nicht zeigen, dass ein erhöhtes Risiko einer bakteriellen Pneumonie im Zusammenhang mit der Anwendung von Enfuvirtid besteht.
Überempfindlichkeitsreaktionen
- Unter der Therapie mit Enfuvirtid können Überempfindlichkeitsreaktionen (z.B. Hautausschlag, Fieber, Übelkeit und Erbrechen, Schüttelfrost, Rigor, niedriger Blutdruck und verschiedene Kombinationen erhöhter Lebertransaminasenwerte im Serum, sowie möglicherweise primäre Immunkomplexreaktionen, Atembeschwerden und Glomerulonephritis) auftreten.
- In seltenen Fällen kommt es zu einem Wiederauftreten der Überempfindlichkeitsreaktionen bei erneuter Exposition.
- Patienten, die Anzeichen bzw. Symptome einer systemischen Überempfindlichkeitsreaktion zeigen, sollen die Behandlung mit Enfuvirtid absetzen und sich sofort einer ärztlichen Untersuchung unterziehen.
- Die Behandlung mit Enfuvirtid soll nach systemischen Anzeichen und Symptomen, die einer Überempfindlichkeitsreaktion entsprechen und im Zusammenhang mit Enfuvirtid stehen, nicht wiederaufgenommen werden.
- Es sind keine Risikofaktoren bekannt, die eine Vorhersage des Auftretens bzw. der Schwere einer Überempfindlichkeit gegenüber Enfuvirtid ermöglichen.
Alternativen
Zur antiretroviralen Therapie (einer HIV-1-Infektion) können alternativ bzw. ergänzend folgende Wirkstoffe eingesetzt werden:
Andere Entry-Inhibitoren
- CCR5-Antagonisten: Maraviroc
Reverse-Transkriptase-Inhibitoren (RTI)
Nukleosidische Reverse-Transkriptase-Inhibitoren (NRTI):
Nukleotidische Reverse-Transkriptase-Inhibitoren (NtRTI):
Nicht-nukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI):
Integrase-Inhibitoren (INI, INSTI)
HIV-Protease-Inhibitoren (PI)
- Atazanavir
- Darunavir
- Fosamprenavir
- Indinavir
- Lopinavir
- Saquinavir
- Tipranavir
- Ritonavir (meist als „Booster“, Kennzeichnung /r)
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
- EMA: Fuzeon
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- AWMF: Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion
- RKI: HIV-Infektion/AIDS
Abbildung
Adapted from „HIV Sites for Therapeutic Intervention”, by BioRender.com











