Erenumab
Erenumab ist ein humaner monoklonaler Antikörper der zur Migräne-Prophylaxe angewendet wird. Der Migräne-Antikörper richtet sich gegen den Rezeptor des Calcitonin Gene-Related-Peptide (CGRP) und wird mit Hilfe einer Fertigspritze oder eines Fertigpens appliziert. Erenumab folgt einem komplett neuen Ansatz in der Migräne-Prophylaxe und ist der erste Vertreter einer neuen Wirkstoffklasse.
Erenumab : Übersicht
Anwendung
Der monoklonale Antikörper Eremumab wird zur Prophylaxe der episodischen und chronischen Migräne bei Erwachsenen mit mindestens vier Migränetagen pro Monat angewendet. Das Medikament kann von Patienten nach einer Schulung selbst appliziert werden.
Wirkmechanismus
Erenumab ist ein humaner monoklonaler IgG2- Antikörper, der sich gegen den Rezeptor des Calcitonin Gene- Related Peptide (CGRP) richtet. Durch die Bindung wird die Interaktion mit dem natürlichen Liganden CGRP gehemmt. CGRP ist ein Neuropeptid, das die nozizeptive Signalübertragung reguliert und stark gefäßerweiternd wirkt, weshalb es mit der Pathophysiologie der Migräne in Zusammenhang gebracht wird. Der CGRP-Spiegel steigt bei einer Migräneattacke signifikant an und sinkt beim Abklingen der Symptome.
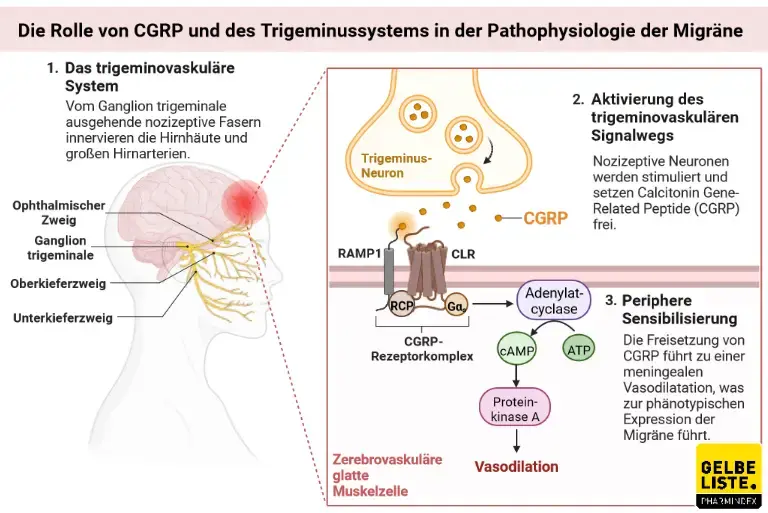
Pharmakokinetik
Erenumab folgt aufgrund der Bindung an den CGRP-Rezeptor einer nichtlinearen Kinetik. Bei therapeutisch relevanten Dosen ist die Pharmakokinetik von Erenumab nach subkutaner Gabe alle 4 Wochen allerdings überwiegend linear, da es bei der Bindung an den CGRP-Rezeptor zu einer Sättigung kommt.
Nach subkutaner Gabe von 70 mg oder 140 mg Erenumab wurden nach 4 bis 6 Tagen Maximalkonzentrationen im Serum erreicht. Die geschätzte absolute Bioverfügbarkeit beträgt 82 %.
Erenumab besitzt zwei Eliminationsphasen:
- Bei niedrigen Konzentrationen erfolgt die Elimination vorwiegend durch eine sättigbare Bindung am CGRP-Rezeptor,
- bei höheren Konzentrationen erfolgt die Elimination überwiegend über einen unspezifischen proteolytischen Abbau.
Während des Dosierungszeitraums wird Erenumab vorwiegend über den unspezifischen proteolytischen Weg eliminiert und hat eine Eliminationshalbwertszeit von
28 Tagen.
Dosierung
Die empfohlene Dosis beträgt 70 mg alle 4 Wochen als Einzelinjektion.
Einige Patienten können von einer Dosis von 140 mg alle 4 Wochen profitieren, die als zwei Injektionen zu je 70 mg gegeben wird.
Nebenwirkungen
Unter der Therapie mit 70 mg bzw. 140 mg wurden als Nebenwirkungen gegenüber Placebo angegeben:
- Reaktionen an der Injektionsstelle (5,6 % bzw. 4,5 %),
- Obstipation (1,3 % bzw. 3,2 %),
- Muskelspasmen (0,7 % bzw. 2,0 %) und
- Pruritus (1,0 % bzw. 1,8 %).
Die meisten dieser Nebenwirkungen waren von leichtem oder mittlerem Schweregrad.
Wechselwirkungen
Aufgrund der Metabolisierungswege monoklonaler Antikörper werden keine Wechselwirkungen mit gleichzeitig verabreichten Arzneimitteln erwartet. In Studien mit gesunden Probanden wurde keine Interaktion mit oralen Kontrazeptiva (Ethinylestradiol/Norgestimat) oder Sumatriptan beobachtet.
Schwangerschaft
Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität. Aus Vorsichtsgründen soll jedoch eine Anwendung während der Schwangerschaft vermieden werden.
Stillzeit
Es ist nicht bekannt, ob Erenumab in die menschliche Muttermilch übergeht. Humane IgGs gehen jedoch in den ersten Tagen nach der Geburt in die Muttermilch über, ihre Konzentration sinkt bald danach auf niedrige Werte ab. Dementsprechend könnte ein Risiko für den Säugling während dieser kurzen Phase bestehen. Falls es klinisch notwendig ist, könnte danach die Anwendung während der Stillzeit in Erwägung gezogen werden.
Verkehrstüchtigkeit
Es ist davon auszugehen, dass Erenumab keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen hat.
Alternativen
Neben Erenumab gibt es folgende drei Antikörper, die nicht gegen den CGRP-Rezeptor sondern gegen CGRP selbst gerichtet sind:
- EMA: Fachinformation Aimovig
- Markham, Anthony. "Erenumab: first global approval." Drugs 78.11 (2018): 1157-1161.
- Lattanzi, Simona, et al. "Erenumab for preventive treatment of migraine: a systematic review and meta-analysis of efficacy and safety." Drugs 79.4 (2019): 417-431.
Abbildung
Adapted from „The Role of CGRP and the Trigeminal System in Migraine Pathophysiology”, by BioRender.com














