Favipiravir
Favipiravir gehört zur Wirkstoffgruppe der Virostatika und ist ein RNA-Polymerase-Inhibitor. Das Medikament wird unter dem Handelsnamen Avigan vertrieben. Der Wirkstoff ist in Japan zur Behandlung neuartiger Influenzaviren und wiederkehrenden Influenza-Ausbrüchen zugelassen.
Favipiravir: Übersicht
Anwendung
Favipiravir ist seit 2014 unter dem Handelsnamen Avigan in Japan als ein Arzneimittel für den Notfalleinsatz zur Behandlung neuartiger Influenzaviren und wiederkehrenden Influenza-Ausbrüchen zugelassen. Das Medikament war allerdings nie auf dem Markt verfügbar und wird nur auf Anforderung durch die japanische Regierung hergestellt und als Pandemiemaßnahme an die Regierung verkauft.
Favipiravir wird aktuell auf seine Wirksamkeit bei der Behandlung der neuartigen Coronavirusinfektion (COVID-19) untersucht.
Anwendungsart
Favipiravir ist als Avigan in Form von Filmtabletten mit 200 mg Wirkstoff in Japan zugelassen. Das Arzneimittel wird oral angewendet.
Mit der Verabreichung sollte unverzüglich nach dem Auftreten von Influenza-ähnlichen Symptomen begonnen werden.
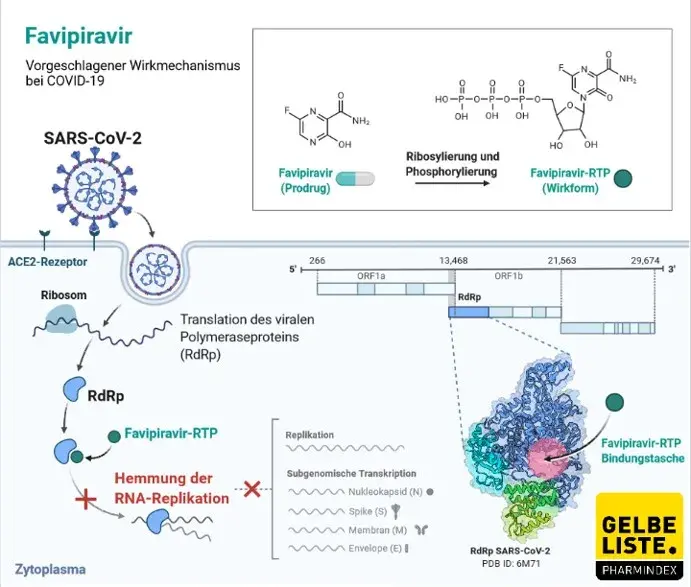
Wirkmechanismus
Antivirale Aktivität in-vitro:
Favipiravir zeigte eine antivirale Aktivität gegen Influenzavirus-Laborstämme vom Typ A und Typ B mit einer EC50 von 0,014–0,55 μg / ml. Die EC50 gegen saisonale Influenzaviren vom Typ A und Typ B, einschließlich Stämme, die gegen Adamantan (Amantadin und Rimantadin), Oseltamivir oder Zanamivir resistent sind, betrug 0,03–0,94 bzw. 0,09–0,83 μg/ml. Die EC50 gegen Influenzaviren vom Typ A (einschließlich Stämme, die gegen Adamantan, Oseltamivir oder Zanamivir resistent sind) einschließlich hoch pathogener Stämme (H5N1 und H7N9) betrug 0,06–3,53 μg / ml. Die EC50 gegen Influenzaviren vom Typ A und Typ B, die gegen Adamantan, Oseltamivir und Zanamivir resistent waren, betrug 0,09–0,47 μg / ml, und es wurde keine Kreuzresistenz beobachtet.
Wirkmechanismus
Es wird angenommen, dass Favipiravir in Zellen zu einer Ribosyltriphosphatform (Favipiravir-Ribofuranosyl-5-Triphosphat; Favipiravir RTP) metabolisiert wird und dass Favipiravir RTP die an der Influenza-Virusreplikation beteiligte RNA-Polymerase selektiv hemmt. In Bezug auf die Aktivität gegen humane DNA-Polymerasen α, β und γ zeigte Favipiravir RTP (1000 µmol / l) keine hemmende Wirkung auf α, 9,1-13,5%, inhibierenden Effekt auf β und 11,7-41,2% hemmende Wirkung auf γ. Die Hemmkonzentration (IC50) von Favipiravir RTP auf der humanen RNA-Polymerase II betrug 905 µmol / l.
Die folgende Tabelle zeigt die pharmakokinetischen Parameter von Favipiravir nach oraler Verabreichung an 8 gesunden Erwachsenen, die 1600 mg zweimal täglich (BID) für 1 Tag, dann 600 mg BID für 4 Tage, gefolgt von 600 mg einmal täglich für 1 Tag (1600 mg / 600 mg BID) einnahmen.
| Dosierung |
Cmax
[µg/ml]
|
AUC
[µg*h/ml]
|
tmax
[h]
|
t1/2
[h]
|
|
|
1600 mg/600 mg BID
|
Tag 1 |
64,56
(17,2)
Geometrisches Mittel (CV%)
|
446,09
(28,1)
|
1,5
(0,75; 4)
Median
(minimum, maximum)
|
4,8 ±1,1
(Mean±SD)
|
|
1600 mg/600 mg BID
|
Tag 6
|
64,69
(24,1)
Geometrisches Mittel (CV%)
|
553,98
(31,2)
|
1,5
(0,75; 2)
Median
(minimum, maximum)
|
5,6±2,3
(Mean±SD)
|
Nach mehrfacher oraler Verabreichung von Favipiravir über 7 Tage an einem gesunden Erwachsenen, der wenig AO-Aktivität aufwies, betrug die geschätzte AUC des unveränderten Arzneimittels an Tag 1 1452,73 μg /h/ml und an Tag 7 1324,09 μg /h/ml.
Metabolismus
Favipiravir wurde nicht durch Cytochrom P-450 (CYP) metabolisiert. Der Wirkstoff wurde hauptsächlich durch Aldehydoxidase (AO) und teilweise durch Xanthinoxidase (XO) zu einer hydroxylierten Form metabolisiert. In Studien mit menschlichen Lebermikrosomen lag die Bildung des Hydroxylats im Bereich von 3,98 bis 47,6 pmol//mg Protein)/min, wobei die interindividuelle Variation der AO-Aktivität maximal das 12-fache betrug. Neben der hydroxylierte Form wurde in menschlichem Plasma und Urin auch ein Glucuronatkonjugat gefunden.
Ausscheidung
Favipiravir wurde hauptsächlich als hydroxylierte Form in den Urin ausgeschieden; nur eine geringe Menge an unverändertem Arzneimittel wurde beobachtet. In einer 7-Tage-Mehrfachdosisstudie (orale Anwendung) mit 6 gesunden Erwachsenen betrug das kumulative Urinausscheidungsverhältnis des unveränderten Arzneimittels und der hydroxylierten Form 48 Stunden nach der letzten Verabreichung 0,8% bzw. 53,1%.
Dosierung
Influenzavirusinfektion:
Die übliche Dosierung von Favipiravir für Erwachsene beträgt 1600 mg oral zweimal täglich für 1 Tag, gefolgt von 600 mg oral zweimal täglich für 4 Tage. Die gesamte Verabreichungsdauer sollte 5 Tage betragen.
Sicherheitshinweis
Es wurde keine klinische Studie durchgeführt, um die Wirksamkeit und Sicherheit von Favipiravir mit der zugelassenen Dosierung zu untersuchen. Die genehmigte Dosierung wurde basierend auf den Ergebnissen einer placebokontrollierten klinischen Phase I / II-Studie bei Patienten mit Influenzavirusinfektion und den pharmakokinetischen Studien-Daten geschätzt. In einer außerhalb Japans durchgeführten pharmakokinetischen Studie wurde bei Patienten mit Leberfunktionsstörungen über einen Anstieg des Favipiravir-Plasmaspiegels berichtet.
Nebenwirkungen
Unter der Anwendung von Favipiravir wurden folgende Nebenwirkungen beobachtet:Unter der Anwendung von Favipiravir wurden folgende Nebenwirkungen beobachtet:
- Schock, Anaphylaxie
- Lungenentzündung
- Fulminante Hepatitis, Leberfunktionsstörung, Gelbsucht
- Toxische epidermale Nekrolyse, Stevens-Johnson-Syndrom
- Akutes Nierenversagen
- Abnahme der Anzahl weißer Blutkörperchen, der Neutrophilenzahl und Thrombozyten
- Neurologische und psychiatrische Symptome (Bewusstseinsstörungen, abnormales Verhalten, Delirie, Halluzination, Wahn)
- hämorrhagische Kolitis
Wechselwirkungen
Favipiravir wird nicht durch Cytochrom P-450 (CYP) metabolisiert, sondern hauptsächlich durch Aldehydoxidase (AO) und teilweise durch Xanthinoxidase (XO). Das Medikament hemmt AO und CYP2C8, induziert jedoch kein CYP.
In vitro: Dosis- und zeitabhängig hemmte Favipiravir irreversibel AO und CYP2C8. Es gab keine Hemmaktivität für XO und eine schwache Hemmaktivität für CYP1A2, 2C9, 2C19, 2D6, 2E1 und 3A4. Der hydroxylierte Metabolit zeigte eine schwache Hemmaktivität gegenüber CYP1A2, 2C8, 2C9, 2C19, 2D6, 2E1 und 3A4. Eine induktive Wirkung von Favipiravir auf CYP wurde nicht beobachtet.
Kontraindikation
avipiravir darf nicht angewendet werden bei:avipiravir darf nicht angewendet werden bei:
- Schwangerschaft oder Verdacht auf eine Schwangerschaft (früher embryonaler Tod und Teratogenität wurden im Tierversuch festgestellt)
- Bekannter Überempfindlichkeit gegenüber dem Wirkstoff oder den sonstigen Bestandteilen des Arzneimittels
Favipiravir sollte bei folgenden Patienten mit Vorsicht angewendet werden:
- Patienten mit Gicht oder Gicht in der Anamnese
- Patienten mit Hyperurikämie (Blutharnsäurespiegel kann ansteigen und Symptome können sich verschlimmern)
Schwangerschaft/Stillzeit
Favipiravir darf nicht in der Schwangerschaft oder bei Verdacht auf eine Schwangerschaft angewendet werden, da im Tierversuch eine Teratogenität festgestellt wurde und der Wirkstoff zu frühem embryonalem Tod geführt hatte.











