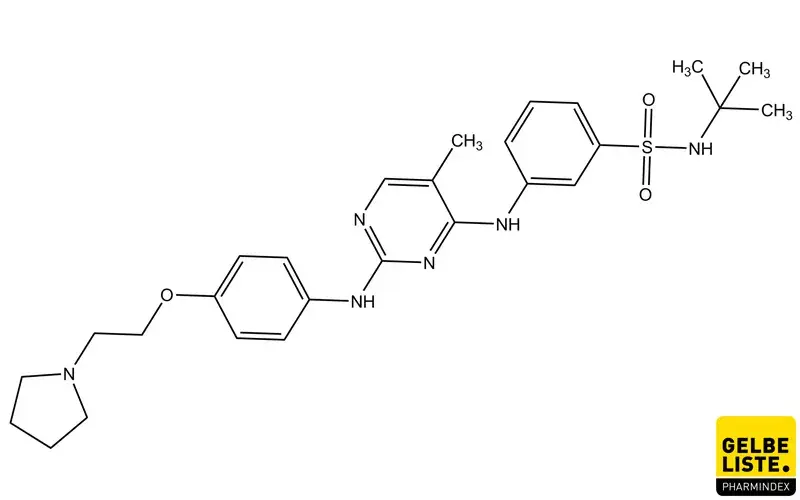
Fedratinib
Fedratinib ist ein hochselektiver Inhibitor der Januskinase (JAK) 2 und FMS-like Tyrosine Kinase 3 (FLT3). Der Wirkstoff ist indiziert für die Behandlung der krankheitsbedingten Splenomegalie (Milzvergrößerung) sowie von Symptomen der primären und sekundären Myelofibrose.
Fedratinib: Übersicht
Anwendung
Fedratinib (Inrebic) ist das erste, einmal täglich oral einzunehmende Medikament, das ein klinisch bedeutsames Ansprechen bezüglich der Reduktion des Milzvolumens sowie eine Verbesserung der krankheitsbedingten Symptomlast bei Patienten mit Myelofibrose, die auf eine Behandlung mit Ruxolitinib nicht angesprochen oder die noch keinen JAK-Inhibitor erhalten haben, gezeigt hat.
Das Medikament ist zugelassen für die Behandlung krankheitsbedingter Splenomegalie (Vergrößerung der Milz) oder Symptome bei erwachsenen Patienten die nicht mit einem Janus-assoziierten Kinase (JAK)-Inhibitor vorbehandelt sind oder die mit Ruxolitinib behandelt wurden, mit:
- Primärer Myelofibrose
- Post-Polycythaemia Vera-Myelofibrose
- Post-Essentielle Thrombozythämie-Myelofibrose
Über Myelofibrose
Die Myelofibrose ist eine seltene, aber schwere Erkrankung der pluripotenten hämatopoetischen Stamm- und Progenitorzellen des Knochenmarks, bei der es durch eine Dysregulation des JAK2-Signalwegs zu einer abnormen Proliferation der Hämatopoese und einer pathologisch gesteigerten Freisetzung verschiedener Zytokine und Wachstumsfaktoren. In der Folge wird das Knochenmark nach und nach durch fibröses Narbengewebe ersetzt, wodurch die Fähigkeit zur Bildung von Blutzellen eingeschränkt wird. Die Störung kann unter anderem zu Anämie, Schwäche, Fatigue und Vergrößerung von Milz und Leber führen. In der EU wird die Diagnose Myelofibrose jedes Jahr bei etwa 1 pro 100.000 Einwohnern gestellt.
Anwendungsart
Fedratinib wird oral eingenommen. Die Kapseln dürfen nicht geöffnet, zerbrochen oder zerkaut werden. Patienten, die vor Beginn der Fedratinib-Behandlung mit Ruxolitinib behandelt werden, müssen Ruxolitinib gemäß der Fachinformation von Ruxolitinib ausschleichend absetzen. Vor Beginn und in regelmäßigen Abständen während der Behandlung mit Fedratinib sollten folgende Werte erhoben werden:
- Thiamin (Vitamin B1)
- ein großes Blutbild
- Leberpanel
- Amylase/Lipase
- Blut-Harnstoff-Stickstoff
- Kreatinin
Bei einem Thiaminmangel sollte die Behandlung erst begonnen werden, wenn die Thiaminspiegel aufgefüllt worden sind.
Liegen der Ausgangswert der Thrombozytenzahl unter 50 x 109/l und die absolute Neutrophilenzahl (ANC) unter 1,0 x 109/l wird nicht empfohlen mit der Inrebic-Behandlung zu beginnen.
In den ersten acht Wochen der Behandlung wird empfohlen prophylaktisch Antiemetika gemäß lokaler Behandlungsstandards anzuwenden und danach wie klinisch angezeigt fortzusetzen. Wird Fedratinib mit einer fettreichen Mahlzeit verabreicht, kann die Häufigkeit von Übelkeit und Erbrechen verringert werden.
Wirkmechanismus
Fedratinib ist ein Kinase Inhibitor mit Aktivität gegen Wildtyp und Mutations-aktivierter Janus-Assoziierter Kinase 2 (JAK2) und FMS-like Tyrosine Kinase 3 (FLT3). Der Wirkstoff ist ein JAK2-selektiver Inhibitor, der eine höhere Wirkstärke für JAK2 als gegenüber den anderen Mitgliedern der JAK-Familie (JAK1, JAK3 und TYK2) aufweist. Eine abnorme Aktivierung von JAK2 ist mit myeloproliferativen Neoplasien, darunter auch Myelofibrose und Polycythaemia-vera, assoziiert.
In Zellmodellen mit Exprimierung der mutationsaktivierten JAK2 oder FLT3 verringerte Fedratinib die Phosphorylierung von STAT3/5-Proteinen (Signaltransduktoren und -aktivatoren der Transkription; STAT), hemmte die Zellproliferation und induzierte die Apoptose.
In Mausmodellen zu JAK2V617F-gesteuerter myeloproliferativer Erkrankung blockierte Fedratinib die Phosphorylierung von STAT3/5, verlängerte das Überleben und verbesserte die krankheitsbedingte Symptomatik, darunter die Reduktion weißer Blutkörperchen, Hämatokrit, Splenomegalie und Fibrose.
Nebenwirkungen
Sehr häufige Nebenwirkungen von Fedratinib (die mehr als 1 von 10 Behandelten betreffen können) sind:
- Diarrhö,
- Nausea
- Erbrechen
- Anämie
- Thrombozytopenie
Sehr häufige ernste Nebenwirkungen von Inrebic (die bis zu 1 von 10 Behandelten betreffen können) sind Anämie und Diarrhö.
Wechselwirkungen
Fedratinib wird in vitro von mehreren CYP-Enzymen metabolisiert, überwiegend durch CYP3A4 und zu einem geringeren Anteil durch CYP2C19, sowie durch flavinhaltige Monooxygenasen (FMO), weshalb folgende Wechselwirkungen zu beachten sind:
- Die gleichzeitige Verabreichung von Inrebic mit starken CYP3A4-Inhibitoren erhöht die Inrebic-Exposition. Wenn starke CYP3A4-Inhibitoren nicht ersetzt werden können, sollte die Dosis von Inrebic bei Verabreichung mit starken CYP3A4-Inhibitoren (z. B. Ketoconazol, Ritonavir) reduziert werden.
- Wirkstoffe, die gleichzeitig CYP3A4 und CYP2C19 hemmen (z. B. Fluconazol, Fluvoxamin), oder die Kombination von CYP3A4- und CYP2C19-Inhibitoren können die Fedratinib-Exposition erhöhen und sollten bei Patienten, die Inrebic erhalten, vermieden werden.
- Wirkstoffe, die stark oder moderat CYP3A4 induzieren (z. B. Phenytoin, Rifampicin, Efavirenz), können die Inrebic-Exposition verringern und sollten deshalb vermieden werden.
- Wenn Inrebic zusammen mit einem Substrat von CYP3A4 (z. B. Midazolam, Simvastatin), CYP2C19 (z. B. Omeprazol, S-Mephenytoin) oder CYP2D6 (z. B. Metoprolol, Dextromethorphan) verabreicht werden soll, sollten Dosisanpassungen der gemeinsam verabreichten Arzneimittel nach Bedarf unter enger Überwachung der Sicherheit und Wirksamkeit vorgenommen werden.
- Die gleichzeitige Anwendung von hämatopoetischen Wachstumsfaktoren und Inrebic wurde nicht untersucht. Die Sicherheit und Wirksamkeit einer gemeinsamen Anwendung ist nicht bekannt.
Kontraindikationen
Fedratinib darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen sonstigen Bestandteile des Arzneimittels sowie in der Schwangerschaft.
Schwangerschaft
Fedratinib ist während der Schwangerschaft kontraindiziert. Bisher liegen keine Daten bezüglich der Anwendung bei Schwangeren vor. Tierexperimentelle Studien haben allerdings eine Reproduktionstoxizität gezeigt; die Exposition in diesen Studien war geringer als die humane Exposition mit der empfohlenen Dosis. Basierend auf dem Wirkmechanismus von Fedratinib kann der Wirkstoff den Fötus schädigen. Für JAK-Inhibitoren ist bekannt, dass diese bei trächtigen Ratten und Kaninchen bei klinisch relevanter Exposition nachweislich zu embryo-fetaler Mortalität und Teratogenität geführt haben.
Frauen im gebärfähigen Alter müssen während der Behandlung und für mindestens einen Monat nach der letzten Dosis eine zuverlässige Verhütungsmethode anwenden.
Stillzeit
Es ist nicht bekannt, ob Fedratinib oder seine Metaboliten in die Muttermilch übergehen. Ein Risiko für das gestillte Kind kann nicht ausgeschlossen werden, weshalb Frauen während der Behandlung und für mindestens ein Monat nach der letzten Fedratinib-Dosis nicht stillen sollten.
Verkehrstüchtigkeit
Fedratinib hat geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Patienten, bei denen ein Schwindelgefühl nach der Einnahme von Inrebic auftritt, sollten nicht am Straßenverkehr teilnehmen oder Maschinen bedienen.
Anwendungshinweise
Enzephalopathie, einschließlich Wernicke-Enzephalopathie
Unter der Anwendung von Fedratinib wurden Fälle von schwerwiegender und tödlich verlaufender Enzephalopathie, einschließlich der Wernicke-Enzephalopathie, berichtet. Bei der Wernicke-Enzephalopathie handelt es sich um einen neurologischen Notfall, der auf einen Mangel an Thiamin (Vitamin B1) zurückzuführen ist. Zu den Anzeichen und Symptomen der Wernicke-Enzephalopathie gehören u.a.:
- Ataxie
- psychische Veränderungen
- Ophthalmoplegie (z. B. Nystagmus, Diplopie)
Jede psychische Veränderung, Verwirrung oder Gedächtnisstörung sollte eine vollständige Beurteilung einschließlich einer neurologischen Untersuchung, einer Beurteilung des Thiaminspiegels und einer Bildgebung nach sich ziehen. Die Thiaminspiegel und der Ernährungszustand der Patienten sollten vor Beginn der Behandlung mit Fedratinib, in regelmäßigen Abständen während der Behandlung und wie klinisch angezeigt beurteilt werden. Besteht ein Thiaminmangel sollte eine Behandlung mit Fedratinib nicht begonnen werden.
Anämie, Thrombozytopenie und Neutropenie
Unter der Anwendung von Fedratinib kann es zu Anämie, Thrombozytopenie und Neutropenie kommen, weshalb vor Behandlungsbeginn, in regelmäßigen Abständen während der Behandlung und wie klinisch angezeigt, große Blutbilder erstellt werden sollten. Eine Anämie, Thrombozytopenie tritt im Allgemeinen innerhalb der ersten drei Monate der Behandlung auf. Patienten, die zu Beginn der Therapie einen Hämoglobinspiegel unter 10,0 g/dl, oder eine niedrige Thrombozytenzahl (< 100 x 109/l) haben, entwickeln während der Behandlung mit höherer Wahrscheinlichkeit eine Anämie bzw. Thrombozytopenie von Grad 3 oder höher und sollten sorgfältig überwacht werden.
Gastrointestinale Ereignisse
Übelkeit, Erbrechen und Diarrhoe gehören zu den häufigsten Nebenwirkungen von Fedratinib. Die meisten Nebenwirkungen sind Grad 1 oder 2 und treten normalerweise innerhalb der ersten 2 Wochen der Behandlung auf. Eine prophylaktische antiemetische Therapie (z. B. 5-HT3-Rezeptorantagonisten) kann deshalb während der Behandlung in Betracht gezogen werden. Diarrhoe soll sofort mit Antidiarrhoika sofort beim ersten Auftreten behandelt werden. Bei Fällen von Übelkeit, Erbrechen und Diarrhoe von Grad 3 oder höher, die nicht innerhalb von 48 Stunden auf unterstützende Maßnahmen ansprechen, sollte die Anwendung von Fedratinib unterbrochen werden, bis sie auf Grad 1 oder weniger abgeklungen sind. Die tägliche Dosis sollte mit 100 mg unter der letzten verabreichten Dosis wieder aufgenommen werden. darüber hinaus sollten die Thiaminspiegel überwacht und bei Bedarf aufgefüllt werden.
Hepatische Toxizität
Unter der Behandlung mit Fedratinib wurden Erhöhungen von ALT und AST und ein Fall von Leberversagen berichtet. Die Leberfunktion der Patienten sollte deshalb bei Behandlungsbeginn, in den ersten drei Monaten mindestens monatlich, während der Behandlung in regelmäßigen Abständen und wie klinisch angezeigt überwacht werden. Wenn eine Toxizität beobachtet wird, sollten die Patienten bis zur Ausheilung mindestens alle zwei Wochen überwacht werden. ALT- und AST-Erhöhungen waren mit Dosisanpassungen oder dauerhaftem Behandlungsabbruch im Allgemeinen reversibel.
Erhöhte Amylase/Lipase
Unter der Behandlung mit Fedratinib wurden Erhöhungen der Amylase und/oder Lipase und ein Fall von Pankreatitis berichtet, weshalb diese Werte bei Behandlungsbeginn, in den ersten drei Monaten mindestens monatlich, während der Behandlung in regelmäßigen Abständen und wie klinisch angezeigt überwacht werden sollten. Wenn eine Toxizität beobachtet wird, sollten die Patienten bis zur Ausheilung mindestens alle zwei Wochen überwacht werden. Für Amylase und/oder Lipase von Grad 3 oder höher werden Dosisanpassungen empfohlen.
Erhöhtes Kreatinin
Unter der Behandlung mit Inrebic wurden Erhöhungen des Kreatininspiegels berichtet, weshalb die Kreatininspiegel der Patienten bei Behandlungsbeginn, in den ersten drei Monaten mindestens monatlich, während der Behandlung in regelmäßigen Abständen und wie klinisch angezeigt überwacht werden sollten. Bei schwerer Nierenfunktionsstörung (CLcr 15 ml/min bis 29 ml/min nach C-G) werden Dosisanpassungen empfohlen
Alternativen
Neben Fedratinib steht Patienten der orale JAK1/2-Inhibitor Ruxolitinib seit 2012 als erster zugelassener Tyrosinkinaseinhibitor für die Behandlung der Myelofibrose und Polycythaemia vera
zur Verfügung. Durch Ruxolitinib werden insbesondere die Splenomegalie und die krankheitsassoziierten Symptome positiv beeinflusst.
Wirkstoff-Informationen
- EMA: Fachinformation Inrebic
- DGHO: Nub Antrag 2020/2021 Fedratinib
- Bristol Myers Squibb: PRESSEMITTEILUNG 17. Dezember2020