Fesoterodin
Fesoterodin ist ein anticholinerger Wirkstoff aus der Gruppe der Muskarinrezeptor-Antagonisten (Parasympatholytika), der zur symptomatischen Behandlung einer überaktiven Blase (overactive bladder, OAB) eingesetzt wird.
Fesoterodin: Übersicht
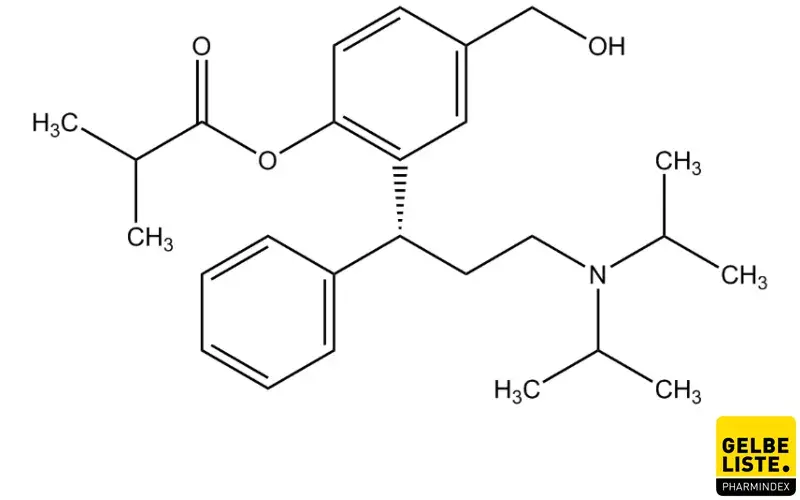
Anwendung
Der anticholinerge Wirkstoff Fesoterodin (Toviaz) ist indiziert zur symptomatischen Behandlung der Dranginkontinenz und/oder der Pollakisurie und des imperativen Harndrangs (wie sie bei erwachsenen Patienten mit dem Syndrom der überaktiven Harnblase auftreten können).
Anwendungsart
Fesoterodin(fumarat) ist als Retardtablette (4 und 8 mg) erhältlich. Die Einnahme kann unabhängig von den Mahlzeiten mit etwas Flüssigkeit erfolgen. Die Retardtabletten müssen im Ganzen geschluckt werden und dürfen nicht zerkaut, geteilt oder zermahlen werden.
Wirkmechanismus
Fesoterodin ist ein Ester-Prodrug, das durch unspezifische Plasmaesterasen schnell zum pharmakologisch aktiven Metaboliten Desfesoterodin (5-Hydroxymethyl-Tolterodin, 5-HMT) hydrolysiert. Desfesoterodin ist ein kompetitiver und spezifischer Muskarinrezeptor-Antagonist, dessen pharmakologische Wirkung primär durch Inhibition des muskarinischen M3-Rezeptors vermittelt wird.
Die Harnblase, die bei Überaktivität Symptome wie Dranginkontinenz und/oder Pollakisurie (häufiges Wasserlassen, meist in kleinen Mengen) verursachen kann, wird von parasympathischen, cholinergen Nerven innerviert. Dabei löst Acetylcholin (ACh) vor allem über den muskarinischen M3-Rezeptor eine Kontraktion der glatten Muskulatur des M. detrusor aus. Folglich wirkt die Hemmung dieses Rezeptorsubtyps durch (Des)Fesoterodin spasmolytisch auf die Harnblase, weshalb (Des)Fesoterodin auch den (urologischen) Spasmolytika zugeordnet werden kann.
Pharmakokinetik
Resorption
- Nach oraler Anwendung kann Fesoterodin aufgrund der schnellen und umfangreichen Hydrolyse durch unspezifische Plasmaesterasen nicht im Plasma nachgewiesen werden.
- Die Bioverfügbarkeit des aktiven Metaboliten Desfesoterodin beträgt 52%.
- Nach oraler Einzel- oder Mehrfachgabe von Fesoterodin in Dosierungen von 4 mg bis 28 mg verhalten sich die Plasmakonzentrationen des aktiven Metaboliten dosisproportional.
- Plasmaspitzenkonzentrationen werden nach etwa 5 Stunden erreicht.
- Therapeutische Plasmaspiegel stellen sich bereits nach der ersten Anwendung von Fesoterodin ein.
- Nach Mehrfachgabe kommt es zu keiner Kumulation.
Verteilung
- Die Bindung des aktiven Metaboliten an Plasmaproteine ist gering, wobei ungefähr 50% an Albumin und Alpha-1-Säure-Glykoprotein gebunden werden.
- Nach intravenöser Infusion des aktiven Metaboliten beträgt das mittlere Verteilungsvolumen im Steady State 169 L.
Metabolismus
- Nach oraler Anwendung wird Fesoterodin rasch und umfassend zu seinem aktiven Metaboliten Desfesoterodin (5-Hydroxymethyl-Tolterodin, 5-HMT) hydrolysiert.
- Der aktive Metabolit unterliegt in der Leber unter Beteiligung von CYP2D6 und CYP3A4 einer weiteren Metabolisierung zu seinen Carboxy-, Carboxy-N-Desisopropyl- und N-Desisopropyl-Metaboliten (keiner dieser Metaboliten trägt signifikant zur antimuskarinischen Wirkung von Fesoterodin bei).
- Die mittlere cmax und die AUC des aktiven Metaboliten sind bei langsamen Metabolisierern im Vergleich zu schnellen Metabolisierern von CYP2D6 um das bis zu 1,7- bzw. 2-Fache erhöht.
Elimination
- Die Metabolisierung in der Leber und die renale Ausscheidung tragen signifikant zur Elimination des aktiven Metaboliten bei.
- Nach oraler Anwendung von Fesoterodin werden ungefähr 70% der angewendeten Dosis in Form des aktiven Metaboliten (16%), Carboxy-Metaboliten (34%), Carboxy-N-Desisopropyl-Metaboliten (18%) bzw. N-Desisopropyl-Metaboliten (1%) renal eliminiert.
- Ein geringerer Anteil (7%) wird über die Fäzes eliminiert.
- Nach oraler Anwendung liegt die terminale Halbwertszeit des aktiven Metaboliten bei ca. 7 Stunden und ist abhängig von der Resorptionsrate.
Patientenindividuelle Pharmakokinetik
- Eingeschränkte Nierenfunktion: Bei Patienten mit leichter bis mäßiger Niereninsuffizienz (GFR 30 bis 80 mL/min) waren cmax und AUC des aktiven Metaboliten gegenüber gesunden Probanden bis zu 1,5- bzw. 1,8-fach erhöht. Bei Patienten mit schwerer Niereninsuffizienz (GFR < 30 mL/min) zeigt sich eine Erhöhung von cmax und AUC um das 2,0- bzw. 2,3-Fache.
- Eingeschränkte Leberfunktion: Bei Patienten mit mäßiger Leberinsuffizienz (Child-Pugh-Klasse B) waren cmax und AUC des aktiven Metaboliten gegenüber gesunden Probanden um das 1,4- bzw. 2,1-Fache erhöht (die Pharmakokinetik von Fesoterodin wurde bei Patienten mit schwerer Leberinsuffizienz nicht untersucht).
Dosierung
- Empfohlene Tagesdosis: 1x täglich 4 mg (je nach Ansprechen der Patienten kann auf eine Tageshöchstdosis von 8 mg 1x täglich erhöht werden)
- Die volle Wirksamkeit der Behandlung wurde nach 2 bis 8 Wochen beobachtet, weshalb empfohlen wird, den individuellen Behandlungserfolg nach 8 Wochen zu überprüfen.
- Eingeschränkte Nieren- und/oder Leberfunktion: In der Fachinformation sind die Empfehlungen für die Tagesdosis bei Patienten mit eingeschränkter Nieren- oder Leberfunktion mit und ohne gleichzeitige Anwendung von mäßigen oder starken CYP3A4-Inhibitoren in einer Tabelle zusammengefasst (bei Patienten mit schwerer Leberfunktionsstörung ist Fesoterodin kontraindiziert).
- CYP3A4-Inhibitoren: Bei Patienten mit normaler Nieren- und Leberfunktion, die gleichzeitig starke CYP3A4-Inhibitoren erhalten, beträgt die Tageshöchstdosis 4 mg 1x täglich.
Nebenwirkungen
Aufgrund des pharmakologischen Wirkmechanismus kann Fesoterodin anticholinerge Nebenwirkungen verursachen, die im Allgemeinen dosisabhängig sind.
Die am häufigsten beschriebene (anticholinerge) Nebenwirkung von Fesoterodin ist Mundtrockenheit (Häufigkeit 28,8% in der Fesoterodin-Gruppe im Vergleich zu 8,5% in der Placebo-Gruppe).
Die Mehrzahl der Nebenwirkungen trat im 1. Behandlungsmonat auf, mit Ausnahme von Fällen von Harnverhalt oder einem Restharnvolumen nach Blasenentleerung von mehr als 200 mL, die auch nach längerer Behandlungsdauer auftreten konnten (bei Männern häufiger als bei Frauen).
Weitere häufige Nebenwirkungen umfassen:
- Kopfschmerzen
- Schwindel
- Trockene Augen und Kehle
- Bauchschmerzen
- Übelkeit
- Dyspepsie
- Obstipation
- Diarrhö
- Schlaflosigkeit
- Dysurie
Wechselwirkungen
Pharmakodynamische Wechselwirkungen
- Die gleichzeitige Applikation anderer Wirkstoffe mit anticholinergen Eigenschaften kann sowohl die therapeutischen Effekte als auch die (anticholinergen) Nebenwirkungen verstärken.
- Die therapeutische Wirkung von Fesoterodin kann durch die gleichzeitige Gabe cholinerger Rezeptoragonisten vermindert werden.
- Fesoterodin kann die Wirkung von Arzneimitteln vermindern, die die Motilität des Gastrointestinaltrakts anregen (wie z.B. Metoclopramid).
Pharmakokinetische Wechselwirkungen
- In-vitro-Daten zeigen, dass der aktive Metabolit von Fesoterodin in klinisch relevanten Plasmakonzentrationen keine Hemmung von CYP1A2, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 oder 3A4 und keine Induktion von CYP1A2, 2B6, 2C9, 2C19 oder 3A4 bedingt (demzufolge hat Fesoterodin wahrscheinlich keinen Einfluss auf die Clearance von Wirkstoffen, die von diesen Enzymen metabolisiert werden).
- Starke CYP3A4-Inhibitoren: Bei Hemmung von CYP3A4 durch gleichzeitige Gabe von Ketoconazol 200 mg 2x täglich kam es bei schnellen CYP2D6-Metabolisierern zu einem Anstieg von cmax (Plasmaspitzenkonzentration) und der AUC des aktiven Metaboliten von Fesoterodin um das 2,0- bzw. 2,3-Fache, bei langsamen CYP2D6-Metabolisierern zu einer Zunahme um das 2,1- bzw. 2,5-Fache (daher sollte die Höchstdosis von Fesoterodin auf 4 mg begrenzt werden, wenn gleichzeitig starke CYP3A4-Hemmer wie Atazanavir, Clarithromycin, Indinavir, Itraconazol, Ketoconazol, Nefazodon, Nelfinavir, Ritonavir (und alle durch Ritonavir verstärkten Therapien mit Proteasehemmern), Saquinavir und Telithromycin angewendet werden.
- Mäßige CYP3A4-Inhibitoren: Bei Hemmung von CYP3A4 durch gleichzeitige Gabe des mäßigen CYP3A4-Hemmers Fluconazol 200 mg 2x täglich über 2 Tage kam es zu einem Anstieg von cmax und der AUC des aktiven Metaboliten von Fesoterodin um ungefähr 19% bzw. 27%, wobei eine Anpassung der Dosierung in Gegenwart mäßiger CYP3A4-Hemmer wie Erythromycin, Fluconazol, Diltiazem, Verapamil und Grapefruitsaft nicht empfohlen wird.
- CYP3A4-Induktoren: Bei Induktion von CYP3A4 durch die gleichzeitige Gabe von Rifampicin 600 mg 1x täglich kam es nach oraler Anwendung von Fesoterodin 8 mg zu einer Reduktion von cmax und der AUC des aktiven Metaboliten von Fesoterodin um ungefähr 70% bzw. 75% (eine Induktion von CYP3A4 kann zu subtherapeutischen Plasmaspiegeln führen, weshalb die gleichzeitige Anwendung mit CYP3A4-Induktoren wie Carbamazepin, Rifampicin, Phenobarbital, Phenytoin und Johanniskraut nicht empfohlen wird).
- CYP2D6: Bei langsamen CYP2D6-Metabolisierern sind die mittlere cmax und die mittlere AUC des aktiven Metaboliten im Vergleich zu schnellen Metabolisierern um das 1,7- bzw. 2-Fache erhöht. Die gleichzeitige Anwendung eines starken CYP2D6-Inhibitors kann demnach zu einer verstärkten Exposition und unerwünschten Effekten führen (Dosisreduktion auf 4 mg kann erforderlich sein), wobei die Wechselwirkung mit CYP2D6-Inhibitoren klinisch nicht untersucht wurde.
Kontraindikationen
Fesoterodin ist kontraindiziert bei Patienten mit:
- Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels
- Harnretention
- Retention des Mageninhaltes
- Unbehandeltem oder nicht ausreichend behandeltem Engwinkelglaukom
- Myasthenia gravis
- Schwerer Leberfunktionsstörung (Child-Pugh C)
- Schwerer Colitis ulcerosa
- Toxischem Megakolon
- Gleichzeitiger Behandlung mit starken CYP3A4-Inhibitoren bei Patienten mit mäßiger bis schwerer Einschränkung der Leber- oder Nierenfunktion
Schwangerschaft
Es liegen keine hinreichenden Daten für die Anwendung von Fesoterodin bei Schwangeren vor. Tierexperimentelle Studien zur Reproduktionstoxizität mit Fesoterodin zeigen eine geringe Embryotoxizität. Das potenzielle Risiko für den Menschen ist allerdings nicht bekannt, weshalb die Anwendung von Fesoterodin während der Schwangerschaft nicht empfohlen wird.
Stillzeit
Es ist nicht bekannt, ob Fesoterodin oder die entstehenden Metaboliten beim Menschen in die Muttermilch übergehen, weshalb empfohlen wird, während der Behandlung mit Fesoterodin nicht zu stillen.
Verkehrstüchtigkeit
Da Fesoterodin wie andere Anticholinergika zu verschwommenem Sehen und/oder zu Somnolenz und Müdigkeit führen kann, können die Verkehrstüchtigkeit und die Fähigkeit, Maschinen zu bedienen, eingeschränkt sein.
Anwendungshinweise
Allgemein
- Bevor eine Behandlung mit Antimuskarinika in Betracht gezogen wird, müssen organische Ursachen ausgeschlossen werden.
- Die Unbedenklichkeit und Wirksamkeit wurden bei Patienten mit einer neurogenen Ursache für die Detrusorüberaktivität noch nicht untersucht.
- Andere Ursachen für häufiges Wasserlassen (Behandlung von Herzinsuffizienz oder Nierenerkrankung) müssen vor der Behandlung mit Fesoterodin abgeklärt werden.
- Falls eine Harnwegsinfektion vorliegt, müssen geeignete medizinische Maßnahmen ergriffen bzw. eine antibakterielle Therapie eingeleitet werden.
-
Fesoterodin ist mit Vorsicht anzuwenden bei Patienten mit:
o Klinisch relevanten obstruktiven Harnabflussstörungen mit dem Risiko eines Harnverhalts (z.B. klinisch relevante Vergrößerung der Prostata bei benigner Prostatahyperplasie)
o Obstruktiven gastrointestinalen Störungen (z.B. Pylorusstenose)
o Gastroösophagealem Reflux und/oder gleichzeitiger Behandlung mit Arzneimitteln, die eine Ösophagitis verursachen oder verstärken können (z.B. orale Bisphosphonate)
o Verminderter gastrointestinaler Motilität
o Autonomer Neuropathie
o Ausreichend behandeltem Engwinkelglaukom - Bei der Verschreibung oder bei einer Dosiserhöhung von Fesoterodin bei Patienten, bei denen eine verstärkte Exposition mit dem aktiven Metaboliten zu erwarten ist, ist Vorsicht geboten (eingeschränkte Leber- und/oder Nierenfunktion, gleichzeitige Anwendung von starken oder mäßigen CYP3A4-Inhibitoren, gleichzeitige Anwendung von starken CYP2D6-Inhibitoren).
Angioödem
- Unter Fesoterodin wurde über das Auftreten eines Angioödems berichtet, in einigen Fällen bereits nach der ersten Einnahme.
- Wenn ein Angioödem auftritt, sollte Fesoterodin abgesetzt und unverzüglich eine geeignete Therapie eingeleitet werden.
QT-Verlängerung
-
Fesoterodin ist mit Vorsicht anzuwenden bei Patienten mit:
o Risiko für eine QT-Verlängerung (z.B. Hypokaliämie, Bradykardie und gleichzeitige Gabe von Arzneimitteln, die bekanntermaßen das QT-Intervall verlängern)
o Manifesten vorbestehenden Herzerkrankungen (z.B. ischämische Herzkrankheit, Arrhythmie, Herzinsuffizienz)
Alternativen
Die medikamentösen Therapiealternativen richten sich nach dem Indikationsgebiet bzw. den Symptomen und sind darüber hinaus abhängig von patientenindividuellen Faktoren wie dem Alter der Patienten, Komorbiditäten oder dem Schweregrad der Erkrankung.
OAB
- Andere Muskarinrezeptor-Antagonisten wie Oxybutynin, Propiverin. Trospium, Solifenacin, Darifenacin und Tolterodin
- Mirabegron
- Botulinumneurotoxin A
Weitere Informationen können der jeweiligen Fachinformation entnommen werden.
Wirkstoff-Informationen
- EMA: Fachinformation Toviaz
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- AWMF: S2k-Leitlinie Medikamentöse Therapie der neurogenen Dysfunktion des unteren Harntraktes (NLUTD) (2022)
-
Fesoterodin AL 4 mg Retardtabletten
ALIUD PHARMA® GmbH
-
Fesoterodin AL 8 mg Retardtabletten
ALIUD PHARMA® GmbH
-
Fesoterodin Aristo 4 mg Retardtabletten
Aristo Pharma GmbH
-
Fesoterodin Aristo 8 mg Retardtabletten
Aristo Pharma GmbH
-
Toviaz 4 mg 2care4 Retardtabletten
2care4 ApS
-
Toviaz 4 mg Abacus Retardtabletten
Abacus Medicine A/S
-
Toviaz 4 mg Emra Retardtabletten
Emra-Med Arzneimittel GmbH
-
Toviaz 4 mg Eurim Retardtabletten
Eurim-Pharm Arzneimittel GmbH
-
Toviaz 4 mg kohlpharma Retardtabletten
kohlpharma GmbH
-
TOVIAZ® 4 mg Retardtabletten
Pfizer Pharma GmbH
-
Toviaz 8 mg 2care4 Retardtabletten
2care4 ApS
-
Toviaz 8 mg Abacus Retardtabletten
Abacus Medicine A/S
-
Toviaz 8 mg Emra Retardtabletten
Emra-Med Arzneimittel GmbH
-
Toviaz 8 mg Eurim Retardtabletten
Eurim-Pharm Arzneimittel GmbH
-
Toviaz 8 mg kohlpharma Retardtabletten
kohlpharma GmbH
-
TOVIAZ® 8 mg Retardtabletten
Pfizer Pharma GmbH











