Fremanezumab
Fremanezumab ist der dritte Antikörper, der zur Migräneprophylaxe bei Erwachsenen über subkutane Applikation angewendet wird. Das Arzneimittel richtet sich gegen das Calcitonin-Gene-Related Peptide (CGRP) und hemmt dessen biologische Aktivität. CGRP spielt nach aktuellem Stand der Wissenschaft eine wichtige Rolle in der Pathogenese der Migräne.
Fremanezumab: Übersicht
Anwendung
Fremanezumab wird angewendet zur Migräneprophylaxe bei Erwachsenen mit mindestens 4 Migränetagen pro Monat und wird subkutan appliziert.
Anwendungsart
Fremanezumab ist als Injektionslösung in einer Fertigspritze auf dem deutschen Markt verfügbar. Patienten können sich das Arzneimittel selbst injizieren, nachdem sie von medizinischem Fachpersonal angeleitet wurden.
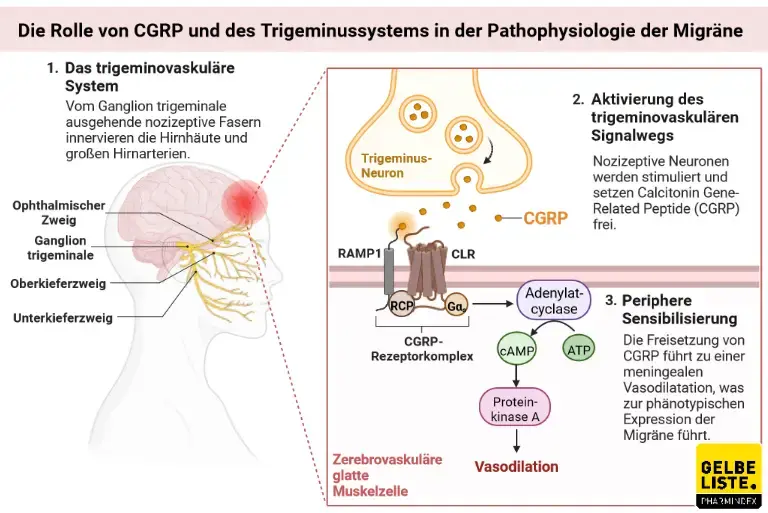
Wirkmechanismus
Fremanezumab ist wie auch Galcanezumab ein humanisierter monoklonaler Antikörper, der an CGRP (Calcitonin Gene-Related Peptide) bindet und dessen biologische Aktivität inhibiert.
CGRP spielt nach aktuellen Wissensstand eine wichtige Rolle im Entzündungsgeschehen und somit der Pathogenese von Migräne. Migräne-Patienten weisen während einer Migräne-Attacke erhöhte Blutkonzentrationen von CGRP auf.
Pharmakokinetik
Resorption
Die mediane Dauer bis zum Erreichen der Maximalkonzentration (tmax) betrug bei gesunden Probanden nach subkutaner Injektion von Fremanezumab (225 mg bzw. 675 mg) 5 bis 7 Tage. Die absolute Bioverfügbarkeit von Fremanezumab nach subkutaner Applikation von 225 mg und 900 mg an gesunden Probanden betrug 55 % (± SD von 23 %) bis 66 % (± SD von 26 %). Zwischen den Dosierungen von 225 mg und 675 mg wurde eine Dosisproportionalität festgestellt. Der Steady-State wurde bei den Dosierungsschemata 225 mg monatlich und 675 mg vierteljährlich nach ca. 168 Tagen erreicht.
Verteilung
Das Verteilungsvolumen betrug ausgehend von der Annahme einer modellierten geschätzten Bioverfügbarkeit von 66 % (± SD von 26 %) 3,6 l (VK 35,1 %).
Biotransformation
Es wird erwartet, dass wie bei anderen monoklonalen Antikörpern auch, Fremanezumab durch enzymatische Proteolyse in kleine Peptide und Aminosäuren zerfällt.
Elimination
Die Clearance lag ausgehend von der Annahme einer modellierten geschätzten Bioverfügbarkeit von 66 % (± SD von 26 %) bei 0,09 l/Tag (VK 23,4 %). Die gebildeten kleinen Peptide und Aminosäuren können im Körper zur de-novo-Synthese von Proteinen wiederverwendet oder über die Nieren ausgeschieden werden.
Die geschätzte Halbwertszeit liegt bei 30 Tagen.
Dosierung
Für die Anwendung von Fremanezumab stehen zwei Dosierungsoptionen zur Verfügung:
- 225 mg einmal monatlich (monatliche Dosierung) oder
- 675 mg alle drei Monate (vierteljährliche Dosierung)
Nebenwirkungen
In klinischen Studien häufig aufgetretene Nebenwirkungen waren lokale Reaktionen an der Injektionsstelle mit:
- Schmerzen (24 %)
- Verhärtung (17 %)
- Erythem (16 %)
- Juckreiz (2 %)
In weniger als einem Prozent der Fälle wurden Überempfindlichkeitsreaktionen unter Fremanezumab in klinischen Studien berichtet. Bei Auftreten einer Überempfindlichkeitsreaktion ist ein Abbruch in Erwägung zu ziehen und eine geeignete Therapie einzuleiten.
Wechselwirkungen
Es werden aufgrund der Eigenschaften von Fremanezumab keine pharmakokinetischen Wechselwirkungen mit anderen Arzneimitteln erwartet. Die begleitende Anwendung von Migränetherapeutika (insbesondere Analgetika, Ergotaminderivate und Triptane) und auch präventiven Migränemedikamenten zeigten innerhalb der klinischen Studien keine Beeinträchtigung der Pharmakokinetik von Fremanezumab.
Kontraindikationen
Fremanezumab darf nicht angewendet werden, wenn eine Überempfindlichkeit gegenüber dem Wirkstoff besteht.
Schwangerschaft
Es liegen nur begrenzte Erfahrungen mit der Anwendung von Fremanezumab während der Schwangerschaft vor. Tierexperimentelle Studien ergaben keine Hinweise auf eine Reproduktionstoxizität. Als Vorsichtsmaßnahme sollte eine Anwendung während der Schwangerschaft jedoch vermieden werden.
Stillzeit
Es ist nicht bekannt ob Fremanezumab in die Muttermilch übergeht. Humanes IgG geht in den ersten Tagen nach der Entbindung in die Muttermilch über. In diesem kurzen Zeitraum kann daher ein Risiko für das gestillte Kind nicht ausgeschlossen werden. Danach sollte die Anwendung von Fremanezumab nur in Betracht gezogen werden, falls dies klinisch unbedingt erforderlich ist.
Verkehrstüchtigkeit
Fremanezumab hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Alternativen
Neben Fremanezumab (Ajovy) sind noch Erenumab (Aimovig), Galcanezumab (Emgality) und Eptinezumab (VYEPTI) als Antikörper zur Migräneprophylaxe auf dem deutschen Markt verfügbar, die in das Calcitonin-Gene-Related-Peptide-System eingreifen.
- Fachinformation Ajovy
- Lionetto, Luana, et al. "Fremanezumab." Monoclonal antibodies in headache (2021): 131-136.
- Silberstein, Stephen D., Joshua M. Cohen, and Paul P. Yeung. "Fremanezumab for the preventive treatment of migraine." Expert Opinion on Biological Therapy 19.8 (2019): 763-771.
Abbildung
Adapted from „The Role of CGRP and the Trigeminal System in Migraine Pathophysiology”, by BioRender.com
-
Ajovy 225 mg CC Pharma Injektionslösung in einer Fertigspritze
CC Pharma GmbH
-
Ajovy 225 mg Eurim Injektionslösung in einer Fertigspritze
Eurim-Pharm Arzneimittel GmbH
-
AJOVY® 225 mg Injektionslösung im Fertigpen
TEVA GmbH
-
AJOVY® 225 mg Injektionslösung in einer Fertigspritze
TEVA GmbH
-
Ajovy 225 mg kohlpharma Injektionslösung im Fertigpen
kohlpharma GmbH
-
Ajovy 225 mg kohlpharma Injektionslösung in einer Fertigspritze
kohlpharma GmbH
-
Ajovy 225 mg Paranova Injektionslösung in einer Fertigspritze
Paranova Pack A/S














