Fulvestrant
Der kompetitive Estrogenrezeptor-Antagonist Fulvestrant wird als Mono- oder Kombinationstherapie zur Behandlung des Hormonrezeptor-positiven, lokal fortgeschrittenen oder metastasierten Mammakarzinoms als intramuskuläre Injektion eingesetzt.
Fulvestrant: Übersicht
Anwendung
Fulvestrant wird aufgrund seiner antagonistischen Wirkung am Estrogenrezeptor (ER) angewendet als:
- Monotherapie zur Behandlung von ER-positivem, lokal fortgeschrittenem oder metastasiertem Mammakarzinom bei postmenopausalen Frauen, die keine vorhergehende endokrine Therapie erhalten haben, ein Rezidiv während oder nach adjuvanter Antiestrogen-Therapie oder eine Progression der Erkrankung unter Antiöstrogen-Therapie zeigen.
- Kombinationstherapie mit Palbociclib zur Behandlung des Hormonrezeptor-(HR)-positiven, humanen Wachstumsfaktor-Rezeptor-2-(HER2)-negativen, lokal fortgeschrittenen oder metastasierten Mammakarzinoms bei Frauen, die eine vorhergehende endokrine Therapie erhalten haben (bei prä- oder perimenopausalen Frauen sollte die Kombinationstherapie mit Palbociclib mit einem Luteinisierungshormon-Releasinghormon-(LHRH)-Agonisten kombiniert werden).
Anwendungsart
Fulvestrant ist als Injektionslösung in einer Fertigspitze erhältlich. Dabei enthält jede Fertigspritze 250 mg Fulvestrant in 5 mL Lösung.
Fulvestrant sollte langsam in Form von zwei unmittelbar aufeinander folgenden 5-mL-Injektionen intramuskulär ins Gesäß appliziert werden (1-2 Minuten pro Injektion), eine in jede Gesäßhälfte (Glutealbereich).
Wenn Fulvestrant dorsogluteal injiziert wird, ist aufgrund der Nähe zum tiefer liegenden Ischiasnerv Vorsicht geboten.
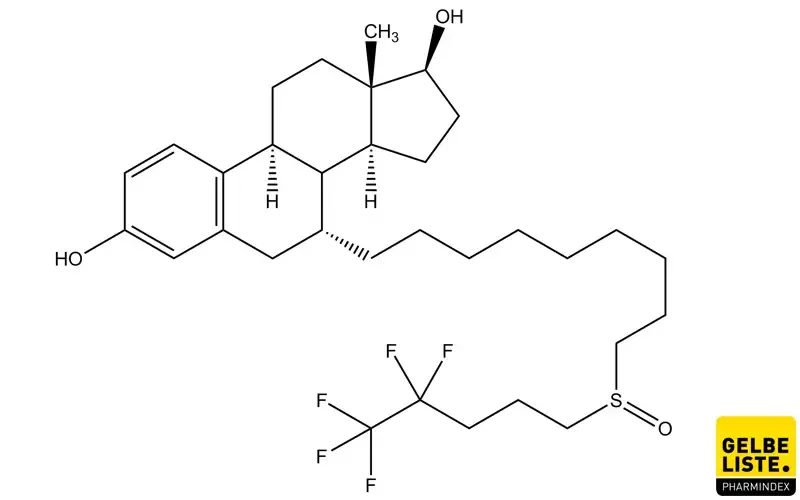
Wirkmechanismus
Fulvestrant ist ein kompetitiver Antagonist am Estrogenrezeptor (ER), dessen Affinität zum ER mit der des Estradiols vergleichbar ist. Dabei besitzt Fulvestrant im Vergleich zu SERMs wie Tamoxifen keine partiell agonistische, estrogenartige Wirkung, sondern inhibiert die trophischen Effekte der Estrogene.
Der gebildete Fulvestrant-ER-Komplex wird darüber hinaus im Zytoplasma abgebaut, was mit einer Reduktion (Downregulation) der Estrogenrezeptoren einhergeht. Wirkstoffe, die den Abbau von Estrogenrezeptoren fördern, werden als „Selektive Estrogenrezeptor Degrader“ (SERD) bezeichnet.
Klinische Studien mit postmenopausalen Frauen mit primärem Mammakarzinom haben gezeigt, dass Fulvestrant das ER-Level in ER-positiven Tumoren im Vergleich zu Placebo signifikant reduziert. In Übereinstimmung mit dem Fehlen von intrinsischen Estrogen-agonistischen Wirkungen war die Expression des Progesteronrezeptors (PR) ebenfalls signifikant vermindert.
Pharmakokinetik
Resorption
- Nach intramuskulärer Injektion wird Fulvestrant langsam resorbiert, sodass die maximale Plasmakonzentration (cmax) nach etwa 5 Tagen erreicht wird.
- Bei der Anwendung des 500-mg-Dosierungsregimes werden innerhalb des ersten Monats nach der Anwendung Expositionslevel (annähernd) auf auf dem Niveau des Steady state erreicht (mittlerer [CV]: AUC 475 [33,4%] ng. Tage/mL, cmax 25,1 [35,3%] ng/mL, bzw. cmin 16,3 [25.9%] ng/mL).
- Im Steady state bleiben die Plasmakonzentrationen von Fulvestrant in einem relativ engen Bereich mit einer bis zu ungefähr 3-fachen Differenz zwischen maximalen und minimalen Konzentrationen.
- Nach intramuskulärer Applikation ist im Dosierungsbereich von 50 bis 500 mg die Exposition annähernd dosisproportional.
Verteilung
- Fulvestrant verteilt sich schnell und extensiv, wobei das große scheinbare Verteilungsvolumen im Steady state (Vdss) von ca. 3 bis 5 L/kg zeigt, dass sich Fulvestrant überwiegend extravasal verteilt.
- Fulvestrant wird in hohem Maße (ca. 99%) an Plasmaproteine gebunden.
- Fraktionen von Lipoprotein sehr niedriger Dichte (VLDL), Lipoprotein niedriger Dichte (LDL) und Lipoprotein hoher Dichte (HDL) sind die hauptsächlichen Bindungspartner.
Metabolismus
- Der Metabolismus von Fulvestrant ist noch nicht vollständig aufgeklärt, allerdings entsprechen manche Biotransformationswege denen endogener Steroide.
- Die identifizierten Metaboliten (einschließlich 17-Keton-, Sulfon-, 3-Sulfat-, 3- und 17-Glucuronidmetaboliten) sind in Antiestrogenmodellen entweder weniger wirksam oder zeigen eine ähnliche Aktivität wie Fulvestrant.
- Studien an menschlichen Leberpräparaten und rekombinanten menschlichen Enzymen zeigen, dass CYP3A4 das einzige P-450 Isoenzym ist, das an der Oxidation von Fulvestrant beteiligt ist (jedoch scheinen in vivo nicht durch P-450 vermittelte Biotransformationswege zu überwiegen).
Elimination
- Fulvestrant wird hauptsächlich in metabolisierter Form über die Fäzes eliminiert (< 1% über den Urin).
- Fulvestrant hat eine hohe Clearance (11 ± 1,7 mL/min/kg), die auf ein hohes hepatisches Extraktionsverhältnis hinweist.
- Die terminale Halbwertszeit (t1/2) nach intramuskulärer Applikation wird von der Absorptionsrate bestimmt und wurde auf 50 Tage berechnet.
Dosierung
Erwachsene Frauen
- Die empfohlene Dosis beträgt 500 mg in Abständen von einem Monat, wobei zwei Wochen nach der Anfangsdosis eine zusätzliche 500-mg-Dosis gegeben wird.
- Eine Kombinationstherapie mit Palbociclib erfordert die Berücksichtigung der Fachinformation von Palbociclib.
- Vor Behandlungsbeginn einer Kombinationstherapie aus Fulvestrant und Palbociclib und während der Dauer der Behandlung sollten prä-/perimenopausale Frauen gemäß der lokalen klinischen Praxis mit LHRH-Agonisten behandelt werden.
Patientinnen mit Nieren- und/oder Leberfunktionsstörungen
- Bei Patientinnen mit leichter bis mittelschwerer Einschränkung der Nierenfunktion (Kreatinin-Clearance ≥ 30 mL/min) wird keine Dosisanpassung empfohlen.
- Die Sicherheit und Wirksamkeit bei Patientinnen mit schwerer Einschränkung der Nierenfunktion (Kreatinin-Clearance < 30 mL/min) sind nicht untersucht worden, daher ist Fulvestrant bei diesen Patientinnen mit Vorsicht anzuwenden.
- Eine Dosisanpassung wird bei Patientinnen mit leichter bis mittelschwerer Einschränkung der Leberfunktion nicht empfohlen.
- Trotzdem sollte bei diesen Patientinnen Fulvestrant mit Vorsicht angewendet werden, da die Exposition von Fulvestrant erhöht sein kann (es liegen keine Daten von Patientinnen mit schweren Leberfunktionsstörungen vor).
Nebenwirkungen
Die häufigsten Nebenwirkungen, die während einer Monotherapie mit Fulvestrant auftreten können, sind:
- Infektionen des Harntrakts
- Überempfindlichkeitsreaktionen (an der Injektionsstelle)
- Hautauschlag
- Anorexie
- Kopfschmerzen
- Hitzewallungen
- Asthenie
- Venöse Thromboembolien
- Übelkeit und Erbrechen
- Gelenk- und muskuloskelettale Schmerzen sowie Rückenschmerzen
- Vaginale Blutungen
- Periphere Neuropathie und Ischialgie
- Erhöhung der Bilirubin- und Leberenzymwerte (ALT, AST, ALP)
Das individuelle Risikoprofil der Patientinnen für thromboembolische Ereignisse ist zu berücksichtigen, um eine Lungenembolie als schwerwiegende Nebenwirkung zu verhindern.
Wechselwirkungen
Bisher liegen unzureichend Daten zu Wechselwirkungen von Fulvestrant vor (CYP3A4-bedingte Wechselwirkungen sind klinisch zu vernachlässigen).
Kontraindikationen
Fulvestrant ist kontraindiziert bei:
- Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels
- Schwangerschaft und Stillzeit
- Schwerer Einschränkung der Leberfunktion
Schwangerschaft
Die Anwendung von Fulvestrant ist während der Schwangerschaft kontraindiziert. Bei Ratten und Kaninchen passiert Fulvestrant nach intramuskulären Einzeldosen die Plazenta. Tierstudien haben zusätzlich eine Reproduktionstoxizität mit einer erhöhten Inzidenz von fetalen Anomalien und Todesfällen gezeigt.
Falls unter der Behandlung mit Fulvestrant eine Schwangerschaft eintritt, muss die Patientin über die mögliche Gefahr für den Fetus und das potenzielle Risiko einer Fehlgeburt informiert werden.
Stillzeit
Fulvestrant geht bei laktierenden Ratten in die Muttermilch über. Es ist allerdings nicht bekannt, ob dies auch beim Menschen geschieht. Aufgrund möglicher schwerwiegender Nebenwirkungen durch Fulvestrant bei Säuglingen ist die Anwendung während der Stillzeit kontraindiziert, sodass das Stillen während der Behandlung unterbrochen werden muss.
Verkehrstüchtigkeit
Fulvestrant hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Bei Patientinnen, bei denen eine Asthenie auftritt (häufige Nebenwirkung), ist beim Führen von Fahrzeugen und beim Bedienen von Maschinen Vorsicht geboten.
Anwendungshinweise
Die Anwendung von Fulvestrant sollte bei diesen Patientinnen mit Vorsicht erfolgen:
- Patientinnen mit leichter bis mittelschwerer Leberfunktionsstörung
- Patientinnen mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance < 30 ml/min)
- Patientinnen mit Blutungsneigung, Thrombozytopenie oder Antikoagulanzien-Medikation (aufgrund der intramuskulären Applikation)
- Patientinnen mit einem erhöhten thromboembolischen Risiko
Darüber hinaus sind Ereignisse an der Injektionsstelle, einschließlich Ischialgie, Neuralgie, neuropathischer Schmerz und periphere Neuropathie im Zusammenhang mit einer Fulvestrant-Injektion berichtet worden, weshalb aufgrund der Nähe zum tiefer liegenden Ischiasnerv bei dorsoglutealer Injektion Vorsicht geboten ist.
Alternativen
In Abhängigkeit vom Erkrankungsstadium, dem vorhandenen tumorspezifischen Expressions- und Mutationsprofil sowie patientenindividuellen Faktoren kommen neben einer Operation oder Strahlentherapie folgende Wirkstoffe als Alternativen in Frage:
- Anti-HER2-Antikörper wie Trastuzumab
- VEGF-gerichtete Therapie wie Bevacizumab (Anti-VEGF-Antikörper)
- Zytostatika wie Alkylanzien (z.B. Cyclophosphamid), Anthrazykline (z.B. Doxorubicin), Taxane (z.B. Paclitaxel), Platinverbindungen (z.B. Cisplatin) oder Antimetabolite (z.B. Capecitabin)
- mTOR-Inhibitoren wie Everolimus
- Aromatase-Inhibitoren wie Anastrozol oder Exemestan
- SERMs wie Tamoxifen
- CDK4/6-Inhibitoren wie Palbociclib
- PARP-Inhibitoren wie Olaparib
- Kinaseinhibitoren wie Lapatinib
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
- EMA: Faslodex
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- Osborne, C. K., Wakeling, A., & Nicholson, R. I. (2004). Fulvestrant: an oestrogen receptor antagonist with a novel mechanism of action. British journal of cancer, 90 Suppl 1(Suppl 1), S2–S6.
- AWMF: Interdisziplinäre S3-Leitlinie für die Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms, Kurzversion, Juni 2021
-
Faslodex 250 mg Abacus Injektionslösung
Abacus Medicine A/S
-
Faslodex 250 mg ACA Injektionslösung
A.C.A. Müller ADAG Pharma AG
-
Faslodex 250 mg Adequapharm Injektionslösung
Adequapharm GmbH
-
Faslodex 250 mg axicorp Injektionslösung
axicorp Pharma B.V.
-
Faslodex 250 mg BB Farma Injektionslösung
BB Farma S.R.L.
-
Faslodex 250 mg Canoma Injektionslösung
Canoma Pharma GmbH
-
Faslodex 250 mg CC Pharma Injektionslösung
CC Pharma GmbH
-
Faslodex 250 mg docpharm Injektionslösung
Docpharm GmbH
-
Faslodex 250 mg Emra Injektionslösung
Emra-Med Arzneimittel GmbH
-
Faslodex 250 mg Eurim Injektionslösung
Eurim-Pharm Arzneimittel GmbH
-
Faslodex 250 mg European Injektionslösung
European Pharma B.V.
-
Faslodex® 250 mg Injektionslösung
AstraZeneca GmbH
-
Faslodex 250 mg kohlpharma Injektionslösung
kohlpharma GmbH
-
Faslodex 250 mg Medicopharm Injektionslösung
Medicopharm AG
-
Faslodex 250 mg Originalis Injektionslösung
Originalis B.V.
-
Fulvestrant - 1 A Pharma® 250 mg Injektionslösung in einer Fertigspritze
1 A Pharma GmbH
-
Fulvestrant Accord 250 mg Injektionslösung in einer Fertigspritze
Accord Healthcare GmbH
-
Fulvestrant AL 250 mg Injektionslösung in einer Fertigspritze
ALIUD PHARMA® GmbH
-
Fulvestrant AXiromed 250 mg Injektionslösung in einer Fertigspritze
Medical Valley Invest AB
-
Fulvestrant beta 250 mg Injektionslösung in einer Fertigspritze
betapharm Arzneimittel GmbH
-
Fulvestrant Cipla 250 mg Injektionslösung in einer Fertigspritze
Cipla Europe NV
-
Fulvestrant EVER Pharma 250 mg 101 Carefarm Injektionslösung in einer Fertigspritze
1 0 1 Carefarm GmbH
-
Fulvestrant EVER Pharma 250 mg Eurim Injektionslösung in einer Fertigspritze
Eurim-Pharm Arzneimittel GmbH
-
Fulvestrant EVER Pharma 250 mg Injektionslösung in einer Fertigspritze
Ever Pharma GmbH
-
Fulvestrant EVER Valinject 250 mg Injektionslösung in einer Fertigspritze
Ever Pharma GmbH
-
Fulvestrant Fresenius Kabi 250 mg Injektionslösung in einer Fertigspritze
FRESENIUS KABI Deutschland GmbH
-
Fulvestrant Glenmark 250 mg Injektionslösung in einer Fertigspritze
Glenmark Arzneimittel GmbH
-
Fulvestrant Heumann 250 mg Injektionslösung in einer Fertigspritze
Heumann Pharma GmbH & Co. Generica KG
-
Fulvestrant HEXAL 250 mg BB Farma Injektionslösung in einer Fertigspritze
BB Farma S.R.L.
-
Fulvestrant HEXAL® 250 mg Injektionslösung in einer Fertigspritze
Hexal AG
-
Fulvestrant medac 250 mg Injektionslösung in einer Fertigspritze
medac Gesellschaft für klinische Spezialpräparate mbH
-
Fulvestrant Mylan 250 mg Injektionslösung in einer Fertigspritze
Viatris Healthcare GmbH
-
Fulvestrant onkovis 250 mg Injektionslösung in einer Fertigspritze
Onkovis GmbH
-
Fulvestrant PUREN 250 mg Injektionslösung in einer Fertigspritze
PUREN Pharma GmbH & Co. KG
-
Fulvestrant-ratiopharm 250 mg BB Farma Injektionslösung in einer Fertigspritze
BB Farma S.R.L.
-
Fulvestrant-ratiopharm® 250 mg Injektionslösung in einer Fertigspritze
ratiopharm GmbH
-
Fulvestrant Ribosepharm 250 mg Injektionslösung in einer Fertigspritze
Hikma Pharma GmbH
-
Fulvestrant STADA 250 mg BB Farma Injektionslösung in einer Fertigspritze
BB Farma S.R.L.
-
Fulvestrant STADA® 250 mg Injektionslösung in einer Fertigspritze
STADAPHARM GmbH
-
Fulvestrant SUN 250 mg Injektionslösung in einer Fertigspritze
Sun Pharmaceuticals Germany GmbH
-
Fulvestrant Teva 250 mg BB Farma Injektionslösung in einer Fertigspritze
BB Farma S.R.L.
-
Fulvestrant Zentiva 250 mg Injektionslösung in einer Fertigspritze
Zentiva Pharma GmbH













