Ganciclovir
Ganciclovir ist ein Nukleosidanalogon und DNA-Polymerase-Inhibitor, der zur Behandlung einer Cytomegalievirus-Infektion und einer Herpes simplex-Keratitis angewendet wird.
Ganciclovir: Übersicht
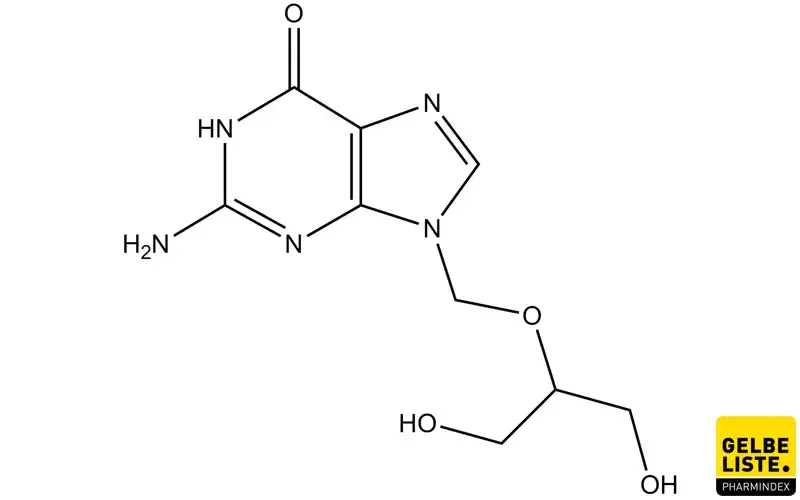
Anwendung
Ganciclovir besitzt folgende Indikationsgebiete:
- In Form eines Augengels zur Behandlung der akuten, oberflächlichen Herpes simplex-Keratitis
- Als intravenöse Infusion zur Behandlung einer Cytomegalievirus (CMV)-Erkrankung bei immungeschwächten Patienten und zur Vorbeugung einer CMV-Erkrankung bei Patienten mit arzneimittelinduzierter Immunsuppression (z.B nach Organtransplantation oder Chemotherapie gegen Krebs)
Wirkmechanismus
Die antivirale Wirkung von Ganciclovir beruht auf dessen Hemmung der Virusreplikation. Diese hemmende Wirkung ist äußerst selektiv, da der Wirkstoff durch ein vom Virus kodiertes zelluläres Enzym, die Thymidin-Kinase (TK), in seine Wirkform umgewandelt werden muss. TK katalysiert die Phosphorylierung von Ganciclovir zum Monophosphat, das anschließend von der zellulären Guanylatkinase in das Diphosphat und von einer Reihe von zellulären Enzymen in das Triphosphat umgewandelt wird.
In vitro stoppt Ganciclovir-Triphosphat die Replikation der viralen Herpes-DNA. Bei Verwendung als Substrat für die virale DNA-Polymerase hemmt Ganciclovir-Triphosphat konkurrierend dATP, was zur Bildung von fehlerhafter DNA führt. In diesem Fall wird Ganciclovir-Triphosphat in den DNA-Strang eingebaut und ersetzt Adenosinbasen. Dies führt dazu, dass die DNA-Synthese verhindert wird, da keine Phosphodiesterbrücken mehr gebildet werden können und der Strang destabilisiert wird.
Pharmakokinetik
Resorption
- Ganciclovir wird nach oraler Anwendung nur schlecht systemisch resorbiert.
- Die Bioverfügbarkeit beträgt unter nüchternen Bedingungen etwa 5% und nach Verabreichung mit Nahrung 6 bis 9% (etwa 30% nach einer fettreichen Mahlzeit).
Verteilung
- Das Verteilungsvolumen wird mit 0,74 ± 0,15 L/kg angegeben.
- Die Proteinbindung beträgt 1 bis 2%.
Metabolisierung
- Es findet nur eine geringe bis keine Metabolisierung statt.
- Etwa 90% Ganciclovir werden unverändert mit dem Urin ausgeschieden.
Elimination
- Die renale Ausscheidung des unveränderten Arzneimittels durch glomeruläre Filtration und aktive tubuläre Sekretion ist der Hauptausscheidungsweg von Ganciclovir.
- Die Halbwertszeit beträgt 2,5 bis 3,6 Stunden (Mittelwert 2,9 Stunden) bei intravenöser Verabreichung an Erwachsenen.
- Bei intravenöser Applikation wird die Halbwertszeit mit 3,1 bis 5,5 Stunden angegeben.
- Eine Beeinträchtigung der Nierenfunktion führt zu einer deutlichen Verlängerung der Halbwertszeit (9 bis 30 Stunden intravenös;15,7 bis 18,2 Stunden oral).
Dosierung
CMV-Erkrankung bei Erwachsenen und Jugendlichen im Alter ab 12 Jahren mit normaler Nierenfunktion
- Initialdosis: 5 mg/kg angewendet über eine Stunde als intravenöse Infusion, alle 12 Stunden für eine Dauer von 14-21 Tagen
- Erhaltungsdosis: 5 mg/kg über eine Stunde als intravenöse Infusion, einmal täglich an 7 Tagen pro Woche oder 6 mg/kg einmal täglich an 5 Tagen pro Woche.
- Prophylaxe: 5 mg/kg angewendet über eine Stunde als intravenöse Infusion, einmal täglich an 7 Tagen pro Woche oder 6 mg/kg einmal täglich an 5 Tagen pro Woche. Die Dauer der Prophylaxe richtet sich nach dem Risiko einer CMV-Erkrankung.
- Präemptive Therapie: Initialdosis: 5 mg/kg angewendet über eine Stunde als intravenöse Infusion, alle 12 Stunden für eine Dauer von 7-14 Tagen.
Herpessimplex-Keratitis
- 5-mal täglich 1 Tropfen Virgan Augengel bis zur vollständigen Reepithelisierung der Cornea.
- Anschließend 3-mal täglich 1 Tropfen über 7 Tage.
- Die Behandlung dauert im Allgemeinen nicht länger als 21 Tage.
Nebenwirkungen
Die schwersten und häufigsten Nebenwirkungen unter systemischer Anwendung von Ganciclovir sind:
- Neutropenie
- Anämie
- Thrombozytopenie
Bei der Anwendung am Auge kommt es sehr häufig zu:
- Vorübergehendem Gefühl von Brennen oder Stechen
- einer Reizung des Auges
- Verschwommensehen
Wechselwirkungen
Mit folgenden Verbindungen kann es bei gleichzeitiger Anwendung mit Ganciclovir zu Wechselwirkungen kommen:
- Probenecid: statistisch signifikant reduzierte renale Clearance von Ganciclovir sowie klinisch signifikant höhere Exposition.
- Didanosin: Plasmakonzentrationen von Didanosin wird bei gleichzeitiger Anwendung durchgängig erhöht.
- Imipenem-Cilastatin: Bei gleichzeitiger Anwendung von Ganciclovir mit Imipenem-Cilastatin wurden Krampfanfälle berichtet.
-
Myelosuppressive Wirkstoffe: Die Toxizität kann erhöht sein, wenn Ganciclovir gleichzeitig mit anderen Wirkstoffen angewendet wird, die myelosuppressiv
sind oder mit einer Nierenfunktionsstörung in Verbindung stehen (wie z. B. Dapson, Pentamidin, Flucytosin, Vincristin, Vinblastin, Doxorubicin, Amphotericin B, Mycophenolatmofetil, Trimethoprim/Sulfamethoxazol, Hydroxyharnstoff) sowie Nukleosidanaloga (einschließlich Zidovudin).
Kontraindikationen
Ganciclovir darf nicht angewendet werden bei:
- Überempfindlichkeit gegenüber Ganciclovir oder Aciclovir
- Stillzeit (bei oraler Anwendung)
Schwangerschaft
In Tierstudien wurden nach oraler und intravenöser Gabe von Ganciclovir Anzeichen einer Teratogenität und Auswirkungen auf die Fertilität beobachtet. Ganciclovir zeigte außerdem ein genotoxisches
Potenzial bei geringer therapeutischer Breite. Aus diesen Gründen wird die Anwendung während der Schwangerschaft und Stillzeit nicht empfohlen, es sei denn, es gibt keine alternative Behandlung.
Frauen im gebärfähigen Alter müssen bei der Anwendung von Ganciclovir geeignete Maßnahmen zur Empfängnisverhütung anwenden.
Stillzeit
Es ist nicht bekannt, ob Ganciclovir in die Muttermilch übertritt. Die Möglichkeit, dass Ganciclovir in die Muttermilch übertritt und bei gestillten Säuglingen schwerwiegende Nebenwirkungen auslöst, kann
nicht ausgeschlossen werden. Das Stillen muss während der Behandlung mit Ganciclovir unterbrochen werden.
Verkehrstüchtigkeit
Bei systemischer Verabreichung kann Ganciclovir die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen wesentlich beeinflussen. Bei der Anwendung am Auge kann durch das Auftreten von Sehstörungen die Verkehrstüchtigkeit beeinträchtigt sein.
Wirkstoff-Informationen
- Fachinformation Ganciclovir HEXAL
- Fachinformation VIRGAN 1,5 mg/g Augengel
- DrugBank; Ganciclovir, abgerufen am 07.02.2023
-
Cymeven® i.v., 500 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Cheplapharm Arzneimittel GmbH
-
Cymevene i.v., 500 mg Emra Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Emra-Med Arzneimittel GmbH
-
Ganciclovir Accord 500 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Accord Healthcare GmbH
-
Ganciclovir HEXAL® 500 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Hexal AG
-
Virgan® 1,5 mg/g Augengel
Thea Pharma GmbH











