Glasdegib
Der Wirkstoff Glasdegib wird in Kombination mit Cytarabin zur Behandlung der akuten myeloischen Leukämie angewendet und gehört zur Wirkstoffgruppe der Hedgehog-Signalweg-Inhibitoren. In der Zulassungsstudie führte das Arzneimittel zu einer 49 prozentigen Reduktion des Sterberisikos verglichen zur Monotherapie mit Cytarabin.
Glasdegib : Übersicht
Anwendung
Glasdegib (Daurismo) wird in Kombination mit niedrig dosiertem Cytarabin angewendet zur Behandlung von neu diagnostizierter oder sekundärer akuter myeloischer Leukämie (AML), wenn die Patienten für eine Standard-Induktionschemotherapie nicht infrage kommen. Es handelt sich bei den Krankheitsbildern um genetisch heterogene myeloische Stammzellstörungen, die im Median mit etwa 67 Jahren auftreten.
Anwendungsart
Glasdegib ist für die orale Anwendung bestimmt und in Form von Filmtabletten unter dem Handelsnamen Daurismo zugelassen, die unabhängig von den Mahlzeiten eingenommen werden können. Patienten sollte empfohlen werden, die Tabletten jeden Tag etwa zur gleichen Uhrzeit einzunehmen.
Wirkmechanismus
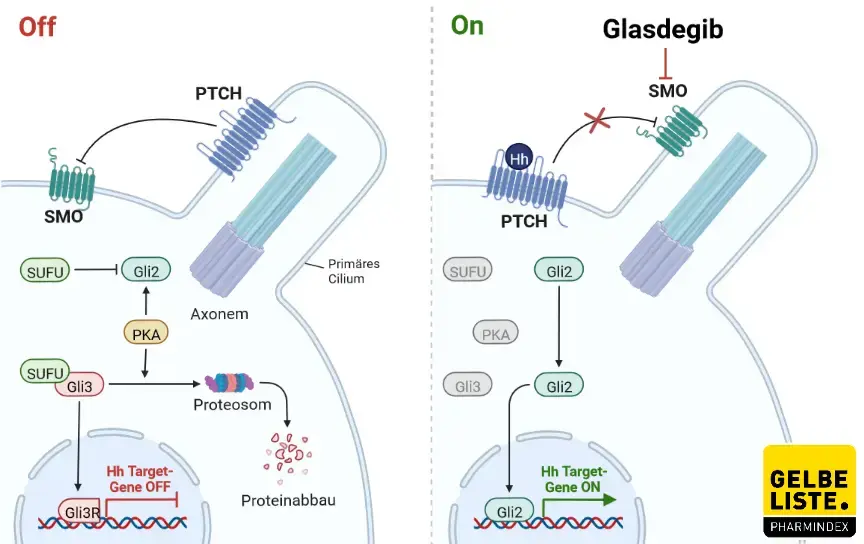
Glasdegib gehört wie auch Sonidegib und Vismodegib zur Wirkstoffgruppe der Hedgehog-Signalweg-Inhibitoren. Glasdegib ist ein Inhibitor des Hedgehog-Signalwegs, indem der Wirkstoff an den Smoothend-Rezeptor (Smo) bindet, der den Hedgehog-Signalweg auslöst.
Der Hedgehog-Signalweg ist ein Signaltransduktionsweg, der eine wichtige Funktion bei der Embryonalentwicklung einnimmt. Seine Aktivierung erfolgt durch Bindung des Hedgehog-Proteins an den Rezeptor namens Patched (Ptch), wodurch das Transmembranprotein Smo ein Signal ins Zellinnere weiterleitet, welches die Degradation des regulatorischen Proteins Ci (Cubitus interruptus) inhibiert. Ohne Einwirken von Hedgehog wird Ci in einem größeren Proteinkomplex, der aus dem Protein Costal, der Serin-Threonin-Kinase Fused (Fu) und dem Inhibitor von Fused besteht, abgebaut.
Die Aktivierung durch Hedgehog führt schließlich dazu, dass das Protein Ci nicht mehr abgebaut werden kann und deshalb in den Zellkern gelangt. Dies führt zu einer Reduktion der Aktivität des GLI-Transkriptionsfaktors (Glioma-Associated Oncogene) in AML-Zellen, wodurch das Leukämie-verursachende Potenzial von AML-Zellen verringert wird.
Pharmakokinetik
Resorption
Die Einnahme von 100 mg Glasdegib führt rasch zur Plasma-Spitzenkonzentration mit einer medianen Tmax von 2 Stunden. Bis zum Erreichen des Steady-State variierte die mediane Tmax für Glasdegib zwischen etwa 1,3 Stunden und 1,8 Stunden nach wiederholter Gabe von 100 mg einmal täglich. Auswirkungen von Nahrungsmitteln auf die Pharmakokinetik von Glasdegib werden als nicht klinisch relevant eingestuft, weshalb der Wirkstoff mit einer Mahlzeit oder unabhängig von den Mahlzeiten eingenommen werden kann. Nach einer Dosierung von 100 mg Glasdegib einmal täglich betrug der Mittelwert (Variationskoeffizient, %VK) für die Cmax von Glasdegib 1.252 ng/ml (44%) und die AUCtau17.210 ng×hr/ml (54%) bei Krebspatienten.
Verteilung
In vitro bindet Glasdegib zu 91% an menschliche Plasmaproteine. Der Mittelwert (%VK) des apparenten Verteilungsvolumens (Vz/F) lag bei Patienten mit hämatologischen Malignomen nach einer Einzeldosis von 100 mg Glasdegib bei 188 (20) l.
Biotransformation
Der primäre Stoffwechselweg für Glasdegib besteht aus:
- N-Demethylierung
- Glucuronidierung
- Oxidierung
- Dehydrogenierung
Im Plasma waren N-Desmethyl- und N-Glucuronid-Metaboliten von Glasdegib für 7,9% bzw. 7,2% der zirkulierenden Radioaktivität verantwortlich. Andere Metaboliten im Plasma machten jeweils < 5% der zirkulierenden Radioaktivität aus.
Elimination
Die mittlere (± SD) Halbwertszeit im Plasma von Glasdegib betrug nach Einnahme einer Einzeldosis von 100 mg Glasdegib 17,4 ± 3,7 Stunden. Nach Mehrfachdosierung betrug das geometrische Mittel der oralen Clearance 6,45 l/Std. Bei gesunden Probanden wurden durchschnittlich 48,9 % bzw. 41,7 % der radioaktiv markierten Dosis in Urin und Fäzes wiedergefunden. Die mittlere Massenbilanz der dosierten Radioaktivität in den Exkrementen betrug insgesamt 90,6 %. Unverändertes Glasdegib war der Hauptbestandteil in menschlichem Plasma und machte 69,4% des wirkstoffbezogenen Gesamtmaterials aus. Unverändertes Glasdegib in Urin und Fäzes machte jeweils 17,2 % bzw. 19,5 % der Dosis aus.
Linearität/ Nicht-Linearität
Im Dosisbereich von 5 mg bis 600 mg einmal täglich erhöhte sich die systemische Glasdegib-Exposition im Steady-State (Cmax und AUCtau) in dosisabhängiger Weise.
Dosierung
Die empfohlene Dosis beträgt einmal täglich 100 mg Glasdegib in Kombination mit niedrig dosiertem Cytarabin (20 mg s.c) an den Tagen 1 bis 10.
Nebenwirkungen
Die am häufigsten (≥ 20%) gemeldeten Nebenwirkungen unter Glasdegib waren in Studien:
- Anämie (45,2%), Blutungen (45,2%)
- febrile Neutropenie (35,7%)
- Übelkeit (35,7%), verminderter Appetit (33,3%)
- Fatigue (30,9%)
- Muskelspasmen (30,9%)
- Thrombozytopenie (30,9%)
- Pyrexie (29,7%)
- Diarrhoe (28,5%)
- Pneumonie (28,5%)
- Dysgeusie (26,1%)
- peripheres Ödem (26,1%)
- Obstipation (25,0%), Abdominalschmerz (25,0%)
- Ausschlag (25,0%)
- Dyspnoe (25,0%)
- Erbrechen (21,4%) und Gewichtsabnahme (20,2%)
Wechselwirkungen
Glasdegib wird größtenteils durch CYP3A4 metabolisiert; CYP2C8 und UGT1A9 spielen bei der Metabolisierung eine untergeordnete Rolle.
Bei einer gleichzeitigen Anwendung mit starken CYP3A4-Inhibitoren wie z. B. Boceprevir, Cobicistat, Conivaptan, Itraconazol, Ketoconazol, Posaconazol, Telaprevir, Troleandomycin, Voriconazol, Ritonavir, Grapefruit oder Grapefruitsaft sowie mäßig starken CYP3A4-Induktoren wie z. B. Bosentan, Efavirenz, Etravirin, Modafinil, Nafcillin ist Vorsicht geboten, da es zu einer erhöhten Plasmakonzentration von Glasdegib kommen kann.
Dementsprechend kann die gleichzeitige Gabe starker CYP3A4-Induktoren wie z. B. Rifampicin, Carbamazepin, Enzalutamid, Mitotan, Phenytoin und Johanniskraut zu einer Reduktion der Plasmakonzentration von Glasdegib führen.
Da Glasdegib zu einer Verlängerung des QT-Intervalls führen kann, ist Vorsicht geboten bei der gleichzeitigen Anwendung anderer QT-Intervall verlängernden Arzneimitteln.
Glasdegib ist vermutlich weiterhin in der Lage den über P-Glykoprotein (P-gp) und Breast Cancer Resistance Protein (BCRP) vermittelten Arzneistofftransport zu hemmen kann. P-gp- oder BCRP-Substrate mit enger therapeutischer Breite (z. B. Digoxin) sollten somit bei einer Kombination mit Glasdegib mit Vorsicht angewendet werden.
Weiterhin zeigen in-vitro-Studien, dass Glasdegib in klinisch relevanten Konzentrationen zu einer Hemmung von MATE1 und MATE2K führen kann.
Kontraindikationen
Glasdegib darf nicht angewendet werden bei bekannter Überempfindlichkeit gegen den Wirkstoff.
Schwangerschaft
Es liegen keine Daten zur Anwendung von Glasdegib bei Schwangeren vor. Aufgrund des Wirkmechanismus und gemäß Erkenntnissen aus Toxizitätsstudien zur embryofetalen Entwicklung bei Tieren kann Glasdegib allerdings bei Verabreichung an Schwangere dem Fetus schaden. Der Wirkstoff sollte deshalb bei Schwangeren und gebärfähigen Frauen, die nicht verhüten, nicht angewendet werden.
Stillzeit
Es wurden keine Studien an Menschen zur Untersuchung der Auswirkungen von Glasdegib auf die Milchproduktion, den Übergang in die Muttermilch oder die Auswirkungen auf das gestillte Kind durchgeführt. Es ist nicht bekannt, ob Glasdegib und seine Metaboliten beim Menschen in die Muttermilch übergehen. In Anbetracht möglicher schwerwiegender Nebenwirkungen bei gestillten Kindern durch Glasdegib, wird das Stillen während der Behandlung und mindestens eine Woche lang nach der letzten Anwendung nicht empfohlen.
Verkehrstüchtigkeit
Glasdegib kann Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben, da bei der Anwendung Symptome wie z. B. Muskelkrämpfen, Schmerzen oder Übelkeit mit Auswirkungen auf die normale Reaktionsfähigkeit auftreten können.
Studienlage
Die Zulassung von Glasdegib (Daurismo) durch die Europäische Kommission basiert auf den Ergebnissen der klinischen Phase-II-Studie BRIGHT 1003, in der die Wirksamkeit von Glasdegib plus niedrig dosiertem Cytarabin bei Patienten mit akuter myeloischer Leukämie oder myelodysplastischem Syndrom untersucht wurde. Glasdegib (100 mg) wurde kontinuierlich über 28 Tage verabreicht; Cytarabin (20 mg) wurde an Tag 1 bis 10 der 28 Tage gegeben. Die Patienten wurden 2:1 randomisiert und erhielten entweder Glasdegib in Kombination mit Cytarabin (88 Patienten) oder Cytarabin alleine (44 Patienten). Primärer Endpunkt stellte das Gesamtüberleben dar.
Ergebnisse
Das mediane Gesamtüberleben (80% Konfidenzintervall [CI]) betrug 8,8 (6,9–9,9) Monate unter Glasdegib / Cytarabin und 4,9 (3,5–6,0) Monate unter Cytarabin Monotherapie (Hazard Ratio, 0,51; 80% CI, 0,39–0,67, P = 0,0004). Daurismo führte somit fast zu einer Verdopplung der medianen Gesamtüberlebenszeit.
Eine vollständige Remission wurde bei 15 (17,0%) Patienten unter Glasdegib / Cytarabin und bei einem (2,3%) Patienten unter Cytarabin Monotherapie erreicht (P <0,05).
Zu den nicht hämatologischen unerwünschten Ereignissen vom Grad 3/4 gehörten unter Glasdegib / Cytarabin Lungenentzündung (16,7%) und Müdigkeit (14,3%) und unter Cytarabin Lungenentzündung (14,6%).
Alternativen
Die Therapiealternativen richten sich nach dem jeweiligen Indikationsgebiet und sind darüber hinaus abhängig von patientenindividuellen Faktoren wie dem Alter der Patienten, Komorbiditäten oder dem Schweregrad der Erkrankung. Zusätzlich sollte das Mutationsprofil berücksichtigt werden.
Topische Therapie
- Imiquimod
- 5-Fluorouracil (5-FU)
- Ingenolmebutat
- Photodynamische Therapie (PDT) mit 5-Aminolävulinsäure (5-ALA) und dem Ester Methyl-Aminolävulinat (MAL)
- Kryochirurgie
- Laser
Systemische Therapie
- Andere Hedgehog-Inhibitoren wie Sonidegib oder Vismodegib
- Elektrochemotherapie mit Bleomycin
- Immuncheckpoint-Inhibitoren wie Anti-PD1-Antikörper (Cemiplimab)
- Leukemia: Randomized comparison of low dose cytarabine with or without glasdegib in patients with newly diagnosed acute myeloid leukemia or high-risk myelodysplastic syndrome
- Fachinformation Daurismo
Abbildung
Created with Biorender











