Ipilimumab
Ipilimumab ist ein humaner monoklonaler Antikörper der Immunglobulin G1 (IgG1)-Klasse, der zur Behandlung von fortgeschrittenen Melanomen zugelassen ist.
Ipilimumab: Übersicht
Anwendung
Der Checkpoint-Inhibitor Ipilimumab (Yervoy) ist zur Behandlung folgender Erkrankungen indiziert:
- Melanom als Monotherapie oder in Kombination mit Nivolumab
- Nierenzellkarzinom in Kombination mit Nivolumab für die Erstlinientherapie bei Erwachsenen mit intermediärem/ungünstigem Risikoprofil
- Nicht-kleinzelliges Lungenkarzinom (non-small cell lung cancer, NSCLC) in Kombination mit Nivolumab und zwei Zyklen platinbasierter Chemotherapie für die Erstlinientherapie bei Erwachsenen, deren Tumoren keine sensitivierende EGFR-Mutation oder ALK-Translokation aufweisen.
- Malignes Pleuramesotheliom (MPM) in Kombination mit Nivolumab für die Erstlinientherapie.
- Metastasiertes Kolorektalkarzinom (colorectal cancer, CRC) mit Mismatch-Reparatur-Defizienz (Mismatch repair deficient, dMMR) oder hoher Mikrosatelliteninstabilität (microsatellite instability high, MSI-H) in Kombination mit Nivolumab nach vorheriger fluoropyrimidinbasierter Kombinationschemotherapie.
Wirkmechanismus
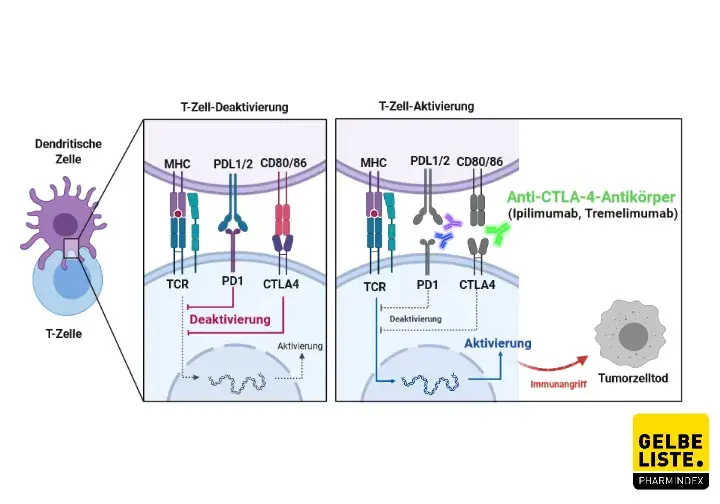
Auf der Oberfläche von T-Helferzellen, zytotoxischen T-Zellen und regulatorischen T-Zellen wird CTLA-4 (Cytotoxic T-Lymphocyte Antigen-4), ein wichtiger Regulator des Immunsystems, exprimiert. Ipilimumab ist ein CTLA-4-Immun-Checkpoint-Inhibitor, der die vom CTLA-4-Signalweg induzierten inhibitorischen Signale auf die T-Zellen blockiert. Dadurch erhöht sich die Anzahl der Tumor-reaktiven T-Effektorzellen, die den Tumor im Folgenden direkt attackieren können.
Eine CTLA-4-Blockade kann außerdem zu einer verminderten regulatorischen T-Zellfunktion führen. Dies kann eine Erhöhung der Anti-Tumor-Immunantwort bewirken. Durch selektive Depletion von regulatorischen T-Zellen kann Ipilimumab das Verhältnis von intratumoralen T-Effektorzellen zu regulatorischen T-Zellen in der Tumorumgebung erhöhen. Das Absterben von Tumorzellen wird dadurch begünstigt.
Pharmakokinetik
Cmin und AUC verhielten sich bei Ipilimumab innerhalb des untersuchten Dosisbereichs (0,3 und 10 mg/kg, alle 3 Wochen für 4 Dosen) proportional zur Dosis. Bei wiederholter Gabe (alle 3 Wochen) war die Clearance zeitinvariant, und es wurde nur eine minimale systemische Akkumulation beobachtet. Mit der dritten Dosis wurde der Steady-State-Level von Ipilimumab erreicht. Das Verteilungsvolumen im Steady-State betrug 7,47 l und die Eliminationshalbwertzeit 15,4 Tage.
Die Clearance von Ipilimumab stieg mit höherem Körpergewicht und höherer LDH vor Therapiebeginn an. Bei einer Verabreichung auf mg/kg-Basis ist jedoch bei erhöhten LDH-Werten oder höherem Körpergewicht keine Anpassung der Dosis erforderlich. Weitere Faktoren wie z.B. Alter (zwischen 23 - 88 Jahren), Geschlecht, leicht eingeschränkte Leber- bzw. Nierenfunktion, gleichzeitiger Einsatz von Budesonid oder Dacarbazin, und frühere Tumortherapie hatten keinen Einfluss auf die Clearance.
Es existieren nur begrenzt Daten bezüglich schwer eingeschränkter Nieren- oder Leberfunktion und Aussagen über eine eventuell erforderliche Dosisanpassung sind zum jetzigen Zeitpunkt nicht möglich.
Nebenwirkungen
In klinischen Studien wurde eine Vielzahl von Nebenwirkungen beobachtet. Am häufigsten war Ipilimumab mit immunvermittelten Nebenwirkungen assoziiert, welche aus einer erhöhten Immunaktivität resultierten. Immunvermittelte Nebenwirkungen, die schwerwiegend bis lebensbedrohlich sein können, können Verdauungstrakt, Leber, Haut, Nervensystem, endokrines System oder andere Organsysteme betreffen. Die meisten dieser Nebenwirkungen (inklusive schwerwiegende Ereignisse) klangen nach Einleitung einer geeigneten Therapie oder Abbruch der Behandlung mit Ipilimumab wieder ab.
Sehr häufig (≥ 1/10) kann es bei der Anwendung zu folgenden nebenwirkungen kommen:
- Diarrhö
- Ausschlag
- Pruritus
- Müdigkeit
- Übelkeit
- Erbrechen
- verminderter Appetit
- Reaktionen an der Injektionsstelle und Pyrexie
Wechselwirkungen
Ipilimumab ist ein Antikörper, der nicht mithilfe von Cytochrom-P450-Enzymen (CYPs) oder anderen Enzymen des Arzneimittelmetabolismus abgebaut wird. In Wechselwirkungsstudien (z.B. mit CYP-Isoenzymen) wurden keine klinisch relevanten pharmakokinetischen Arzneimittelwechselwirkungen beobachtet.
Kortikosteroide und Immunsuppressiva
Systemische Kortikoide können die pharmakodynamische Aktivität und Wirksamkeit von Ipilimumab beeinträchtigen. Deren Verwendung sollte vor Behandlungsbeginn mit Ipilimumab vermieden werden. Nach dem Beginn der Ipilimumab-Therapie können systemische Kortikosteroide oder andere Immunsuppressiva jedoch eingesetzt werden, um immunvermittelte Nebenwirkungen zu behandeln.
Antikoagulanzien
Patienten, bei denen eine gleichzeitige antikoagulative Behandlung nötig ist, sollten engmaschig überwacht werden, da das Risiko von Gastrointestinalblutungen durch Antikoagulantien erhöht wird.
Kontraindikation
Gegenanzeigen sind Überempfindlichkeit gegen den Wirkstoff Ipilimumab oder einen der sonstigen Bestandteile der Arzneizubereitung.
Schwangerschaft
Zur Anwendung bei Schwangeren liegen keine Daten vor und das potentielle Risiko für den sich entwickelnden Fötus ist nicht bekannt. In tierexperimentellen Studien wurde Reproduktionstoxizität nachgewiesen. Die Anwendung von Ipilimumab in der Schwangerschaft und bei gebärfähigen Frauen, die nicht verhüten, wird nicht empfohlen, es sei denn, der klinische Nutzen überwiegt das potentielle Risiko.
Stillzeit
Beim Stillen sind eine signifikante systemische Exposition des Säuglings und Auswirkungen auf das gestillte Kind nicht zu erwarten. Nebenwirkungen beim Säugling können jedoch nicht ausgeschlossen werden. Daher muss unter Abwägung des Nutzens des Stillens für das Kind und des Nutzens der Behandlung für die Mutter eine Entscheidung darüber getroffen werden, ob das Stillen oder die Behandlung mit Ipilimumab unterbrochen werden soll.
Anwendungshinweise
Immunvermittelte Nebenwirkungen wurden auch Monate nach der letzten Ipilimumab-Dosis beobachtet. Solange keine andere Ursache ermittelt wurde, müssen Diarrhö, erhöhte Stuhlfrequenz, blutiger Stuhl, LFT-Erhöhungen, Hautausschlag und Endokrinopathie als immunvermittelt und als im Zusammenhang mit Ipilimumab stehend betrachtet werden. Eine frühzeitige Diagnose und adäquate Behandlung sind von entscheidender Bedeutung, um das Auftreten lebensbedrohlicher Komplikationen zu minimieren.
Anwendung bei Jugendlichen: In Anbetracht der nur begrenzt verfügbaren Daten, des beobachteten Nutzens und der Toxizität der Ipilimumab-Monotherapie bei Kindern und Jugendlichen, sollte vor Beginn einer Ipilimumab-Therapie bei Jugendlichen (ab 12 Jahren), jeder Patient sorgfältig individuell eingeschätzt werden.
Alternativen
Ipilimumab (ATC-Klasse L01XC11) gehört zu der Gruppe humaner monoklonaler Antikörper der Immunglobulin G1 (IgG1)-Klasse.
Andere Vertreter dieser Klasse sind: