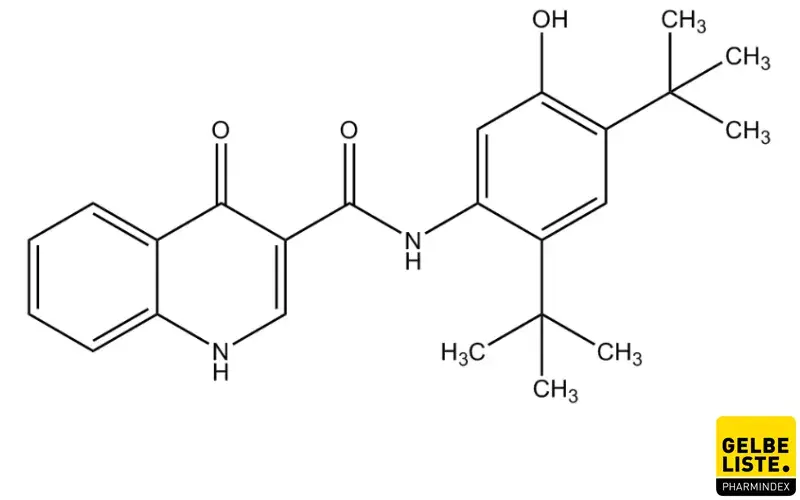
Ivacaftor
Ivacaftor wird angewendet zur Behandlung der zystischen Fibrose (CF, Mukoviszidose), die bestimmte Gating-Mutationen im CFTR-Gen aufweist. Das Medikament erhöht die Öffnungswahrscheinlichkeit von CFTR-Kanälen und fördert so den Sekretfluss. Ivacaftor ist das erste zugelassene orale Medikament zur Behandlung von Patienten mit Mukoviszidose.
Ivacaftor: Übersicht
Anwendung
Ivacaftor wird angewendet zur Behandlung von Patienten mit zystischer Fibrose (CF, Mukoviszidose), die eine der folgenden Gating-Mutationen (Klasse III) im CFTR-(Cystic Fibrosis Transmembrane Conductance Regulator)-Gen aufweisen: G551D, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N oder S549R. Das CFTR-Gen dient als Bauplan für einen Transportkanal, durch den Chlorid- und Bikarbonat-Ionen aus den Schleimhautzellen nach Außen befördert werden.
Im Rahmen einer Kombinationsbehandlung mit Tezacaftor 100 mg/Ivacaftor 150 mg-Tabletten ist der Wirkstoff indiziert zur Behandlung von Erwachsenen und Jugendlichen ab 12 Jahren mit CF, die homozygot für die F508del-Mutation sind oder heterozygot für die F508del-Mutation und eine der folgenden Mutationen im CFTR-Gen aufweisen: P67L, R117C, L206W, R352Q, A455E, D579G, 711+3A➔G, S945L, S977F, R1070W, D1152H, 2789+5G➔A, 3272-26A➔G und 3849+10kbC➔T.
Anwendungsart
Ivacaftor ist unter dem Handelsnamen Kalydeco zugelassen und für die orale Anwendung vorgesehen. Unmittelbar vor oder unmittelbar nach der Einnahme ist eine fetthaltige Mahlzeit oder Zwischenmahlzeit zu verzehren. Auf Speisen oder Getränke, die Grapefruit oder Pomeranzen enthalten, ist während der Behandlung zu verzichten.
Wirkmechanismus
Ivacaftor ist ein Potentiator des durch Mutation veränderten CFTR-Proteins. Der Wirkstoff verbessert durch seine Bindung am Kanal den Chloridionentransport durch Verstärkung der Kanalöffnungswahrscheinlichkeit (Gating) bei spezifizierten Gating-Mutationen. Die G970R-Mutation verursacht einen Spleißdefekt, durch den an der Zelloberfläche wenig bis kein CFTR-Protein ausgebildet wird.
In Deutschland ist die häufigste Mutation im CFTR-Gen die sogenannte F508del-Mutation, die dazu führt, dass in der Sequenz des CFTR-Gens ein Basen-Triplett für die Aminosäure Phenylalanin (F) an Position 508 des CFTR-Kanals fehlt. Das Protein kann durch diesen Fehler nicht richtig gefaltet werden und wird abgebaut, bevor es die Zelloberfläche erreicht.
Bei Trägern anderer Mutation befinden sich zwar CFTR-Kanäle in der Membran, die jedoch in vielen Fällen durch die Mutation in ihrer Funktion gestört sind. Ein Beispiel ist die G551D-Mutation, die zum Austausch der Aminosäure Glycin (G) durch Asparaginsäure (D) an Position 551 im CFTR-Protein führt.
Pharmakokinetik
Resorption
Nach oraler Mehrfachgabe von Ivacaftor nahm die Ivacaftor-Exposition von 25 mg alle 12 Stunden bis 450 mg alle 12 Stunden generell mit der Dosis zu. Bei Gabe mit einer fetthaltigen Mahlzeit stieg die Ivacaftor-Exposition um etwa das 2,5- bis 4-Fache an. Die AUC von Ivacaftor stieg bei kombinierter Anwendung mit Tezacaftor um etwa das 3-Fache an, wenn das Arzneimittel mit einer fetthaltigen Mahlzeit eingenommen wurde. Daher ist Ivacaftor als Monotherapie oder in einer Kombinationsbehandlung mit Tezacaftor zusammen mit einer fetthaltigen Mahlzeit einzunehmen. Die mediane (Bereich) tmax beträgt ungefähr 4,0 (3,0; 6,0) Stunden nach Nahrungsaufnahme. Der Einfluss einer Mahlzeit auf die Resorption von Ivacaftor ist bei beiden Formulierungen, d. h. Tabletten und Granulat, ähnlich.
Verteilung
Ivacaftor wird zu etwa 99% an Plasmaproteine gebunden, in erster Linie an alpha 1-saures Glycoprotein und Albumin. Ivacaftor bindet nicht an menschliche Erythrozyten. Nach oraler Gabe von Ivacaftor 150 mg alle 12 Stunden über 7 Tage an gesunde Probanden nach Nahrungsaufnahme betrug der Mittelwert (±SD) für das scheinbare Verteilungsvolumen 353 (122) l.
Nach oraler Anwendung von Ivacaftor 150 mg alle 12 Stunden in Kombination mit Tezacaftor 100 mg einmal täglich bei Patienten mit CF nach Nahrungsaufnahme betrug der Mittelwert (±SD) für das scheinbare Verteilungsvolumen von Ivacaftor 206 (82,9) l.
Biotransformation
Ivacaftor wird beim Menschen umfangreich metabolisiert. In vitro und in vivo erhobenen Daten zufolge wird Ivacaftor primär durch CYP3A metabolisiert. M1 und M6 sind beim Menschen die beiden Hauptmetaboliten von Ivacaftor. M1 besitzt ungefähr ein Sechstel der Wirkstärke von Ivacaftor und wird als pharmakologisch aktiv angesehen. M6 besitzt weniger als ein Fünfzigstel der Wirkstärke von Ivacaftor und wird nicht als pharmakologisch aktiv angesehen. Die Wirkung der potenziell reduzierten Aktivität von CYP3A4 auf die Bioverfügbarkeit von Ivacaftor bei Patienten, die Träger der CYP3A4*22-Variante sind, ist noch nicht bekannt.
Elimination
Nach oraler Gabe an gesunde Probanden wurde der größte Teil von Ivacaftor (87,8%) nach Metabolisierung mit den Fäzes eliminiert. Die Hauptmetaboliten M1 und M6 machten ungefähr 65% der eliminierten Gesamtdosis aus, und zwar 22% als M1 und 43% als M6. Ivacaftor wurde in vernachlässigbarem Umfang als unveränderte Muttersubstanz renal eliminiert. Nach Einmalgabe nach Nahrungsaufnahme betrug die scheinbare terminale Halbwertszeit ungefähr 12 Stunden. Die scheinbare Clearance (CL/F) von Ivacaftor war bei gesunden Probanden und CF-Patienten vergleichbar. Der CL/F-Mittelwert (±SD) für eine Einzeldosis von 150 mg bei gesunden Probanden betrug 17,3 (8,4) l/h. Nach oraler Gabe von Ivacaftor 150 mg alle 12 Stunden in Kombination mit Tezacaftor 100 mg einmal täglich bei Patienten mit CF nach Nahrungsaufnahme betrug der Mittelwert (±SD) für die scheinbare Clearance von Ivacaftor 15,7 (6,38) l/Stunde. Nach Steady-State-Gabe von Ivacaftor in Kombination mit Tezacaftor bei CF-Patienten betrug die mittlere (±SD) terminale Halbwertszeit von Ivacaftor ungefähr 9,3 (1,7) Stunden.
Linearität/Nicht-Linearität
Die Pharmakokinetik von Ivacaftor ist in Bezug auf die Zeit bzw. den Dosisbereich von 25 mg bis 250 mg im Allgemeinen linear.
Dosierung
Für Ivacaftor bestehen folgende Dosierungsempfehlungen:
| Körpergewicht | Einzeldosis | Tagesgesamtdosis |
| ≥ 5 kg bis < 7 kg | 25 mg oral alle 12 Stunden | 50 mg |
| ≥ 7 kg bis < 14 kg | 50 mg oral alle 12 Stunden | 100 mg |
| ≥ 14 kg bis < 25 kg | 75 mg oral alle 12 Stunden | 150 mg |
| Kindern ab 6 Jahren mit einem Körpergewicht von mindestens 25 kg | 150 mg oral alle 12 Stunden | 300 mg |
Bei gleichzeitiger Anwendung mit starken oder mäßigen CYP3A-Inhibitoren ist die Dosis gemäß der jeweiligen Fachinformation zu reduzieren
Nebenwirkungen
Die häufigsten Nebenwirkungen, die bei Patienten ab 6 Jahren unter Ivacaftor in den gepoolten 48-wöchigen placebokontrollierten Phase-III-Studien mit einer Inzidenz auftraten, die mindestens 3% und bis zu 9% höher war als im Placeboarm, waren:
- Kopfschmerzen (23,9%)
- oropharyngeale Schmerzen (22,0%)
- Infektion der oberen Atemwege (22,0%)
- verstopfte Nase (20,2%)
- Bauchschmerzen (15,6%)
- Nasopharyngitis (14,7%)
- Diarrhoe (12,8%)
- Schwindel (9,2%)
- Hautausschlag (12,8%)
- Bakterien im Sputum (12,8%)
Transaminasenanstiege traten bei 12,8% der mit Ivacaftor behandelten Patienten versus 11,5% der mit Placebo behandelten Patienten auf.
Bei Kindern zwischen 2 und weniger als 6 Jahren waren die häufigsten Nebenwirkungen:
- verstopfte Nase (26,5%)
- Infektion der oberen Atemwege (23,5%)
- Transaminasenanstiege (14,7%)
- Hautausschlag (11,8%)
- Bakterien im Sputum (11,8%)
Zu den schwerwiegenden Nebenwirkungen bei den mit Ivacaftor behandelten Patienten gehörten Bauchschmerzen und Transaminasenanstiege.
Wechselwirkungen
Unter der Anwendung von Ivacaftor können bei gleichzeitiger Anwendung mit folgenden Verbindungen Wechselwirkungen auftreten:
- CYP3A-Induktoren wie Rifampicin, Rifabutin, Phenobarbital, Carbamazepin, Phenytoin und Johanniskraut (Hypericum perforatum): Da Ivacaftor ein Substrat von CYP3A4 und CYP3A5 ist , kann es bei gleichzeitiger Anwendung zu einer Abnahme der Bioverfügbarkeit von Ivacaftor kommen.
- CYP3A-Inhibitoren wie Ketoconazol, Itraconazol, Posaconazol, Voriconazol, Grapefruitsaft, Telithromycin und Clarithromycin: Bei gleichzeitiger Anwendung kann es zu einer erhöhten Bioverfügbarkeit von Ivacaftor kommen.
- Substrate von CYP2C9 und/ oder P-gp und/oder CYP3A: Ivacaftor kann die systemische Bioverfügbarkeit dieser Arzneimitteln erhöhen, wodurch deren therapeutische Wirkung und Nebenwirkungen sich verstärken oder länger andauern können.
- CYP2C9-Substrate: Ivacaftor kann CYP2C9 hemmen. Daher wird eine Überwachung des International Normalised Ratio (INR) während der gleichzeitigen Anwendung von Warfarin empfohlen. Andere Arzneimittel, bei denen es zu einer höheren Bioverfügbarkeit kommen kann, sind Glimepirid und Glipizid; diese Arzneimittel sind mit Vorsicht anzuwenden.
- Digoxin und andere P-gp-Substrate wie Ciclosporin, Everolimus, Sirolimus oder Tacrolimus: Die gleichzeitige Anwendung kann die systemische Bioverfügbarkeit von Arzneimitteln, die sensitive Substrate von P-gp sind, erhöhen, wodurch ihre therapeutische Wirkung sowie ihre Nebenwirkungen verstärkt oder länger anhaltend auftreten können.
Kontraindikation
Ivacaftor darf nicht angewendet werden bei bekannter Überempfindlichkeit gegen den Wirkstoff.
Schwangerschaft/Stillzeit
Bisher liegen keine oder nur sehr begrenzte Erfahrungen (weniger als 300 Schwangerschaftsausgänge) mit der Anwendung von Ivacaftor bei Schwangeren vor. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität. Aus Vorsichtsgründen soll eine Anwendung während der Schwangerschaft jedoch vermieden werden.
Stillzeit
Es ist nicht bekannt, ob Ivacaftor und/oder seine Metaboliten beim Menschen in die Muttermilch übergehen. Die zur Verfügung stehenden pharmakokinetischen Daten vom Tier zeigten, dass Ivacaftor in die Milch von laktierenden weiblichen Ratten ausgeschieden wird. Daher kann ein Risiko für Neugeborene/Kinder nicht ausgeschlossen werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Ivacaftor verzichtet werden soll/die Behandlung mit Ivacaftorzu unterbrechen ist. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
Verkehrstüchtigkeit
Ivacaftor hat einen geringen Einfluss auf die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen, da es Schwindel auslösen kann.
Alternativen
Neben dem Potenziator Ivacaftor sind noch die beiden sogennanten Korrektoren Lumacaftor und Tezacaftor zugelassen. Die beiden Chaperone stabilisieren CFTR-Kanalmoleküle, denen das Phenylalanin an Position 508 fehlt. Sie verbessern deren zelluläre Verarbeitung sowie Transportsteuerung und erhöhen so die Menge an funktionellem CFTR an der Zelloberfläche. Die beiden Wirkstoffe sind mit Ivacaftor fix kombiniert, wodurch den Kanälen, die die Membran erreicht haben, ermöglicht wird, zusätzlich durch den Potenziator Ivacaftor häufiger geöffnet zu werden. Lumacaftor/Ivacaftor wurde im Jahr 2015 als Orkambi® und Tezacaftor/Ivacaftor im Jahr 2018 als Symkevi® zugelassen. Seit 2020 ist außerdem Kaftrio, eine Kombination aus Tezacaftor, Elexacaftor und Ivacaftor in Deutschland zugelassen.
Wirkstoff-Informationen
- Fachinformation Kalydeco
- GBA: Dossier zur Nutzenbewertunggemäß § 35a SGB V
-
Kaftrio 37,5 mg/25 mg/50 mg Filmtabletten
Vertex Pharmaceuticals (Germany) GmbH
-
Kaftrio 60 mg/40 mg/80 mg Granulat im Beutel
Vertex Pharmaceuticals (Germany) GmbH
-
Kaftrio 75 mg/50 mg/100 mg Filmtabletten
Vertex Pharmaceuticals (Germany) GmbH
-
Kaftrio 75 mg/50 mg/100 mg Granulat im Beutel
Vertex Pharmaceuticals (Germany) GmbH
-
Kalydeco 13,4 mg Granulat im Beutel
Vertex Pharmaceuticals (Germany) GmbH
-
Kalydeco 25 mg Granulat im Beutel
Vertex Pharmaceuticals (Germany) GmbH
-
Kalydeco 50 mg Granulat im Beutel
Vertex Pharmaceuticals (Germany) GmbH
-
Kalydeco 59,5 mg Granulat im Beutel
Vertex Pharmaceuticals (Germany) GmbH
-
Kalydeco 75 mg Filmtabletten
Vertex Pharmaceuticals (Germany) GmbH
-
Kalydeco 75 mg Granulat im Beutel
Vertex Pharmaceuticals (Germany) GmbH
-
Kalydeco 150 mg Filmtabletten
Vertex Pharmaceuticals (Germany) GmbH
-
Orkambi® 75 mg/94 mg Granulat im Beutel
Vertex Pharmaceuticals (Germany) GmbH
-
Orkambi® 100 mg/125 mg Filmtabletten
Vertex Pharmaceuticals (Germany) GmbH
-
Orkambi® 100 mg/125 mg Granulat im Beutel
Vertex Pharmaceuticals (Germany) GmbH
-
Orkambi® 150 mg/188 mg Granulat im Beutel
Vertex Pharmaceuticals (Germany) GmbH
-
Orkambi® 200 mg/125 mg Filmtabletten
Vertex Pharmaceuticals (Germany) GmbH
-
Symkevi 50 mg/75 mg Filmtabletten
Vertex Pharmaceuticals (Germany) GmbH
-
Symkevi 100 mg/150 mg Filmtabletten
Vertex Pharmaceuticals (Germany) GmbH












