Ixazomib
Ixazomib ist ein Proteasom-Inhibitor, der in Kombination mit Dexamethason und Lenalidomid zur Behandlung des Multiplen Myeloms angewendet wird. Der Wirkstoff hemmt den Abbau verschiedenster Proteine und führt so über zahlreiche Effekte zur Apoptose der Myelomzellen.
Ixazomib: Übersicht
Anwendung
Ixazomib wird in Kombination mit Lenalidomid und Dexamethason zur Behandlung des Multiplen Myeloms bei Erwachsenen Patienten angewendet, die mindestens eine vorausgegangene Therapie erhalten haben.
Anwendungsart
Ixazomib wird in Form von Kapseln mit Wasser eingenommen. Die Applikation sollte immer etwa zur gleichen Zeit spätestens eine Stude vor oder frühestens zwei Stunden nach einer Mahlzeit erfolgen. Die Kapseln dürfen nicht zerbrochen, zerkaut oder geöffnet werden.
Wirkmechanismus
Ixazomib liegt als Prodrug, Ixazomibcitrat, vor und wird unter physiologischen Bedinungen rasch in die biologisch aktive Form hydolysiert. Der Wirkstoff ist ein hochgradig selektiver und reversibler Proteasom-Inhibitor. Ixazomib bindet und hemmt die Chymotrypsin-ähnlichen Aktivität der Beta-5-Untereinheit des 20S-Proteasoms.
Proteasome sind intrazelluläre Multiproteasekomplexe, die am Abbau zahlreicher Proteine beteiligt sind. Dieser Mechanismus ist essenziell für den Zyklus und das Überleben der Zellen. Die Hemmung der Proteasome führt demnach zu einer Vielzahl von Effekten.
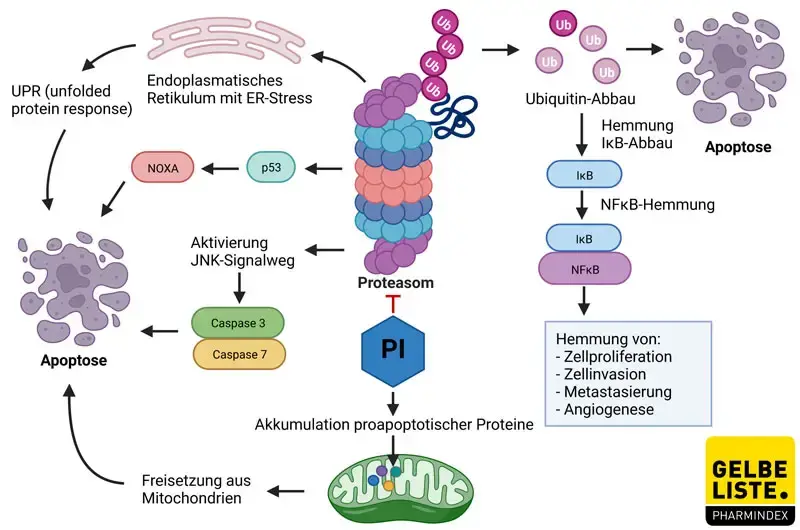
Hemmung des NFκB-Signalwegs
Ein wichtiger Mechanismus ist die Inhibition des NFκB-Signalwegs. Durch einen erhöhten Ubiquitin-Abbau bleibt das Protein IκB intakt, das NFκB bindet und dadurch hemmt. Auf diese Weise kommt es zur Downregulation verschiedener NFκB-vermittelter Mechanismen, wie der Zellproliferation, Invasion, Metastasierung und Angiogenese.
Signalwege des programmierten Zelltods
Die Proteasom-Hemmung führt außerdem zur Aktivierung der c-Jun NH2-terminalen Kinase (JNK), die über verschiedene Caspasen zum programmierten Zelltod führt. Auch das Tumorsuppressorprotein p53 wird durch Proteasom-Inhibitoren (PI) aktiviert und führt über das proapoptotische NOXA sowie Caspasen letztendlich zur Apoptose. Das gilt auch bei Anwesenheit von p53-Mutanten. NOXA kann zudem unabhängig von p53 induziert werden. Auch weitere proapoptotische Proteine (z.B. Bim, Bid, Bik), die im Normalfall durch die Proteasomen reguliert werden, akkumulieren und induzieren den Zelltod.
ER-Stress
Die Hemmung der Multiproteasekomplexe führt zu einer gesteigerten Ansammlung defekter Proteine in der Zelle. Auch die Krebserkrankung selbst kann eine erhöhte Produktion von Proteinen verursachen. Proteine werden in der Regel im Endoplasmatischen Retikulum (ER) zusammengebaut und einer Qualitätskontrolle unterzogen, falsch gefaltete Proteine werden den Proteasomen zugeführt. Bei einer zu großen Proteinmenge gerät das ER unter Stress, der bei Proteasom-Hemmung durch die Ansammlung falsch gefalteter Proteine verstärkt wird. Dies löst die sogenannte UPR (Unfolded Protein Response) aus, die einerseits die Proteinsynthese reduziert und bei starkem ER-Stress auch Apoptose auslösen kann.
Pharmakokinetik
Resorption
Die maximale Plasmakonzentration von Ixazomib wird etwa eine Stunde nach oraler Applikation erreicht. Die mittlere absolute orale Bioverfügbarkeit liegt bei 58%, die AUC steigt mit der Dosis proportional an.
Die Einnahme mit fettreicher Nahrung kann die Bioverfügbarkeit des Proteasom-Inhibitors verringern.
Verteilung (Distribution)
Ixazomib ist zu 99% an Plasmaproteine gebunden und das Verteilungsvolumen liegt im Steady State bei 543 L.
Metabolismus (Biotransformation)
Die Biotransformation von Ixazomib erfolgt sowohl über das Cytochrom-P450-Enzymsystem als auch zahlreiche Non-CYP-Proteine. In Konzentrationen, die die klinisch üblichen Mengen übersteigen, wird der Proteasom-Inhibitor von den folgenden CYP-Enzymen verstoffwechselt: CYP3A4 (42,3%), CYP1A2 (26,1%), CYP2B6 (16,0%), CYP2C8 (6,0%), CYP2D6 (4,8%), CYP2C19 (4,8%) und CYP2C9 (< 1 %).
Elimination
Die systemische Clearance von Ixazomib liegt bei etwa 1,86 l/h, schwankt jedoch sehr stark mit einer interindividuellen Variabilität von 44%. Die terminale Halbwertszeit liegt bei 9,5 Tagen. An Tag 15 wurde bei einer wöchentlichen oralen Dosis eine zweifache Akkumulation der AUC beobachtet.
Die Ausscheidung von Ixazomib erfolgt zu etwa zwei Dritteln renal und zu etwa 22% über die Fäzes. Im Urin wurden <3,5% unveränderter Wirkstoff nachgewiesen.
Dosierung
Ixazomib wird initial in einer Dosierung von 4 mg einmal wöchentlich an den Tagen 1, 8 und 15 eines 28-tägigen Behandlungszyklus eingenommen. Lenalidomid wird in einer Dosierung von 25 mg einmal täglich an den Tagen 1 bis 21 und Dexamethason in einer Dosierung von 40 mg an den Tagen 1, 8, 15 und 22 angewendet.
Verspätete/ vergessene Einnahme
Eine vergessene Dosis sollte nicht mehr eingenommen werden, wenn die nächste Dosis in 72 Stunden oder weniger geplant ist. Es sollte keine doppelte Dosis eingenommen werden, auch dann nicht, wenn ein Patienten nach der Einnahme einer Dosis erbricht.
Dosisanpassung
Bei Patienten mit mäßigen oder schweren Leberfunktionsstörungen, schweren Nierenfunktionsstörungen oder terminaler dialysepflichtiger Niereninsuffizienz wird eine reduzierte Dosis von 3 mg Ixazomib empfohlen. Diese kann je nach Zustand des Patienten und Verträglichkeit auf 2,3 mg gesenkt werden. Bei weiterer Unverträglichkeit sollte die Therapie abgebrochen werden.
Nebenwirkungen wie Thrombozytopenie, Neutropenie und Hautausschlag können sowohl unter Ixazomib als auch Lenalidomid auftreten. Daher erfolgt in solchen Fällen eine wechselnde Dosierungsanpassung gemäß der Fachinformation, beginnend mit Lenalidomid.
Tritt eine periphere Neuropathie auf oder kommt es zu weiteren nicht-hämatologischen Toxizitäten, wird Ixazomib zunächst abgesetzt. Nach Abklingen der Symptome kann die Behandlung je nach Schweregrad der Nebenwirkungen mit der gleichen oder einer niedrigeren Dosis des Wirkstoffs fortgesetzt werden.
Nebenwirkungen
Die folgenden Nebenwirkungen könnten bei der Behandlung mit Ixazomib häufig (≥1/100, <1/10) bis sehr häufig (≥ 1/10) auftreten.
- Herpes Zoster
- Infektionen der oberen Atemwege, Bronchitis
- Diarrhoe, Konstipation, Übelkeit, Erbrechen
- Thrombozytopenie, Neutropenie
- Periphere Neuropathien
- Hautausschlag
- Rückenschmerzen
- Peripheres Ödem
Die häufigsten schwerwiegenden Nebenwirkungen unter Ixazomib sind Diarrhoe (3%), Thrombozytopenie (2%) und Bronchitis (2%).
Wechselwirkungen
Ixazomib ist unter anderem ein Substrat von CYP3A4, daher wird die Anwendung mit Induktoren dieses Enzyms, wie Johanniskraut, Carbamazepin, Phenytoin und Rifampicin, nicht empfohlen.
Kontraindikationen
Ixazomib darf bei Überempfindlichkeit gegen den Wirkstoff nicht angewendet werden.
Schwangerschaft
Es liegen keine Daten zur Anwendung von Ixazomib in der Schwangerschaft vor. In Tierversuchen wurde eine Reproduktionstoxizität nachgewiesen. Aus diesem Grund wird die Anwendung von Ixazomib in der Schwangerschaft nicht empfohlen.
Außerdem ist zu beachten, dass der Proteasom-Inhibitor mit dem teratogenen Wirkstoff Lenalidomid angewendet wird, das lebensbedrohliche Missbildungen beim Fötus verursachen kann.
Stillzeit
Zum Übergang von Ixazomib in die Muttermilch liegen weder Human- noch Tierstudien vor. Da ein Risiko für den Säugling nicht ausgeschlossen werden kann und Ixazomib außerdem in Kombination mit Lenalidomid angewendet wird, soll das Stillen beendet werden.
Verkehrstüchtigkeit
In klinischen Studien wurden Müdigkeit und Schwindel unter der Behandlung mit Ixazomib beobachtet. Aus diesem Grund sollten Patienten, wenn solche Symptome während der Therapie auftreten, keine Fahrzeuge führen oder Maschinen bedienen.
Anwendungshinweise
Vor Beginn eines neuen Behandlungszyklus sollten die folgenden Parameter überprüft werden:
- Absolute Neutrophilenzahl ≥1.000/mm3
- Thrombozytenzahl ≥ 75.000/mm3
- Nicht-hämatologische Toxizitäten des Patienten nach Ermessen des Arztes entsprechen Zustand zu Behandlungsbeginn oder ≤Grad 1
Da Ixazomib ausschließlich in Kombination mit Lenalidomid und Dexamethason angewendet wird, sollten auch die Fachinformationen dieser beiden Arzneimittel beachtet werden.
Behandlungsdauer
Die Behandlung sollte fortgeführt werden, bis eine Krankheitsprogression oder eine inakzeptable Toxizität auftritt. Eine Anwendung über 24 Zyklen hinaus sollte auf einer individuellen Nutzen-Risiko-Analyse basieren.
Prophylaxe
Um das Risiko einer Herpes-zoster-Reaktivierung zu verringern, wird eine entsprechende virustatische Prophylaxe empfohlen.
Außerdem sollten Patienten, die mit der Kombinationstherapie aus Ixazomib, Lenalidomid und Dexamethason behandelt werden, basierend auf den Risikofaktoren und des klinischen Status des Patienten, eine Thromboseprophylaxe erhalten.
Überwachung
Folgende Parameter sollten während der Behandlung mit Ixazomib überwacht werden:
- Thrombozytenzahl, mindestens einmal monatlich
- Leberenzyme, regelmäßig
- Kaliumspiegel, falls schwere gastrointestinale Störungen auftreten
- Anzeichen einer peripheren Neuropathie
- Anzeichen und Symptome einer thrombotischen Mikroangiopathie
Empfängnisverhütung
Für Ixazomib im Tierversuch eine Reproduktionstoxizität nachgewiesen. Dexamethason ist ein schwacher bis mäßiger CYP3A4-Induktor und induziert auch weitere Enzyme und Transporter. Daher kann der Wirkstoff die Wirksamkeit oraler Kontrazeptiva beeinträchtigen. Bei Lenalidomid handelt es sich um eine teratogene Substanz, die zu lebensbedrohlichen Missbildungen führen kann.
Aus diesen Gründen sollten Frauen, die hormonelle Kontrazeptiva anwenden, sowie zeugungsfähige männliche Patienten unter der Behandlung mit Ixazomib und den beiden Kombinationstherapeutika zusätzlich eine Barrieremethode zur Empfängnisverhütung anwenden. Diese sollte auch noch 90 Tage nach Beendigung der Behandlung weitergeführt werden.
Alternativen
Neben Ixazomib sind die Proteasom-Inhibitoren Bortezomib und Carflizomib zur Therapie des Multiplen Myeloms zugelassen. Im Gegensatz zu Ixazomib werden die beiden anderen Wirkstoffe der Gruppe intravenös appliziert.
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
- AWMF: S3-Leitlinie Multiples Myelom (2021)
- EMA: Fachinformation Ninlaro (zuletzt aufgerufen am 11.08.2022)
- Nunes AT, Annunziata CM. Proteasome inhibitors: structure and function. Semin Oncol. 2017 Dec;44(6):377-380. DOI: 10.1053/j.seminoncol.2018.01.004
- Geisslinger, Menzel, Gundermann, Hinz, Ruth (2020) Mutschler Arzneimittelwirkungen, 11. Auflage, Wissenschaftliche Verlagsgesellschaft Stuttgart
- Steinhilber, Schubert-Zsilavecz, Roth (2010) Medizinische Chemie, 2. Auflage, Deutscher Apotheker Verlag Stuttgart
Abbildung
Created with BioRender.com
-
NINLARO® 2,3 mg Hartkapseln
Takeda GmbH
-
Ninlaro 3 mg CC Pharma Hartkapseln
CC Pharma GmbH
-
Ninlaro 3 mg Haemato-Pharm Hartkapseln
HAEMATO PHARM GmbH
-
NINLARO® 3 mg Hartkapseln
Takeda GmbH
-
Ninlaro 4 mg CC Pharma Hartkapseln
CC Pharma GmbH
-
Ninlaro 4 mg Haemato-Pharm Hartkapseln
HAEMATO PHARM GmbH
-
NINLARO® 4 mg Hartkapseln
Takeda GmbH
-
Ninlaro 4 mg kohlpharma Hartkapseln
kohlpharma GmbH
-
Ninlaro 4 mg Medicopharm Hartkapseln
Medicopharm AG
-
Ninlaro 4 mg Orifarm Hartkapseln
Orifarm GmbH












