Maraviroc
Der antiretrovirale Wirkstoff Maraviroc ist ein CCR5-Antagonist aus der Gruppe der Entry-Inhibitoren, der in Kombination mit anderen HIV-Therapeutika zur Therapie einer Infektion mit CCR5-tropen HI-Viren Typ-1 (HIV-1) eingesetzt wird.
Maraviroc: Übersicht

Anwendung
Der CCR5-Antagonist Maraviroc ist in Kombination mit anderen HIV-Therapeutika indiziert zur Therapie vorbehandelter Erwachsener, Jugendlicher und Kinder ab einem Alter von 2 Jahren und einem Körpergewicht von mindestens 10 kg, bei denen ausschließlich CCR5-trope HI-Viren Typ-1 (HIV-1) nachgewiesen wurden.
Anwendungsart
Maraviroc ist als Filmtablette (25, 75, 150, 300 mg) sowie als Lösung zum Einnehmen (20 mg/mL) erhältlich. Die Einnahme kann nahrungsunabhängig erfolgen. Die Therapie sollte nur durch einen Arzt eingeleitet werden, der in der Behandlung von HIV-Infektionen erfahren ist.
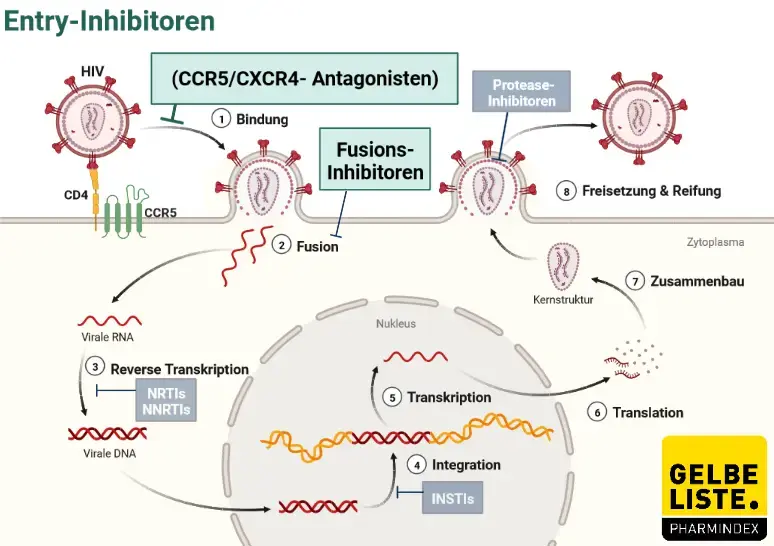
Wirkmechanismus
Maraviroc ist ein CCR5-Antagonist aus der Gruppe der Entry-Inhibitoren, die Bestandteil einer antiretroviralen Therapie (ART) sein können.
Humane Immundefizienz-Viren sind lymphotrope Lentiviren aus der Familie der Retroviren. Jedes individuelle Viruspartikel enthält zwei RNA-Stränge, die von einem Capsid-Protein (p24) und einer Lipidmembran mit Hüllproteinen (gp120, gp41) umschlossen sind.
Das Oberflächenprotein gp120 befähigt das HI-Virus, sich an das Oberflächenprotein CD4 der Zielzelle (überwiegend T-Helferzellen, aber auch Makrophagen) zu heften und unter Beteiligung von Korezeptoren (CCR5, CXCR4) auf der Zielzelle mit dieser zu fusionieren.
Maraviroc bindet selektiv an den Chemokinrezeptor CCR5 beim Menschen, wodurch das Eindringen („Entry“) des CCR5-tropen HIV-1 in die Zielzellen inhibiert wird. Gegen Viren, die CXCR4 als Korezeptor nutzen können, zeigt Maraviroc keine antivirale Aktivität (in vitro).
Pharmakokinetik
Resorption
- Die Resorption von Maraviroc ist variabel und hat mehrere Spitzenwerte.
- Die medianen Spitzenplasmakonzentrationen von Maraviroc werden bei gesunden Probanden zwei Stunden (Bereich: 0,5 bis 4 Stunden) nach oraler Einmalgabe (300 mg Tablette) erreicht (über diesen Dosisbereich verhält sich die Pharmakokinetik von oral angewendetem Maraviroc nicht dosisproportional).
- Die absolute Bioverfügbarkeit einer 100-mg-Dosis beträgt 23%, bei einer 300-mg-Dosis werden 33% geschätzt.
- Maraviroc ist ein Substrat des Efflux-Transporters P-Glykoprotein (P-gp).
- Bei Einnahme von 300 mg Maraviroc (Tablette) zusammen mit einem fettreichen Frühstück verringern sich die cmax und die AUC von Maraviroc bei gesunden Probanden um etwa 33%.
- Bei Einnahme von 75 mg Maraviroc (Lösung zum Einnehmen) zusammen mit einem fettreichen Frühstück verringert sich die AUC von Maraviroc bei gesunden erwachsenen Probanden um ca. 73% (Studien mit den Tabletten zeigten, dass der Effekt der Nahrung mit höheren Dosen abnahm).
- Es bestehen keine relevanten Bedenken hinsichtlich der Wirksamkeit oder Sicherheit im Zusammenhang mit der Einnahme im Nüchternzustand oder nach einer Mahlzeit (daher können die Maraviroc Tabletten und die Lösung zum Einnehmen bei Erwachsenen, Jugendlichen und Kindern im Alter ab 2 Jahren und einem Körpergewicht von mindestens 10 kg in der empfohlenen Dosierung nahrungsunabhängig eingenommen werden).
Verteilung
- Maraviroc liegt im Humanplasma zu ca. 76% an Proteine gebunden vor und weist eine mäßige Affinität zu Albumin und saurem Alpha-1-Glykoprotein auf.
- Das Verteilungsvolumen von Maraviroc beträgt etwa 194 L.
Metabolismus (Biotransformation)
- Maraviroc wird hauptsächlich über das Cytochrom-P450-System zu Abbauprodukten metabolisiert, die im Wesentlichen inaktiv gegen HIV-1 sind.
- In-vitro-Studien zeigen sowohl, dass CYP3A4 das wichtigste Enzym für die Metabolisierung von Maraviroc darstellt als auch, dass die polymorphen Enzyme CYP2C9, CYP2D6 und CYP2C19 nur unwesentlich zum Metabolismus von Maraviroc beitragen.
- Nach einer oralen Einmaldosis von 300 mg besteht der größte zirkulierende Bestandteil (ca. 42% der Radioaktivität) aus unverändertem Maraviroc.
- Der bedeutendste zirkulierende Metabolit beim Menschen ist ein sekundäres Amin (ca. 22% der Radioaktivität), welches durch N-Dealkylierung entsteht (dieser polare Metabolit weist keine wesentliche pharmakologische Aktivität auf).
- Weitere Metaboliten entstehen durch Monooxygenierung und haben nur einen unbedeutenden Anteil an der Radioaktivität des Plasmas.
Elimination
- Nach 168 Stunden werden ca. 20% der Radioaktivität im Urin und 76% in den Fäzes wiedergefunden.
- Unverändertes Maraviroc ist dabei der Hauptbestandteil im Urin (durchschnittlich 8% der Dosis) und in den Fäzes (durchschnittlich 25% der Dosis), der Rest wird als Metaboliten ausgeschieden.
- Nach intravenöser Gabe (30 mg) beträgt die Halbwertszeit von Maraviroc 13,2 Stunden (22% der Dosis werden dabei unverändert renal ausgeschieden).
- Die Werte für totale und renale Clearance liegen bei 44,0 L/h bzw. 10,17 L/h.
Unterschiedliche Patientenpopulationen
- Kinder und Jugendliche: Die Verwendung von körpergewichtbasierten Dosierungen führt bei vorbehandelten, HIV-1-infizierten Kindern und Jugendlichen zu ähnlichen Maraviroc-Expositionen wie bei vorbehandelten Erwachsenen, die die empfohlene Dosis mit Begleitmedikationen erhielten (bei pädiatrischen Patienten im Alter < 2 Jahren wurde die Pharmakokinetik von Maraviroc nicht untersucht).
- Nierenfunktionsstörung: Bei Patienten mit Nierenfunktionsstörung, die Maraviroc zusammen mit einem starken CYP3A4-Inhibitor erhalten, ist eine Dosisanpassung notwendig.
- Leberfunktionsstörung: Maraviroc wird hauptsächlich über die Leber metabolisiert und eliminiert. Im Vergleich zu Personen mit normaler Leberfunktion waren die geometrischen Mittelwerte für cmax und AUC bei Patienten mit leichter Leberfunktionsstörung (Child-Pugh-Klasse A) um 11% bzw. 25% und bei Patienten mit mittelgradiger Leberfunktionsstörung (Child-Pugh-Klasse B) um 32% bzw. 46% erhöht. Aufgrund begrenzter Daten von Patienten mit einer eingeschränkten metabolischen Kapazität und erhöhter renaler Clearance können die Auswirkungen einer mittelgradigen Leberfunktionsstörung hierbei unterschätzt werden.
Dosierung
Voruntersuchung
- Vor der Einnahme von Maraviroc muss durch eine ausreichend validierte und empfindliche Bestimmungsmethode anhand einer frisch entnommenen Blutprobe nachgewiesen werden, dass ausschließlich CCR5-tropes HIV-1 vorliegt und kein CXCR4-tropes oder dual-/gemischt-tropes Virus nachgewiesen wurde.
- Aus der Vorbehandlung und durch die Untersuchung zurückgestellter, älterer Blutproben lässt sich der virale Tropismus nicht sicher ableiten.
Erwachsene
- Empfohlene Tagesdosis: 2x täglich 150 mg (mit einem starken CYP3A-Inhibitor mit oder ohne einen starken CYP3A-Induktor) oder 2x täglich 300 mg (ohne starke CYP3A-Inhibitoren oder -Induktoren) oder 2x täglich 600 mg (mit einem starken CYP3A-Induktor ohne einen starken CYP3A-Inhibitor) in Abhängigkeit von Interaktionen mit der gleichzeitig angewendeten ART und mit anderen Arzneimitteln.
Kinder ab einem Alter von 2 Jahren und einem Gewicht von mindestens 10 kg
- Die Dosierung sollte basierend auf dem Körpergewicht (kg) vorgenommen werden und darf die empfohlene Dosis für Erwachsene nicht überschreiten.
- Zusätzlich variiert die Dosierung in Abhängigkeit von Interaktionen mit der gleichzeitig angewendeten antiretroviralen Therapie und mit anderen Arzneimitteln (das empfohlene und detaillierte Dosierungsschema kann der Fachinformation entnommen werden).
- Falls ein Kind die Tabletten nicht zuverlässig schlucken kann, sollte die Lösung zum Einnehmen (20 mg/mL) verschrieben werden.
Nierenfunktionsstörung
- Bei erwachsenen Patienten mit einer Kreatinin-Clearance von < 80 mL/min, die auch starke CYP3A4-Inhibitoren als Begleitmedikation erhalten, sollte das Dosierungsintervall von Maraviroc auf 150 mg 1x täglich angepasst werden.
- Maraviroc sollte bei erwachsenen Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance < 30 mL/min), die starke CYP3A4-Inhibitoren erhalten, mit Vorsicht angewendet werden.
- Beispiele für Wirkstoffe bzw. Regime mit einer starken CYP3A4-inhibierenden Aktivität sind:
- Ritonavir-geboosterte Proteaseinhibitoren (mit Ausnahme von Tipranavir/Ritonavir)
- Cobicistat
- Itraconazol, Voriconazol, Clarithromycin und Telithromycin
- Telaprevir und Boceprevir
Nebenwirkungen
Die häufigsten Nebenwirkungen, die im Zusammenhang mit Maraviroc auftreten können, sind:
- Diarrhö
- Kopfschmerzen
- Übelkeit
- Erschöpfung
- Anämie
- Depressionen
- Schlaflosigkeit
- Anorexie
- Erhöhung der Alanin-Aminotransferase und Aspartat-Aminotransferase
- Exanthem
Zu den schwerwiegenderen Nebenwirkungen zählen:
- Immunrekonstitutionssyndrom (entzündliche Reaktion auf asymptomatische oder residuale opportunistische Infektionen zum Zeitpunkt der Therapieeinleitung bei schwerem Immundefekt)
- Osteonekrose (bei Patienten mit Risikofaktoren, fortgeschrittener HIV-Erkrankung oder Langzeitanwendung einer antiretroviralen Therapie)
- Synkopen (verursacht durch orthostatische Hypotonie)
Wechselwirkungen
Eine antiretrovirale Therapie sollte immer aus einer Kombination mehrerer Wirkstoffe bestehen, wodurch sich allerdings auch das Wechselwirkungsrisiko erhöht.
Viele Arzneimittel haben durch Interaktionen schwerwiegende Auswirkungen auf die Maraviroc-Exposition, was wiederum im Dosierungsschema berücksichtigt wird (siehe Dosierung, für detailliertere Informationen siehe Fachinformation).
CYP-Interaktionen
- Maraviroc wird über CYP3A4 und CYP3A5 metabolisiert.
- Die gleichzeitige Gabe von Maraviroc zusammen mit Arzneimitteln, die CYP3A4 induzieren, kann die Plasmakonzentration von Maraviroc reduzieren und dessen therapeutische Wirkung verringern.
- Die gleichzeitige Gabe von Maraviroc zusammen mit Arzneimitteln, die CYP3A4 inhibieren, kann die Plasmakonzentration von Maraviroc erhöhen.
- Wenn Maraviroc zusammen mit starken CYP3A4-Inhibitoren und/oder CYP3A4-Induktoren gegeben wird, wird eine Dosisanpassung von Maraviroc empfohlen.
Sonstige
- Maraviroc ist ein Substrat von P-gp und OATP1B1 (die Auswirkungen dieser Transporter auf die Maraviroc-Exposition sind jedoch nicht bekannt).
Kontraindikationen
Maraviroc ist kontraindiziert bei Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels.
Schwangerschaft
Die Auswirkungen von Maraviroc auf die Schwangerschaft beim Menschen sind nicht bekannt. Tierexperimentelle Studien zeigen eine Reproduktionstoxizität bei hohen Konzentrationen. Maraviroc darf in der Schwangerschaft nur angewendet werden, wenn der zu erwartende Nutzen das mögliche Risiko für den Fetus rechtfertigt.
Stillzeit
Es ist nicht bekannt, ob Maraviroc in die Muttermilch übergeht. Die zur Verfügung stehenden toxikologischen Daten bei Tieren zeigen, dass Maraviroc in erheblichen Mengen in die Milch übergeht. Es kann daher nicht ausgeschlossen werden, dass ein Risiko für Neugeborene/Säuglinge besteht.
Generell wird empfohlen, dass HIV-infizierte Mütter ihre Kinder unter keinen Umständen stillen, um eine Übertragung von HIV zu vermeiden.
Verkehrstüchtigkeit
Maraviroc kann einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben. Die Patienten sollten darüber informiert werden, dass im Zusammenhang mit der Anwendung von Maraviroc Schwindel auftreten kann. Der klinische Zustand des Patienten und das Nebenwirkungsprofil von Maraviroc sollten bei der Beurteilung der Fähigkeit des Patienten, ein Fahrzeug zu führen, Fahrrad zu fahren oder Maschinen zu bedienen, berücksichtigt werden.
Anwendungshinweise
HIV-Übertragung
- Obwohl es sich gezeigt hat, dass die erfolgreiche Virussuppression durch eine antiretrovirale Therapie das Risiko einer sexuellen Übertragung erheblich reduziert, kann ein Restrisiko nicht ausgeschlossen werden.
- Demnach sollten Vorsichtsmaßnahmen zur Vermeidung der Übertragung gemäß nationaler Leitlinien getroffen werden.
Lebererkrankung
- Bei Patienten mit ausgeprägten Leberfunktionsstörungen wurde die Sicherheit und Wirksamkeit von Maraviroc nicht speziell untersucht.
- Im Zusammenhang mit der Einnahme von Maraviroc wurden Fälle von Hepatotoxizität und Leberversagen berichtet, die Kennzeichen einer Allergie zeigten.
- Weiterhin wurde unter Maraviroc in Studien an vorbehandelten Personen mit einer HIV-Infektion ein Anstieg der hepatischen Nebenwirkungen beobachtet, ohne dass es jedoch zu einer generellen Zunahme von Grad-3/4-Leberfunktionsstörungen nach ACTG-Klassifikation gekommen wäre.
- Die bei nicht vorbehandelten Patienten beobachteten hepatobiliären Störungen traten gelegentlich auf und waren gleichmäßig über die Behandlungsgruppen verteilt.
- Bei Patienten mit bereits bestehenden Leberfunktionsstörungen, einschließlich chronisch aktiver Hepatitis, kann die Häufigkeit von Leberfunktionsstörungen unter einer antiretroviralen Kombinationstherapie zunehmen (die Patienten müssen entsprechend gängiger Praxis überwacht werden).
- Ein Abbruch der Therapie mit Maraviroc muss bei all den Patienten erwogen werden, die Symptome einer akuten Hepatitis entwickeln (dies gilt besonders dann, wenn eine arzneimittelbedingte Überempfindlichkeitsreaktion vermutet wird oder wenn erhöhte Lebertransaminasen zusammen mit einem Hautausschlag oder anderen systemischen Symptomen einer potenziellen Überempfindlichkeit (z.B. juckender Hautausschlag, Eosinophilie oder erhöhtes IgE) auftreten).
- Bei Patienten mit einer Hepatitis-B- und/oder Hepatitis-C-Virus-Koinfektion liegen nur begrenzte Daten vor (bei der Behandlung dieser Patienten ist Vorsicht geboten).
- Da nur eingeschränkte Erfahrungen bei Patienten mit Leberfunktionsstörungen vorliegen, muss Maraviroc bei dieser Patientengruppe mit Vorsicht angewendet werden.
Nierenfunktionsstörung
- Bei Patienten mit schwerer Nierenfunktionsstörung, die mit starken CYP3A-Inhibitoren oder geboosterten Proteaseinhibitoren und Maraviroc behandelt werden, kann es zu einem erhöhten Risiko für orthostatische Hypotonien kommen (dies ist auf eine mögliche Erhöhung der Maximalkonzentration von Maraviroc zurückzuführen, wenn Maraviroc bei diesen Patienten zusammen mit starken CYP3A-Inhibitoren oder geboosterten Proteaseinhibitoren gegeben wird).
Orthostatische Hypotonie
- Bei Gabe von Maraviroc im Rahmen von Studien mit gesunden Probanden mit höheren als den empfohlenen Dosen wurden Fälle von symptomatischer, orthostatischer Hypotonie häufiger als unter Placebo beobachtet.
- Bei Patienten mit einer Begleitmedikation, von der bekannt ist, dass sie den Blutdruck senkt, muss Maraviroc mit Vorsicht angewendet werden.
- Bei Patienten mit schwerer Nierenfunktionsstörung und bei Patienten mit Risikofaktoren für eine orthostatische Hypotonie oder mit einer orthostatischen Hypotonie in der Anamnese muss Maraviroc ebenfalls mit Vorsicht angewendet werden.
- Patienten mit kardiovaskulären Begleiterkrankungen können einem erhöhten Risiko für kardiovaskuläre, durch orthostatische Hypotonie ausgelöste Nebenwirkungen unterliegen.
Schwere Haut- und Hypersensitivitäts-Reaktionen
- Bei Patienten, die Maraviroc einnehmen, wurden Hypersensitivitäts-Reaktionen einschließlich schwerer und potenziell lebensbedrohlicher Ereignisse berichtet.
- In den meisten Fällen wurde Maraviroc gleichzeitig mit anderen Arzneimitteln, für die es einen Zusammenhang mit diesen Reaktionen gibt, eingenommen (diese Reaktionen umfassen Ausschlag, Fieber und mitunter eine Funktionsstörung von Organen und Leberversagen).
- Maraviroc und andere verdächtigte Arzneimittel sollten sofort abgesetzt werden, wenn sich Anzeichen oder Symptome schwerer Haut- oder Hypersensitivitäts-Reaktionen entwickeln.
- Der klinische Zustand und relevante Blutwerte sollten beobachtet und eine geeignete symptomatische Therapie eingeleitet werden.
Immunrekonstitutionssyndrom
- Bei HIV-infizierten Patienten mit schwerem Immundefekt kann sich zum Zeitpunkt der Einleitung einer antiretroviralen Kombinationstherapie (CART) eine entzündliche Reaktion auf asymptomatische oder residuale opportunistische Pathogene entwickeln, die zu schweren klinischen Zuständen oder Verschlechterung von Symptomen führt (typischerweise werden solche Reaktionen innerhalb der ersten Wochen oder Monate nach Beginn der CART beobachtet).
- Entsprechende Beispiele sind CMV-Retinitis, disseminierte und/oder lokalisierte mykobakterielle Infektionen und Pneumonien durch Pneumocystis jiroveci (früher bekannt als Pneumocystis carinii).
- Jedes Entzündungssymptom ist zu bewerten und, falls notwendig, eine geeignete Behandlung einzuleiten.
- Es liegen auch Berichte über Autoimmunerkrankungen (wie z. B. Morbus Basedow und Autoimmunhepatitis) vor, die im Rahmen einer Immun-Reaktivierung auftraten (allerdings ist der Zeitpunkt des Auftretens sehr variabel und diese Ereignisse können viele Monate nach Beginn der Behandlung auftreten).
Tropismus
- Maraviroc darf nur angewendet werden, wenn über eine ausreichend validierte und empfindliche Testmethode nachgewiesen ist, dass ausschließlich CCR5-tropes HIV-1 vorliegt und kein CXCR4-tropes oder dual-/gemischt-tropes Virus nachgewiesen wurde (in den klinischen Studien mit Maraviroc wurde hierfür der Trofile-Test von Monogram verwendet).
- Aus der Vorbehandlung und durch die Untersuchung älterer Blutproben lässt sich der virale Tropismus nicht ableiten.
- Bei Patienten, die mit HIV-1 infiziert sind, verändert sich der virale Tropismus im Laufe der Zeit, weshalb es notwendig ist, die Therapie kurz nach einem Tropismus-Test zu beginnen.
- Vormals unentdeckte Minoritäten von CXCR4-tropen Viren zeigen im Hintergrund eine vergleichbare Resistenz wie CCR5-trope Viren gegenüber anderen Klassen antiretroviraler Wirkstoffe.
- Die Anwendung von Maraviroc bei bisher nicht vorbehandelten Patienten wird nicht empfohlen (dies basiert auf den Ergebnissen einer klinischen Studie in dieser Population).
Osteonekrose
- Obwohl von einer multifaktoriellen Ätiologie (einschließlich Anwendung von Kortikoiden, Alkoholkonsum, ausgeprägte Immunsuppression und erhöhtem Body-Mass-Index) ausgegangen wird, wurden insbesonders bei Patienten mit fortgeschrittener HIV-Infektion und/oder langdauernder antiretroviraler Kombinationstherapie (CART) Fälle von Osteonekrose berichtet.
- Die Patienten müssen darauf hingewiesen werden, dass sie beim Auftreten von Gelenkbeschwerden und -schmerzen, bei Gelenksteifigkeit oder Bewegungseinschränkungen ihren Arzt aufsuchen sollen.
Auswirkungen auf das Immunsystem
- CCR5-Antagonisten können möglicherweise die Immunantwort auf bestimmte Infektionen verändern (dies sollte bei der Behandlung von Infektionen, wie z.B. aktiver Tuberkulose und invasiven Pilzinfektionen berücksichtigt werden).
- In den Zulassungsstudien war im Behandlungsarm mit Maraviroc und in dem mit Placebo die Häufigkeit von AIDS-definierenden Infektionen vergleichbar.
Alternativen
Zur antiretroviralen Therapie können alternativ bzw. ergänzend folgende Wirkstoffe eingesetzt werden:
Andere Entry-Inhibitoren
- Fusionshemmer: Enfuvirtid
Reverse-Transkriptase-Inhibitoren (RTI)
Nukleosidische Reverse-Transkriptase-Inhibitoren (NRTI):
Nukleotidische Reverse-Transkriptase-Inhibitoren (NtRTI):
Nicht-nukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI):
Integrase-Inhibitoren (INI, INSTI)
HIV-Protease-Inhibitoren (PI)
- Atazanavir
- Darunavir
- Fosamprenavir
- Indinavir
- Lopinavir
- Saquinavir
- Tipranavir
- Ritonavir (meist als „Booster“, Kennzeichnung /r)
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
- EMA: Celsentri
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- AWMF: Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion
- RKI: HIV-Infektion/AIDS
Abbildung
Adapted from „HIV Sites for Therapeutic Intervention”, by BioRender.com
-
CELSENTRI 20 mg/ml Lösung zum Einnehmen
ViiV Healthcare GmbH
-
Celsentri 150 mg Abacus Filmtabletten
Abacus Medicine A/S
-
Celsentri 150 mg axicorp Filmtabletten
axicorp Pharma GmbH
-
Celsentri 150 mg Bodensee Pharma Filmtabletten
Bodensee Pharma GmbH
-
Celsentri 150 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Celsentri 150 mg Emra Filmtabletten
Emra-Med Arzneimittel GmbH
-
Celsentri 150 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
CELSENTRI 150 mg Filmtabletten
ViiV Healthcare GmbH
-
Celsentri 150 mg Haemato Pharm Filmtabletten
HAEMATO PHARM GmbH
-
Celsentri 150 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Celsentri 150 mg Orifarm Filmtabletten
Orifarm GmbH
-
Celsentri 300 mg Abacus Filmtabletten
Abacus Medicine A/S
-
Celsentri 300 mg axicorp Filmtabletten
axicorp Pharma GmbH
-
Celsentri 300 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Celsentri 300 mg Emra Filmtabletten
Emra-Med Arzneimittel GmbH
-
Celsentri 300 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
CELSENTRI 300 mg Filmtabletten
ViiV Healthcare GmbH
-
Celsentri 300 mg Haemato Pharm Filmtabletten
HAEMATO PHARM GmbH
-
Celsentri 300 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Celsentri 300 mg Orifarm Filmtabletten
Orifarm GmbH
-
Maraviroc Amarox 150 mg Filmtabletten
Amarox Pharma GmbH
-
Maraviroc Amarox 300 mg Filmtabletten
Amarox Pharma GmbH
-
Maraviroc Waymade 150 mg Filmtabletten
Waymade B.V.
-
Maraviroc Waymade 300 mg Filmtabletten
Waymade B.V.











