Mifepriston
Der Wirkstoff Mifepriston ist ein Progesteronrezeptor-Antagonist, der zum frühen Schwangerschaftsabbruch, zur Vorbereitung von Schwangerschaftsabbrüchen und zur Weheneinleitung nach intrauterinem Tod des Fetus indiziert ist.
Mifepriston: Übersicht
Anwendung
Die Anwendung von Mifepriston ist unter anderem vom Stadium und den Umständen der Schwangerschaft abhängig. Der Wirkstoff wird eingesetzt:
- Beim medikamentösen Schwangerschaftsabbruch bis zum Ende der 9. Woche (Tag 63) nach Ausbleiben der Menstruation mit anschließender Verwendung eines Prostaglandinanalogons.
- Um den Gebärmutterhals (Cervix uteri) vor einem chirurgischen Schwangerschaftsabbruch während des ersten Trimesters zu erweitern und zu erweichen.
- Zur Vorbereitung für die Wirkung von Prostaglandinanaloga beim Abbruch der Schwangerschaft aus medizinischen Gründen nach dem ersten Trimester.
- Zur Weheneinleitung bei Tod des Fetus in utero, wenn Prostaglandin oder Oxytocin nicht verwendet werden können.
Zum Schwangerschaftsabbruch kann Mifepriston nur in Übereinstimmung mit nationalen Gesetzen und Bestimmungen des jeweiligen Landes verschrieben und verabreicht werden.
Anwendungsart
Die Applikation von Mifepriston (Mifegyne) erfolgt oral in Form von Tabletten mit je 200 mg. Je nach Indikationsgebiet kann die Einnahme von bis zu 3 Tabletten gleichzeitig (600 mg) notwendig sein.
Wirkmechanismus
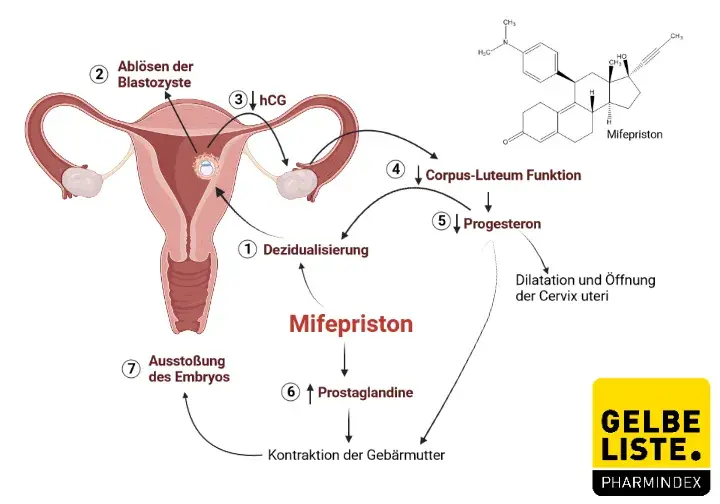
Die Progesteronfreisetzung des Corpus luteum in der frühen Schwangerschaft sowie der Plazenta in der fortgeschrittenen Schwangerschaft ist entscheidend für die Aufrechterhaltung der Schwangerschaft. Progesteron vermittelt dabei über Progesteronrezeptoren wachstumsfördernde und kontraktionshemmende Effekte, die zusammen mit Östrogenen die Gravidität erhalten. Das 19-Nortestosteronderivat Mifepriston verfügt über antigestagene Eigenschaften, indem es kompetitiv Progesteronrezeptoren hemmt.
Eine Hemmung der Progesteronwirkung hat zur Folge, dass progesteroninduzierte Kontraktionshemmungen aufgehoben werden und somit prostaglandininduzierte Uteruskontraktionen erfolgen können.
In Kombination mit Prostaglandinanaloga kann Mifepriston daher zum Abbruch einer intrauterinen Schwangerschaft angewendet werden. Mifepriston bindet darüber hinaus an Glukokortikoid-Rezeptoren und kann glukokortikoidinduzierte Wirkungen abschwächen. Zudem hat Mifepriston auch anti-androgene Eigenschaften, die beim Menschen klinisch allerdings vernachlässigbar sind.
Pharmakokinetik
Resorption
- Nach oraler Verabreichung einer Einzeldosis von 600 mg wird Mifepriston schnell resorbiert.
- Nach 1,5 Stunden wird die Spitzenkonzentration von 1,98 mg/l erreicht (Mittelwert aus 10 Probanden).
- Die Dosisantwort ist nichtlinear.
- Nach Verabreichung niedriger Dosen von Mifepriston (20 mg oral oder intravenös) beträgt die absolute Bioverfügbarkeit 69%.
Verteilung
- Im Plasma ist Mifepriston zu 98% an Plasmaproteine (Albumin und vor allem alpha-1-saures Glykoprotein (AAG), an dem die Bindung sättigbar ist) gebunden.
- Das Verteilungsvolumen und die Plasma-Clearance von Mifepriston sind aufgrund der spezifischen Bindung umgekehrt proportional zur Plasmakonzentration von AAG.
Metabolismus (Biotransformation)
- N-Demethylierung und terminale Hydroxylierung der 17-Propinyl-Kette sind die primären Stoffwechselwege des oxidativen Abbaus in der Leber (CYP3A4-Beteiligung).
Elimination
- Nach einer Verteilungsphase beginnt die Eliminierung zunächst langsam, wobei die Konzentration zwischen etwa 12 und 72 Stunden um die Hälfte abnimmt und verläuft dann schneller, was eine Eliminationshalbwertszeit von 18 Stunden ergibt.
- Die terminale Halbwertszeit beträgt bis zu 90 Stunden, einschließlich aller Metaboliten von Mifepriston, die in der Lage sind, an Progesteronrezeptoren zu binden (gemessen mit Radio-Rezeptor-Assay-Techniken).
- Mifepriston-Metaboliten werden hauptsächlich (circa 90%) über den Fäzes ausgeschieden, wobei der Restanteil renal eliminiert wird.
Dosierung
Die Dosierung ist abhängig vom Stadium der Schwangerschaft und der gewählten Abbruchmethode.
Medikamentöser Abbruch einer frühen intrauterinen Schwangerschaft
Bis zum 49. Tag der Amenorrhoe:
- 600 mg Mifepriston (3 Tabletten mit je 200 mg) werden als Einzeldosis oral eingenommen und 36 bis 48 Stunden später folgt die Verabreichung eines Prostaglandinanalogons (Misoprostol 400 μg oral oder Gemeprost 1 mg vaginal).
- Alternativ können auch 200 mg Mifepriston als Einzeldosis oral verwendet werden und 36 bis 48 Stunden später folgt die vaginale Verabreichung des Prostaglandinanalogons Gemeprost 1 mg.
Zwischen dem 50. und 63. Tag der Amenorrhoe:
- 600 mg Mifepriston (3 Tabletten mit je 200 mg) werden als Einzeldosis oral eingenommen und 36 bis 48 Stunden später folgt die vaginale Verabreichung des Prostaglandinanalogons Gemeprost 1 mg.
- Alternativ können auch 200 mg Mifepriston als Einzeldosis oral verwendet werden und 36 bis 48 Stunden später folgt die vaginale Verabreichung des Prostaglandinanalogons Gemeprost 1 mg.
Erweichung und Erweiterung der Cervix uteri vor dem chirurgischen Abbruch der Schwangerschaft während des ersten Trimesters
- 200 mg Mifepriston (eine Tablette), höchstens 36 bis 48 Stunden später erfolgt der chirurgischen Schwangerschaftsabbruch.
Vorbereitung für die Wirkung von Prostaglandinanaloga beim Abbruch der Schwangerschaft aus medizinischen Gründen
- 600 mg Mifepriston (3 Tabletten mit je 200 mg) als Einzeldosis per oral 36 bis 48 Stunden vor der geplanten Verabreichung des Prostaglandins.
Einleitung von Wehen bei Tod des Fetus in utero
- 600 mg Mifepriston (3 Tabletten mit je 200 mg) als tägliche Einzeldosis per oral für zwei aufeinander folgende Tage (die Wehen sollten durch die üblichen Methoden eingeleitet werden, wenn sie nicht innerhalb von 72 Stunden nach der ersten Verabreichung von Mifepriston einsetzen).
Nebenwirkungen
Zu den häufigen Nebenwirkungen, die während einer Mifepriston-Therapie auftreten können, zählen:
- Urogenitale Blutungen
- Uteruskontraktionen
- Krämpfe
- Infektionen nach Abort
- Übelkeit und Erbrechen
- Hypersensibilität der Haut
- Vagale Symptome (Hitzewallungen, Schwindel, Kältegefühl)
Schwerwiegende Nebenwirkungen, die potenziell unter Mifepriston auftreten können, sind:
- Lebensbedrohliche toxische Schocks durch Clostridium sordellii endometritis ohne Fieber oder andere offensichtliche Symptome
- Uterusrupturen nach Prostaglandin-Applikation (bei Weheneinleitung nach Tod des Fetus im dritten Trimester, vor allem bei Mehrfachgebärenden oder Patientinnen mit Kaiserschnitt-Narbe)
Wechselwirkungen
Die Wechselwirkungen von Mifepriston wurden unzureichend untersucht, jedoch sind vor allem Interaktionen mit Substraten des CYP3A4-Enzymsystems zu beachten:
- CYP3A4-Induktoren (z.B. Rifampicin, Johanniskraut, Phenytoin, Carbamazepin): CYP3A4-Induktoren können den Metabolismus von Mifepriston anregen und somit den Plasmaspiegel senken.
- CYP3A4-Inhibitoren (z.B. Ketoconazol, Itraconazol, Erythromycin, Grapefruitsaft): CYP3A4-Hemmer können den Metabolismus von Mifepriston hemmen und somit den Plasmaspiegel erhöhen.
- CYP3A4-Substrate (z.B. Atorvastatin, Phenprocoumon): Mifepriston kann bei gleichzeitiger Einnahme den Plasmaspiegel von CYP3A4-Substraten erhöhen (vor allem für Wirkstoffe mit geringer therapeutischer Breite zu berücksichtigen).
- Glukokortikoide (z.B. Dexamethason): Mifepriston verfügt über antiglukokortikoide Eigenschaften und kann somit die Wirksamkeit einer Langzeittherapie mit Glukokortikoiden (auch inhalativer Glukokortikoide z.B. bei Asthmapatienten) beeinflussen.
Kontraindikationen
Die Anwendung von Mifepriston ist generell kontraindiziert bei:
- Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile der Formulierung
- Chronischem Nierenversagen
- Schwerem, nicht therapeutisch kontrollierbarem Asthma
- Angeborener Porphyrie
Kontraindikationen bei der Indikation medikamentöser Abbruch einer frühen Schwangerschaft sind:
- Fehlende Bestätigung der Schwangerschaft mittels Ultraschallscans oder biologischen Tests
- Schwangerschaft nach dem 63. Tag der Amenorrhoe
- (Vermutete) extrauterine Schwangerschaft
- Kontraindikationen für das ausgewählte Prostaglandinanalogon
Kontraindikationen bei der Indikation Erweichung und Erweiterung der Cervix uteri vor dem chirurgischen Abbruch der Schwangerschaft sind:
- Fehlende Bestätigung der Schwangerschaft mittels Ultraschallscans oder biologischen Tests
- Schwangerschaft nach 84 Tagen der Amenorrhoe (und danach)
- (Vermutete) extrauterine Schwangerschaft
Kontraindikationen bei der Vorbereitung für die Wirkung von Prostaglandinanaloga beim Abbruch der Schwangerschaft aus medizinischen Gründen (nach dem ersten Trimester) entsprechen den Kontraindikationen für das ausgewählte Prostaglandinanalogon.
Kontraindikationen bei der Einleitung von Wehen bei Tod des Fetus in utero entsprechen den Kontraindikationen für das ausgewählte Prostaglandinanalogon.
Schwangerschaft
Im Tierversuch schließt die abortive Wirkung von Mifepriston die korrekte Beurteilung teratogener Effekte aus. Subabortive Dosen Mifepriston erzielten dabei vereinzelt mit unzureichender Signifikanz Fälle von Missbildungen. Die begrenzte Datenlage lässt eine Aussage zur Human-Teratogenität nicht zu.
Diesbezüglich sollten Patientinnen den Kontrolltermin aufgrund der Gefahr eines Therapie-Misserfolgs dringend wahrnehmen und der Schwangerschaftsabbruch nach Misserfolg, sofern die Patientin einverstanden ist, mit einer anderen Methode durchgeführt werden. Sollte die Patientin nach einem Misserfolg die Schwangerschaft jedoch aufrecht erhalten wollen, rechtfertigt die Datenlage einen systematischen Abbruch nicht (in diesem Fall sollte die Schwangerschaft mit sorgfältigen Ultraschalluntersuchungen überwacht werden).
Stillzeit
Mifepriston ist eine lipophile Verbindung und kann theoretisch in die Muttermilch übergehen. Da jedoch keine Daten verfügbar sind, sollte die Anwendung von Mifepriston während der Stillzeit vermieden werden.
Verkehrstüchtigkeit
Es wurden keine Untersuchungen zur Verkehrstüchtigkeit und der Fähigkeit zum Bedienen von Maschinen durchgeführt.
Anwendungshinweise
Allgemeine Anwendungshinweise
- Aufgrund der unzureichenden Studienlage sollte Mifepriston generell bei Patientinnen mit Nierenversagen, Leberversagen oder Unterernährung nicht angewendet werden.
- Wird ein akutes Nierenversagen vermutet, kann die Verabreichung von 1 mg Dexamethason die Dosis von 400 mg Mifepriston neutralisieren.
- Mifepriston verfügt über eine Antiglukokortikoid-Aktivität und kann somit die Wirksamkeit einer Langzeittherapie mit Glukokortikoiden (auch inhalativer Glukokortikoide z.B. bei Asthmapatientinnen) verringern.
- Für die Anwendung von Mifepriston ist die Bestimmung des Rhesusfaktors und ggf. die Prävention einer Rhesus-Allo-Immunisierung erforderlich.
- Um einen möglichen Effekt von Mifepriston auf eine nachfolgende Schwangerschaft auszuschließen, wird empfohlen, eine Konzeption während des nächsten Menstruationszyklus zu vermeiden (so früh wie möglich nach der Verabreichung von Mifepriston sollte eine zuverlässige kontrazeptive Maßnahme ergriffen werden).
- Für die sequenzielle Anwendung von Mifepriston und Prostaglandinanaloga sind unabhängig von der Indikation die Vorsichtsmaßnahmen im Zusammenhang mit dem jeweiligen Prostaglandin zu beachten.
- Im Zusammenhang mit Mifepriston wurden schwere arzneimittelinduzierte Hautreaktionen, einschließlich toxisch epidermaler Nekrolyse und akuter generalisierter exanthematischer Pustulose, berichtet. Bei Patientinnen mit schweren Hautreaktionen sollte die Behandlung mit Mifepriston sofort abgebrochen werden. Eine erneute Behandlung mit Mifepriston wird nicht empfohlen.
Medikamentöser Abbruch einer frühen intrauterinen Schwangerschaft
- Da die Patientin aktiv an der Behandlung mitwirken muss, sollte eine Aufklärung erfolgen bezüglich der Notwendigkeit der Weiterbehandlung mit Prostaglandin (wird bei einem zweiten Termin verabreicht) sowie der Notwendigkeit eines Nachfolgetermins (3. Termin, innerhalb von 14-21 Tage nach erster Verabreichung von Mifepriston) als auch über die Möglichkeit eines Therapieversagens, das wiederum eine andere Methode zum Schwangerschaftsabbruch notwendig macht.
- Tritt die Schwangerschaft bei einer eingesetzten intrauterinen Vorrichtung auf, so muss diese vor Applikation von Mifepriston entfernt werden.
- In etwa 3% der Fälle findet die Austreibung vor der Verabreichung von Prostaglandin-Analoga statt (trotzdem muss ein Kontrolltermin zu Sicherstellung der vollständigen Austreibung und Leere des Uterus wahrgenommen werden).
- Misserfolge: In 1,3 bis 7,5 % der Fälle treten Misserfolge auf, entsprechend muss ein Kontrolltermin zu Sicherstellung der vollständigen Austreibung und Leere des Uterus wahrgenommen werden. Bestätigt sich der Misserfolg nach dem Kontrolltermin, so wird der Patientin eine andere Methode zum Schwangerschaftsabbruch vorgeschlagen.
- Blutungen: Patientinnen müssen darüber aufgeklärt werden, dass es zu länger anhaltenden und möglicherweise starken vaginalen Blutungen (im Durchschnitt etwa 12 Tage) kommen kann. Blutungen sind jedoch kein Hinweis auf eine vollständige Austreibung und können einen unvollständigen Abgang oder eine extrauterine Schwangerschaft anzeigen (Überwachung bei Patientinnen mit Blutgerinnungsstörungen, verminderter Gerinnbarkeit oder Anämie).
- Die Patientinnen sollten angehalten werden keine weiteren Reise zu unternehmen bis nicht die vollständige Austreibung nachgewiesen wurde. Zudem sollen der Patientin konkrete Anweisungen gegeben werden, wen sie im Falle von Komplikationen oder Problemen kontaktieren sollte.
- Kontrolltermin: Innerhalb von 14 bis 21 Tagen nach Verabreichung von Mifepriston muss ein Kontrolltermin wahrgenommen werden, der die Austreibung bestätigt (klinische Untersuchungen, Ultraschallscans und Bestimmung von Beta-HCG). Wird eine weiterbestehende Schwangerschaft vermutet, so kann eine weitere Ultraschalluntersuchung notwendig sein, um die Lebensfähigkeit des Fetus zu beurteilen.
- Infektionen: In sehr seltenen Fällen wurde ein tödlicher Schock (ausgelöst durch Clostridium sordellii endometritis) nach Schwangerschaftsabbruch mit Mifepriston 200 mg und anschließender nicht autorisierter vaginaler Verabreichung von Misoprostol-Tabletten für orale Anwendung berichtet (dabei traten keine Symptome oder sonstige Anzeichen einer bestehenden Infektion auf).
- Kardiovaskuläre Zwischenfälle: Es wurden seltene aber ernst zu nehmende kardiovaskuläre Zwischenfälle nach intramuskulärer Verabreichung von Prostaglandinanaloga berichtet (entsprechend sollten Patientinnen mit Vorerkrankungen oder Risikofaktoren mit besonderer Vorsicht behandelt werden).
- Verfahren der Prostaglandin-Verabreichung: Während und für 3 Stunden nach der Einnahme von Prostaglandinanaloga muss die Patientin im Behandlungszentrum zur Überwachung akuter Prostaglandin-Wirkungen bleiben.
Erweichung und Erweiterung der Cervix uteri vor dem chirurgischen Abbruch der Schwangerschaft während des ersten Trimesters
- Zur vollständigen Wirksamkeit der Therapie muss spätestens 36 bis 48 Stunden nach Anwendung von Mifepriston der chirurgische Abbruch folgen.
- Blutungen: Patientinnen sollen über das Risiko (starker) vaginaler Blutungen nach Mifepriston-Anwendung aufgeklärt werden (bei etwa 1% der Patientinnen treten starke Blutungen auf, die eine Kürettage erforderlich machen, vor allem bei vorliegenden Blutgerinnungsstörungen, Hypokoagulabilität oder ausgeprägter Anämie).
- Es kann auch schon vor dem chirurgischen Eingriff zu einem Abort kommen.
- Anonsten gelten Risiken des chirurgischen Eingriffs.
Alternativen
Je nach Indikationsgebiet und patientenindividuellen Gegebenheiten kommen verschiedene Wirkstoffe und operative Techniken als Alternativen in Frage:
- Prostaglandinanaloga wie Misoprostol und Gemeprost
- Oxytocin
- Ethacridinlactat
- Operative Techniken wie z.B. Vakuumaspiration und operative Uterusausräumung
Wirkstoff-Informationen
- BfArM: Mifegyne
- Schild, R.L., Morfeld, C. Schwangerschaftsabbruch aus medizinischer Indikation – bei Einlingsschwangerschaft. Gynäkologe 53, 183–192 (2020)
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer











