Mirabegron
Mirabegron ist der bisher einzige Vertreter aus der Wirkstoffgruppe der Beta-3-Adrenozeptoragonisten. Der Wirkstoff wird zur symptomatischen Behandlung einer überaktiven Blase (overactive bladder, OAB) eingesetzt.
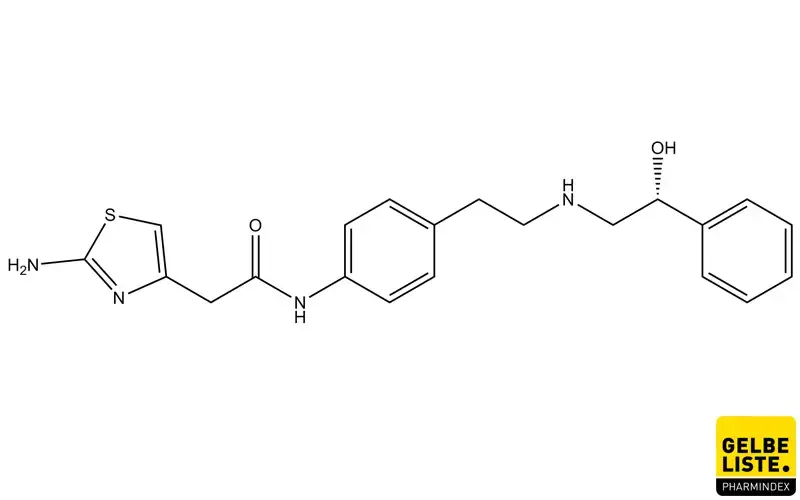
Mirabegron: Übersicht
Anwendung
Der Wirkstoff Mirabegron (Betmiga) ist indiziert zur symptomatischen Behandlung der Dranginkontinenz und/oder der Pollakisurie und des imperativen Harndrangs (wie sie bei erwachsenen Patienten mit dem Syndrom der überaktiven Harnblase auftreten können).
Anwendungsart
Mirabegron ist als Retardtablette (25 und 50 mg) erhältlich. Die Einnahme kann unabhängig von den Mahlzeiten erfolgen. Die Retardtabletten müssen im Ganzen geschluckt und dürfen nicht zerkaut, geteilt oder zermahlen werden.
Wirkmechanismus
Mirabegron ist ein selektiver Beta-3-Adrenozeptoragonist (β3-Rezeptoragonist), dessen pharmakologische Wirkung auf dem Agonismus an β3-Rezeptoren der Harnblasenmuskulatur beruht. Beta-3-Adrenozeptoren sind Gs-Protein gekoppelte Rezeptoren aus der Familie der G-Protein gekoppelten Rezeptoren (GPCR). Folglich führt die Aktivierung von β3-Rezeptoren durch beispielsweise Mirabegron zu einer Zunahme der cAMP-Konzentration durch die Adenylylzyklase (AC). Erhöhte cAMP-Level induzieren eine Relaxation der glatten Muskulatur der Harnblase, wodurch diese entspannt und der Harndrang abnimmt.
Während sich der Urin in der Harnblase sammelt, überwiegt die sympathische Nervenstimulation. Die Nervenendigungen setzen Noradrenalin frei, das vorwiegend die Beta-Adrenozeptoren in der Harnblasenmuskulatur aktiviert und dadurch den glatten Harnblasenmuskel entspannt. Dagegen wird die Harnblase in der Harnentleerungsphase vorwiegend vom parasympathischen
Nervensystem kontrolliert. Aus den pelvinen Nervenendigungen freigesetztes Acetylcholin stimuliert cholinerge Muskarinrezeptoren (M2- und M3-Rezeptoren) und löst eine Harnblasenkontraktion aus. Die Aktivierung der M2-Rezeptoren inhibiert dabei auch die über Beta-3-Adrenozeptoren induzierte Zunahme von cAMP, weshalb die Beta-3-Adrenozeptor-Stimulation den Entleerungsprozess nicht stören sollte. Muskarinrezeptor-Antagonisten wie Darifenacin und Solifenacin sind ebenfalls bei OAB indiziert.
Pharmakokinetik
Resorption
- Nach oraler Anwendung wird Mirabegron resorbiert und erreicht bei gesunden Probanden die maximalen Plasmakonzentrationen 3 bis 4 Stunden nach der Einnahme.
- Die absolute Bioverfügbarkeit nimmt von 29% nach einer Dosis von 25 mg auf 35% nach einer Dosis von 50 mg zu.
- Die mittlere cmax und AUC steigen über den Dosisbereich mehr als dosisproportional an.
- In der Gesamtpopulation der Männer und Frauen bewirkt eine Verdoppelung der Dosis von 50 mg auf 100 mg Mirabegron einen Anstieg der cmax und AUCtau um etwa den Faktor 2,9 bzw. 2,6 und eine Vervierfachung der Dosis von 50 mg auf 200 mg Mirabegron einen Anstieg der cmax und AUCtau um etwa den Faktor 8,4 bzw. 6,5.
- Steady-State-Konzentrationen werden bei 1x täglicher Anwendung von Mirabegron innerhalb von 7 Tagen erreicht.
- Die Mirabegron-Plasmaexposition im Steady-State ist bei 1x täglicher Anwendung etwa doppelt so hoch wie nach einer Einzeldosis.
- Einfluss von Nahrung: Die Einnahme einer 50-mg-Tablette zu einer Mahlzeit mit hohem Fettgehalt hat eine Verringerung der cmax und AUC von Mirabegron um etwa 45% bzw. 17% zur Folge. Eine Mahlzeit mit niedrigem Fettgehalt bewirkt eine Reduktion der cmax und AUC von Mirabegron um etwa 75% bzw. 51%. In den Phase-III-Studien wurde Mirabegron mit oder ohne Nahrung verabreicht und erwies sich als sicher und wirksam (entsprechend kann Mirabegron in der empfohlenen Dosierung mit oder ohne Nahrung eingenommen werden).
Verteilung
- Das Verteilungsvolumen im Steady-State (Vss) beträgt etwa 1.670 Liter.
- Mirabegron wird zu etwa 71% an humane Plasmaproteine gebunden und zeigte eine mäßige Affinität für Albumin und saures Alpha-1-Glykoprotein.
- Mirabegron wird in Erythrozyten verteilt (in-vitro erreichte 14C-Mirabegron in Erythrozyten eine doppelt so hohe Konzentration wie im Plasma).
Metabolismus
- Mirabegron wird über zahlreiche Wege metabolisiert, unter anderem Dealkylierung, Oxidation, (direkte) Glukuronidierung und Amid-Hydrolyse.
- Mirabegron ist nach einmaliger Anwendung die hauptsächlich zirkulierende Verbindung.
- Im menschlichen Plasma wurden zwei wichtige Metaboliten nachgewiesen (Glukuronide der Phase 2, die 16% bzw. 11% der Gesamtexposition ausmachen), wobei diese Metaboliten nicht pharmakologisch aktiv sind.
- Auf Grundlage von In-vitro-Studien ist es unwahrscheinlich, dass Mirabegron den Metabolismus von gleichzeitig applizierten Arzneimitteln hemmt, die über die Cytochrom-P450-Enzyme CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 und CYP2E1 metabolisiert werden, da es die Aktivität dieser Enzyme in klinisch relevanten Konzentrationen nicht hemmt.
- Mirabegron hat keine induzierende Wirkung auf CYP1A2 oder CYP3A.
- Es ist zu erwarten, dass Mirabegron keine klinisch relevante Hemmung von OTC-vermitteltem Arzneimitteltransport verursacht.
- Obwohl In-vitro-Studien auf eine Beteiligung von CYP2D6 und CYP3A4 am oxidativen Metabolismus von Mirabegron hinweisen, zeigen In-vivo-Ergebnisse, dass diese Isoenzyme für die insgesamte Elimination eine begrenzte Rolle spielen.
- In-vitro- und Ex-vivo-Studien haben gezeigt, dass Butyrylcholinesterase, UGT und möglicherweise die Alkoholdehydrogenase (ADH) am Metabolismus von Mirabegron neben CYP3A4 und CYP2D6 beteiligt sind.
Elimination
- Die Gesamtkörper-Clearance (CLtot) aus dem Plasma beträgt etwa 57 L/h und die terminale Eliminationshalbwertszeit (t1/2) etwa 50 Stunden.
- Es wurde eine renale Clearance (CLR) von etwa 13 L/h gemessen, was fast 25% der CLtot entspricht.
- Die renale Elimination von Mirabegron erfolgt zusätzlich zur glomerulären Filtration vorwiegend über aktive tubuläre Sekretion.
- Die Exkretion von unverändertem Mirabegron über den Harn ist dosisabhängig und reicht von etwa 6,0% nach einer Tagesdosis von 25 mg bis 12,2% nach einer Tagesdosis von 100 mg.
- Nach Anwendung von 160 mg Mirabegron an gesunden Probanden werden etwa 55% im Urin (ca. 45% unverändertes Mirabegron, was auf das Vorliegen von Metaboliten hinweist) und 34% im Stuhl nachgewiesen (im Stuhl ist der größte Teil auf unverändertes Mirabegron zurückzuführen).
Patientenindividuelle Pharmakokinetik
- Geschlecht: cmax und AUC sind bei Frauen etwa 40% bis 50% höher als bei Männern, wobei die geschlechtsspezifischen Unterschiede bei cmax und AUC auf Unterschiede beim Körpergewicht und bei der Bioverfügbarkeit zurückgeführt werden.
- CYP2D6: Bei gesunden Probanden, die genotypisch langsame Metabolisierer für CYP2D6-Substrate sind (als Surrogat für eine CYP2D6-Hemmung verwendet), war die mittlere cmax und AUCinf nach einmaliger Gabe von 160 mg schnell freisetzendem Mirabegron um 14% bzw. 19% höher als bei schnellen Metabolisierern (diese Beobachtung weist darauf hin, dass ein genetischer CYP2D6-Polymorphismus minimalen Einfluss auf die mittlere Mirabegron-Plasmaexposition hat). Wechselwirkungen zwischen Mirabegron und bekannten CYP2D6-Inhibitoren werden nicht erwartet und wurden nicht untersucht. Bei gemeinsamer Anwendung mit einem CYP2D6-Inhibitor und bei Anwendung an Patienten, die langsame CYP2D6-Metabolisierer sind, ist keine Dosisanpassung erforderlich.
- Eingeschränkte Nierenfunktion: Nach Anwendung einer 100-mg-Einzeldosis an Probanden mit leichter Einschränkung der Nierenfunktion (eGFR gemäß MDRD-Formel 60 bis 89 mL/min/1,73 m2) stiegen die mittlere cmax und AUC von Mirabegron gegenüber Probanden mit normaler Nierenfunktion um 6% bzw. 31% an. Bei Probanden mit mäßiger Einschränkung der Nierenfunktion (eGFR-MDRD 30 bis 59 mL/min/1,73 m2) stiegen cmax und AUC um 23% bzw. 66% an. Bei Probanden mit starker Einschränkung der Nierenfunktion (eGFR-MDRD 15 bis 29 ml/min/1,73 m2) waren die mittlere cmax und AUC um 92% bzw. 118% erhöht. Mirabegron wurde nicht bei Patienten mit terminaler Niereninsuffizienz (GFR< 15 mL/min/1,73 m2 oder dialysepflichtige Patienten) untersucht.
- Eingeschränkte Leberfunktion: Nach Anwendung einer 100-mg-Einzeldosis an Probanden mit leichter Einschränkung der Leberfunktion (Child-Pugh-Klasse A) stiegen die mittlere cmax und AUC von Mirabegron gegenüber Probanden mit normaler Leberfunktion um 9% bzw. 19% an. Bei Probanden mit mäßiger Einschränkung der Leberfunktion (Child-Pugh-Klasse B) stiegen die mittleren cmax- und AUC-Werte um 175% bzw. 65%. Mirabegron wurde nicht bei Patienten mit starker Einschränkung der Leberfunktion (Child-Pugh-Klasse C) untersucht.
Dosierung
- Empfohlene Tagesdosis: 1x täglich 50 mg
- Eingeschränkte Nieren- und Leberfunktion: Mirabegron wurde nicht an Patienten mit einer terminalen Niereninsuffizienz (GFR < 15 mL/min/1,73 m² oder dialysepflichtige Patienten) oder mit einer starken Einschränkung der Leberfunktion (Child-Pugh-Klasse C) untersucht und wird daher bei diesen Patienten nicht empfohlen.
- Eingeschränkte Nieren- und/oder Leberfunktion: In der Fachinformation sind die Empfehlungen für die Tagesdosis bei Patienten mit eingeschränkter Nieren- oder Leberfunktion mit und ohne gleichzeitige Anwendung von starken CYP3A-Inhibitoren in einer Tabelle zusammengefasst.
Nebenwirkungen
Die am häufigsten beschriebenen Nebenwirkungen von Mirabegron (im Rahmen von Phase-III-Studien) sind:
- Tachykardie
- Harnwegsinfektionen
Weitere häufige Nebenwirkungen umfassen:
- Kopfschmerzen
- Schwindel
- Übelkeit
- Obstipation
- Durchfall
Vorhofflimmern kann als schwerwiegende Nebenwirkung auftreten.
Wechselwirkungen
Mirabegron wird über zahlreiche Wege transportiert und metabolisiert und ist ein Substrat von Cytochrom P450 (CYP) 3A4, CYP2D6, Butyrylcholinesterase, Uridin-Diphospho-Glucuronosyltransferasen (UGT), Efflux-Transporter P-Glykoprotein (P-gp) und Influx-Transporter für organische Kationen (OCT) OCT1, OCT2 und OCT3.
Zudem ist Mirabegron ein mäßiger und zeitabhängiger Inhibitor von CYP2D6 und ein schwacher Inhibitor von CYP3A und hemmt darüber hinaus in hohen Konzentrationen den über P-gp-vermittelten Arzneimittel-Transport.
Allerdings werden klinisch relevante Arzneimittelwechselwirkungen zwischen Mirabegron und Arzneimitteln, die eines der CYP-Isoenzyme oder einen der Transporter hemmen oder induzieren oder Substrate dieser sind (mit Ausnahme eines hemmenden Effektes von Mirabegron auf den Metabolismus von CYP2D6-Substraten) nicht erwartet.
Einfluss von Enzyminhibitoren
- Bei gesunden Probanden ist die Mirabegron-Exposition (AUC) in Gegenwart des starken CYP3A/P-gp-Inhibitors Ketoconazol um etwa den Faktor 1,8 erhöht, wobei bei Kombination mit Inhibitoren von CYP3A und/oder P-gp keine Dosisanpassung erforderlich ist.
- Allerdings beträgt die empfohlene Dosis 25 mg 1x täglich mit oder ohne Nahrung bei Patienten mit leichter bis mäßiger Einschränkung der Nierenfunktion (GFR 30 bis 89 ml/min/1,73 m2) oder leichter Einschränkung der Leberfunktion (Child-Pugh-Klasse A), die gleichzeitig starke CYP3A-Inhibitoren wie Itraconazol, Ketoconazol, Ritonavir oder Clarithromycin erhalten.
- Mirabegron wird bei Patienten mit starker Einschränkung der Nierenfunktion (GFR 15 bis 29 ml/min/1,73 m2) oder solchen mit mäßiger Einschränkung der Leberfunktion (Child-Pugh-Klasse B), die gleichzeitig starke CYP3A-Inhibitoren erhalten, nicht empfohlen.
Einfluss von Enzyminduktoren
- Induktoren von CYP3A oder P-gp verringern die Plasmakonzentrationen von Mirabegron, wobei bei Anwendung mit therapeutischen Dosen von Rifampicin oder anderen CYP3A- oder P-gp-Induktoren keine Anpassung der Mirabegron-Dosis erforderlich ist.
CYP2D6
- Der genetische CYP2D6-Polymorphismus hat minimale Auswirkungen auf die mittlere Mirabegron-Plasmaexposition.
- Wechselwirkungen zwischen Mirabegron und bekannten CYP2D6-Inhibitoren werden nicht erwartet und wurden nicht untersucht.
- Bei gemeinsamer Anwendung mit CYP2D6-Inhibitoren oder bei Gabe an Patienten, die langsame CYP2D6-Metabolisierer sind, ist keine Dosisanpassung erforderlich.
- Bei gesunden Probanden ist das hemmende Potenzial von Mirabegron auf CYP2D6 mäßig ausgeprägt (die CYP2D6-Aktivität erholt sich innerhalb von 15 Tagen nach Absetzen von Mirabegron).
- Die mehrmalige 1x tägliche Anwendung von schnell freisetzendem Mirabegron bewirkt nach einer Einzeldosis Metoprolol einen Anstieg der cmax von Metoprolol um 90% und der AUC um 229% und nach einer Einzeldosis Desipramin einen Anstieg der cmax von Desipramin um 79% und der AUC um 241%.
- Vorsicht ist geboten, wenn Mirabegron gemeinsam mit Arzneimitteln mit geringer therapeutischer Breite eingenommen wird, die in relevantem Maße durch CYP2D6 metabolisiert werden wie Thioridazin, Typ-1C-Antiarrhythmika (z.B. Flecainid, Propafenon) und trizyklische Antidepressiva (z.B. Imipramin, Desipramin).
- Des Weiteren ist Vorsicht geboten bei gemeinsamer Anwendung von Mirabegron mit CYP2D6-Substraten, bei denen eine individuelle Dosiseinstellung erfolgt.
Einfluss von Mirabegron auf Transporter
- Mirabegron ist ein schwacher P-gp-Inhibitor.
- Bei gesunden Probanden erhöht Mirabegron die cmax und AUC des P-gp-Substrats Digoxin um 29% bzw. 27%.
- Bei Patienten, die eine Kombinationstherapie mit Mirabegron und Digoxin beginnen, sollte initial die niedrigste Digoxin-Dosis verordnet werden.
- Anschließend müssen die Digoxin-Serumkonzentrationen bestimmt werden, die dann die Grundlage für die Aufdosierung der Digoxin-Dosis bis zur gewünschten klinischen Wirkung bilden.
- Bei Kombination von Mirabegron mit sensitiven P-gp-Substraten wie Dabigatran muss die potenzielle Hemmung von P-gp durch Mirabegron berücksichtigt werden.
Kontraindikationen
Mirabegron ist kontraindiziert bei:
- Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels
- Schwerer, nicht ausreichend eingestellter Hypertonie (definiert als systolischer Blutdruck ≥ 180 mmHg und/oder diastolischer Blutdruck ≥ 110 mmHg)
Schwangerschaft
Es liegen nur begrenzt Daten zur Anwendung von Mirabegron bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt, weshalb die Anwendung von Mirabegron während der Schwangerschaft nicht empfohlen wird.
Stillzeit
Es wurden keine Studien zum Einfluss von Mirabegron auf die Milchproduktion beim Menschen, zum Auftreten in der menschlichen Muttermilch oder zu den Auswirkungen auf den gestillten Säugling durchgeführt, weshalb Mirabegron während der Stillzeit nicht angewendet werden sollte. Mirabegron wird bei Nagern in die Milch ausgeschieden, so dass zu erwarten ist, dass es beim Menschen in der Muttermilch auftritt.
Verkehrstüchtigkeit
Mirabegron hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Anwendungshinweise
Eingeschränkte Nierenfunktion
- Mirabegron wurde nicht bei Patienten mit terminaler Niereninsuffizienz (GFR < 15 mL/min/1,73 m2 oder dialysepflichtige Patienten) untersucht, weshalb die Einnahme in dieser Patientenpopulation nicht empfohlen wird.
- Es liegen nur begrenzt Daten zu Patienten mit starker Einschränkung der Nierenfunktion (GFR 15 bis 29 mL/min/1,73 m2) vor, sodass auf Grundlage der Ergebnisse einer Pharmakokinetik-Studie in dieser Population eine Dosisreduktion auf 25 mg empfohlen wird.
- Die Anwendung von Mirabegron bei Patienten mit starker Einschränkung der Nierenfunktion (GFR 15 bis 29 mL/min/1,73 m2), die gleichzeitig starke CYP3A-Inhibitoren erhalten, wird nicht empfohlen.
Eingeschränkte Leberfunktion
- Mirabegron wurde nicht bei Patienten mit starker Einschränkung der Leberfunktion (Child-Pugh-Klasse C) untersucht, weshalb die Anwendung in dieser Patientenpopulation nicht empfohlen wird.
- Darüber hinaus wird Mirabegron nicht für die Anwendung bei Patienten mit mäßiger Einschränkung der Leberfunktion (Child-Pugh-Klasse B) empfohlen, die gleichzeitig starke CYP3A-Inhibitoren erhalten.
Hypertonie
- Mirabegron kann den Blutdruck erhöhen, weshalb dieser vor Behandlungsbeginn und regelmäßig während der Behandlung mit Mirabegron gemessen werden sollte (insbesondere bei Patienten mit Hypertonie).
- Es liegen nur begrenzt Daten zu Patienten mit Hypertonie im Stadium 2 (systolischer Blutdruck ≥ 160 mmHg oder diastolischer Blutdruck ≥ 100 mmHg) vor.
Patienten mit kongenitaler oder erworbener QT-Verlängerung
- Mirabegron zeigt in therapeutischen Dosen keine klinisch relevanten QT-Verlängerungen in klinischen Studien.
- Da jedoch keine Patienten mit anamnestisch bekannter QT-Verlängerung oder unter Einnahme von bekanntermaßen das QT-Intervall verlängernden Arzneimitteln in diese Studien einbezogen waren, sind die Wirkungen von Mirabegron bei diesen Patienten nicht bekannt.
- Bei der Verschreibung von Mirabegron bei diesen Patienten ist daher Vorsicht geboten.
Patienten mit Blasenausgangsobstruktion und Patienten, die Antimuskarinika zur Behandlung einer OAB einnehmen
- Nach Markteinführung wurden Fälle von Harnverhalt unter der Behandlung mit Mirabegron bei Patienten mit einer Blasenausgangsobstruktion (BOO) und bei Patienten, die Antimuskarinika zur Behandlung einer OAB erhielten, berichtet.
- Eine kontrollierte klinische Studie zur Verträglichkeit bei Patienten mit BOO zeigte kein erhöhtes Risiko eines Harnverhalts bei Patienten, die mit Mirabegron behandelt wurden.
- Dennoch sollte Mirabegron bei Patienten mit klinisch signifikanter BOO mit Vorsicht angewendet werden.
- Dies gilt auch für Patienten, die Antimuskarinika zur Behandlung der OAB einnehmen.
Alternativen
Die medikamentösen Therapiealternativen richten sich nach dem Indikationsgebiet bzw. den Symptomen und sind darüber hinaus abhängig von patientenindividuellen Faktoren wie dem Alter der Patienten, Komorbiditäten oder dem Schweregrad der Erkrankung.
OAB
- Muskarinrezeptor-Antagonisten wie Oxybutynin, Propiverin. Trospium, Solifenacin, Darifenacin, Desfesoterodin, Fesoterodin und Tolterodin
- Botulinumneurotoxin A
Weitere Informationen können der jeweiligen Fachinformation entnommen werden.
Wirkstoff-Informationen
- EMA: Fachinformation Betmiga
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- AWMF: S2k-Leitlinie Medikamentöse Therapie der neurogenen Dysfunktion des unteren Harntraktes (NLUTD) (2022)













