Mosunetuzumab
Mosunetuzumab ist ein bispezifischer Antikörper gegen CD20 und CD3 zur Behandlung von rezidivierendem oder refraktärem follikulärem Lymphom.
Mosunetuzumab: Übersicht

Anwendung
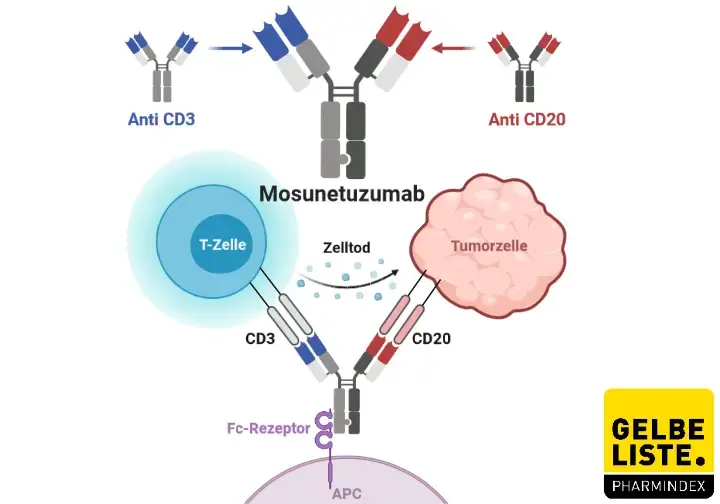
Mosunetuzumab (Lunsumio) des Pharmakonzerns Roche ist ein humanisierter, auf Immunglobulin G1 basierender bispezifischer Antikörper, der auf CD20 (B-Zellen) und CD3 (T-Zellen) abzielt. Mosunetuzumab führt zu einer Rekrutierung von T-Zellen, welche dann maligne B-Zellen angreifen und eliminieren.
Anwendungsart
Lunsumio ist als Konzentrat zur Herstellung einer Infusionslösung auf dem Markt und wird intravenös angewendet.
Das Medikament soll über 8 Zyklen verabreicht werden, es sei denn es kommt es zu inakzeptabler Toxizität oder Krankheitsprogression. Patienten, die nach der Behandlung mit 8 Zyklen von Lunsumio ein partielles Ansprechen (partial response - PR) oder eine stabile Erkrankung erreichen, sollen 9 Behandlungszyklen (insgesamt 17 Zyklen) verabreicht werden. Auch hier gilt: Ausnahme bildet eine inakzeptable Toxizität oder Krankheitsprogression.
Wirkmechanismus
Das Wirkprinzip von Mosunetuzumab besteht darin, dass einer der beiden Antikörperarme an das Antigen CD20 auf der Zelloberfläche der malignen B-Zellen und der zweite Arm das CD3-Antigen auf zytotoxischen T-Zellen bindet. Die hierdurch veranlasste räumliche Nähe begünstigt die effektive Abtötung der Krebszellen.
Dosierung
Zyklus 1
Infusionen von Lunsumio in Zyklus 1 sind über einen Zeitraum von mindestens 4 Stunden zu verabreichen.
- Tag 1: 1 mg Lunsumio
- Tag 8: 2 mg Lunsumio
- Tag 15 60 mg Lunsumio
Zyklus 2
Wenn die Infusionen in Zyklus 1 gut vertragen wurden, können nachfolgende Infusionen von Lunsumio über einen Zeitraum von 2 Stunden verabreicht werden.
- Tag 1: 60 mg Lunsumio
Zyklus 3 und weitere Zyklen
Wenn die Infusionen in Zyklus 1 gut vertragen wurden, können nachfolgende Infusionen von Lunsumio über einen Zeitraum von 2 Stunden verabreicht werden.
- Tag 1: 30 mg Lunsumio
Nebenwirkungen
Die am häufigsten berichteten Nebenwirkungen (≥ 20%) von Mosunetuzumab, die in den kontrollierten klinischen Studien auftraten, waren:
- Zytokin-Freisetzungs-Syndrom
- Neutropenie
- Fieber
- Hypophosphatämie
- Kopfschmerzen
Die häufigsten schwerwiegenden Nebenwirkungen (≥2%) waren:
- Zytokin-Freisetzungs-Syndrom
- Fieber
- Pneumonie
Wechselwirkungen
Bei der Anwendung von Mosunetuzumab kann es zu einer vorübergehenden klinisch relevanten Wirkung auf CYP450-Substrate mit engem therapeutischem Index (z. B. Warfarin, Voriconazol, Ciclosporin), kommen, da die Einleitung einer Behandlung mit Lunsumio einen vorübergehenden Anstieg der Zytokinspiegel verursacht, der eine Hemmung von CYP450-Enzymen bewirken kann.
Kontraindikationen
Mosunetuzumab darf nicht angewendet werden bei Überempfindlichkeit gegen den Antikörper oder einen der sonstigen Bestandteile des Arzneimittels.
Schwangerschaft
Es liegen keine Daten über die Anwendung von Mosunetuzumab bei Schwangeren vor. Tierexperimentelle Studien sind hinsichtlich der Reproduktionstoxizität unzureichend. Es wird deshalb nicht empfohlen Mosunetuzumab während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine Kontrazeption anzuwenden.
Stillzeit
Es ist nicht bekannt, ob Mosunetuzumab/-Metaboliten in die Muttermilch übergehen. Da ein Risiko für Neugeborene/Säuglinge nicht ausgeschlossen werden kann, soll während der Behandlung mit Mosunetuzumab nicht gestillt werden.
Verkehrstüchtigkeit
Mosunetuzumab hat geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Patienten, bei denen Ereignisse auftreten, die das Bewusstsein beeinträchtigen, sind entsprechend zu untersuchen und darauf hinzuweisen, nicht Auto zu fahren und keine schweren oder potenziell gefährlichen Maschinen zu bedienen, bis die Ereignisse abgeklungen sind.
Anwendungshinweise
Zytokin-Freisetzungs-Syndrom (CRS)
Unter der Anwendung von Lunsumio sind CRS, einschließlich lebensbedrohlicher Reaktionen aufgetreten. Anzeichen und Symptome umfassten Fieber, Schüttelfrost, Hypotonie,Tachykardie, Hypoxie und Kopfschmerzen. Infusionsbedingte Reaktionen sind klinisch möglicherweise nicht von Manifestationen eines CRS zu unterscheiden. CRS-Ereignisse traten überwiegend in Zyklus 1 auf und standen hauptsächlich mit der Verabreichung der Dosis an Tag 1 und Tag 15 in Zusammenhang.
Patienten sollen mindestens bis Zyklus 2 mit Kortikosteroiden, Antipyretika und Antihistaminika vorbehandelt werden. Vor der Verabreichung von Lunsumio müssen die Patienten ausreichend hydriert werden. Die Patienten sind auf Anzeichen oder Symptome eines CRS zu überwachen. Die Patienten sind anzuweisen, sofort einen Arzt aufzusuchen, falls zu irgendeinem Zeitpunkt Anzeichen oder Symptome von CRS auftreten. Ärzte müssen je nach Bedarf eine Behandlung mit unterstützenden Maßnahmen, Tocilizumab und/oder Kortikosteroiden, einleiten.
Schwerwiegende Infektionen
Bei Patienten, die Lunsumio erhielten, sind schwerwiegende Infektionen wie Pneumonie, Bakteriämie, Sepsis oder septischer Schock aufgetreten, von denen einige lebensbedrohlich waren oder tödlich verliefen. Darüber hinaus ist eine febrile Neutropenie möglich. Lunsumio darf deshalb während aktiver Infektionen nicht verabreicht werden. Vorsicht ist deshalb geboten bei Patienten:
- mit rezidivierenden oder chronischen Infektionen in der Anamnese (z. B. chronische, aktive Infektion mit dem Epstein-Barr-Virus),
- mit Grunderkrankungen, die für Infektionen prädisponieren können
- die zuvor eine intensive immunsuppressive Behandlung erhalten haben
Bei Bedarf können prophylaktisch antibakterielle, antivirale und/oder antimykotische Arzneimittel verabreicht werden. Vor und nach der Anwendung von Lunsumio müssen die Patienten auf Anzeichen und Symptome einer Infektion überwacht werden und entsprechend behandelt werden. Im Falle einer febrilen Neutropenie sind die Patienten auf eine Infektion zu untersuchen und gemäß den lokalen Richtlinien mit Antibiotika, Flüssigkeit und anderen unterstützenden Maßnahmen zu behandeln.
Schübe der Tumorerkrankung
Unter Lunsumio sind Schübe der Tumorerkrankung möglich. Zu den Manifestationen gehören neue oder sich verschlechternde Pleuraergüsse, lokalisierte Schmerzen und Schwellungen an den Stellen der Lymphomläsionen und Tumorentzündung. Spezifischen Risikofaktoren wurden nicht identifiziert. Bei Patienten mit großen Tumoren, die sich in unmittelbarer Nähe der Atemwege und/oder eines lebenswichtigen Organs befinden, besteht jedoch ein erhöhtes Risiko für Beeinträchtigungen und Morbidität aufgrund des Masseeffekts infolge der Schübe der Tumorerkrankung.
Tumorlysesyndrom (tumor lysis syndrome - TLS)
Bei Patienten, die Lunsumio erhielten, wurde über TLS berichtet. Vor der Verabreichung von Lunsumio müssen die Patienten ausreichend hydriert sein. Bei Bedarf sollen Patienten eine prophylaktische urikostatische Therapie (z. B. Allopurinol, Rasburicase) erhalten. Die Patienten sind auf Anzeichen oder Symptome eines TLS zu überwachen, insbesondere Patienten mit hoher Tumorlast oder schnell proliferierenden Tumoren sowie Patienten mit eingeschränkter Nierenfunktion. Die klinische Chemie der Patienten ist zu überwachen und auffällige Laborwerte sind umgehend zu behandeln.
Immunisierung
Während der Therapie Lunsumio dürfen keine Lebendimpfstoffe und/oder attenuierte Lebendimpfstoffe appliziert werden.
Patientenpass
Der verschreibende Arzt muss mit dem Patienten die Risiken der Therapie mit Lunsumio besprechen. Dem Patienten ist ein Patientenpass auszuhändigen und er ist anzuweisen, diesen stets bei sich zu tragen. Der Patientenpass beschreibt die üblichen Anzeichen und Symptome eines CRS und enthält Anweisungen, wann ein Patient ärztliche Hilfe in Anspruch nehmen muss.
- EMA: Fachinformation Lunsumio
- Budde, Lihua E., et al. "Single-agent mosunetuzumab shows durable complete responses in patients with relapsed or refractory B-cell lymphomas: phase I dose-escalation study." Journal of Clinical Oncology 40.5 (2022): 481-491.
- Assouline, Sarit E., et al. "Mosunetuzumab shows promising efficacy in patients with multiply relapsed follicular lymphoma: updated clinical experience from a phase I dose-escalation trial." Blood 136 (2020): 42-44.
Abbildung
Adapted from „ Bispecific Antibody Design”, by BioRender.com











