Nimodipin
Nimodipin ist ein 1,4-Dihydropyridin-Calciumkanalblocker, der spannungsabhängige Calciumkanäle vom L-Typ in ihrer inaktiven Konformation stabilisiert. Das Medikament wird angewendet zur Behandlung von hirnorganisch bedingten Leistungsstörungen oder ischämischer neurologischer Defizite infolge zerebraler Vasospasmen nach aneurysmatisch bedingter Subarachnoidalblutung.
Nimodipin: Übersicht
Anwendung
Nimodipin wird in Form von Filmtabletten angewendet zur Behandlung von hirnorganisch bedingten Leistungsstörungen im Alter mit deutlichen Beschwerden wie Gedächtnis-, Antriebs- und Konzentrationsstörungen sowie Stimmungslabilität.
Als Infusion kommt der Wirkstoff bei der Vorbeugung und Behandlung ischämischer neurologischer Defizite infolge zerebraler Vasospasmen nach aneurysmatisch bedingter Subarachnoidalblutung zum Einsatz.
Anwendungsart
Nimodipin ist in Deutschland in Form einer Infusionslösung und in Form von Filmtabletten verfügbar.
Wirkmechanismus
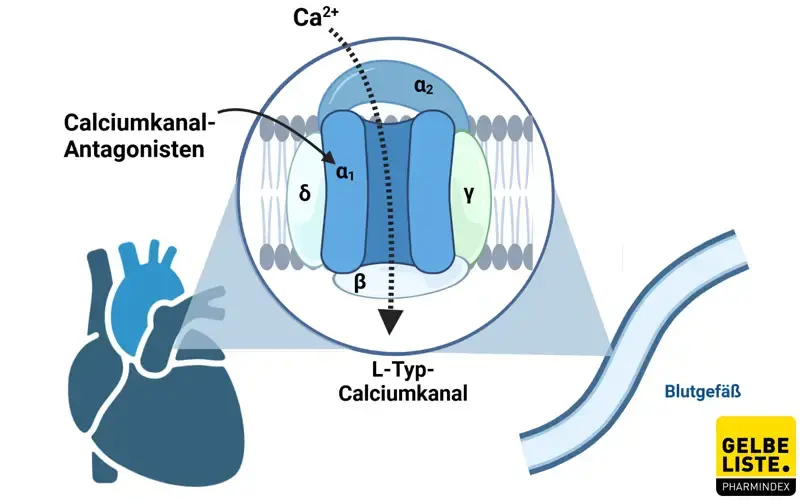
Nimodipin ist ein Calciumkanalantagonist der zur Wirkstoffgruppe der 1,4-Dihydropyridingruppe zählt. Der Wirkstoff bindet an Calciumkanäle vom L-Typ und verhindert so den transmembranösen Ca2+-Einstrom. Die kontraktilen Prozesse glatter Muskelzellen sind abhängig von Calciumionen, die während der Depolarisation als langsame ionische Transmembranströme in diese Zellen eintreten. Nimodipin hemmt den Calciumionentransfer in diese Zellen und hemmt somit die Kontraktionen der glatten Gefäßmuskulatur.
Aufgrund seiner hohen Lipophilie kann Nimodipin leicht die Blut-Hirn-Schranke passieren. Bei Hirnischämien kann es zu einem verstärkten Einstrom von Ca2+-Ionen in die Nervenzellen kommen, weshalb Nimodipin hier die Stabilität und Funktionsfähigkeit verbessert. Und neurologische vermindern kann.
Pharmakokinetik
Resorption
- Nach oraler Anwendung wird Nimodipin praktisch vollständig resorbiert.
- 10-15 Minuten nach der Einnahme werden bereits der unveränderte Wirkstoff und seine frühen „First-Pass"-Stoffwechselprodukte im Plasma detektiert.
- Bei älteren Menschen werden nach mehrfacher oraler Gabe (3-mal 30 mg täglich) mittlere maximale Plasmakonzentrationen (Cmax) von 7,3-43,2 ng/ml gemessen, die nach 0,6-1,6 Stunden (tmax) erreicht werden.
- bei jungen Menschen werden nach einer Einmaldosis von 30 mg bzw. 60 mg mittlere maximale Plasmakonzentrationen von 16±8 ng/ml bzw. 31 ±12 ng/ml gemessen.
- Die maximale Plasmakonzentration und die Fläche unter der Kurve (AUC) steigen bis zur höchsten geprüften Dosierung von 90 mg dosisproportional an.
- Bei Dauerinfusion von 0,03 mg/kg/h werden mittlere Steady-State-Plasmakonzentrationen von 17,6-26,6 ng/ml erreicht.
- Nach intravenöser Bolusinjektion fallen die Nimodipin-Plasmakonzentrationen biphasisch mit Halbwertszeiten von 5-10 Minuten und von etwa 60 Minuten ab.
- Das Verteilungsvolumen wird bei i.v. Gabe zu 0,9-1,6 l/kg KG berechnet.
- Die totale (systemische) Clearance beträgt 0,6-1,9 l/h/kg.
Verteilung
- Nimodipin wird zu 97-99% an Plasmaproteine gebunden und sich im Tierversuch als plazentagängig erwiesen.
- Nimodipin hat in der Muttermilch vergleichbarer Konzentrationen wie im Plasma.
- Nach oraler und i.v. Gabe wurde Nimodipin in der Cerebrospinalflüssigkeit in Konzentrationen nachgewiesen, die ca. 0,5% der gemessenen Plasmakonzentrationen betragen.
Biotransformation, Elimination und Exkretion
- Nimodipin wird über das Cytochrom-P450-3A4-System metabolisch eliminiert. Dabei stehen die Dehydrogenierung des Dihydropyridin-Ringes und die oxidative Esterspaltung im Vordergrund.
- Die oxidative Esterspaltung, die Hydroxylierung der 2- und 6-Methyl-Gruppe und die Glukuronidierung als Konjugationsreaktion sind weitere wichtige Metabolisierungsschritte.
- Die im Plasma auftretenden drei primären Metaboliten zeigen keine oder nur therapeutisch unbedeutende Restaktivität.
- Eine Beeinflussung der Leberenzyme durch Induktion oder Hemmung ist nicht bekannt.
- Die Metaboliten werden beim Menschen zu ca. 50% renal und zu ca. 30% biliär eliminiert.
- Die Eliminationskinetik ist linear.
- Die Halbwertszeit für Nimodipin beträgt zwischen 1,1 und 1,7 Stunden.
- Die terminale Halbwertszeit von 5 bis 10 Stunden ist für die Festlegung des Dosisintervalls nicht von Bedeutung.
Bioverfügbarkeit
Aufgrund der hohen Metabolisierungsrate bei der ersten Leberpassage („First-Pass" ca. 85 bis 90%) beträgt die absolute Bioverfügbarkeit 5 bis 15%.
Dosierung
Die empfohlene Tagesdosis beträgt bei der Behandlung von hirnorganisch bedingten Leistungsstörungen im Alter 3-mal täglich 30 mg Nimodipin.
Zur Vorbeugung und Behandlung ischämischer neurologischer Defizite infolge zerebraler Vasospasmen nach aneurysmatisch bedingter Subarachnoidalblutung beträgt die empfohlene Dosis zu Beginn der Behandlung 1 mg Nimodipin/Std. für die Dauer von 2 Stunden (ca.15 μg/kg Körpergewicht/Std.),verabreicht als intravenöse Dauerinfusion. Bei guter Verträglichkeit, insbesondere beim Fehlen von stärkeren Blutdrucksenkungen, Erhöhung der Dosis nach der 2. Stunde auf 2 mg Nimodipin/Std. (ca. 30 μg/kg Körpergewicht/Std.). Bei Patienten mit deutlich niedrigerem Körpergewicht als 70 kg oder labilen Blutdruckverhältnissen sollte mit einer Dosierung von 0,5 mg Nimodipin/Std. begonnen werden.
Prophylaktische Gabe:
Die intravenöse Behandlung sollte nicht länger als 4 Tage nach der Blutung beginnen und während der Periode der größten Gefahr der Entwicklung eines Vasospasmus, d. h. bis zum 10. bis 14. Tag nach der Subarachnoidalblutung, fortgesetzt werden.
Nach Abschluss der Infusionsbehandlung wird für etwa 7 weitere Tage die orale Gabe von 6×60 mg Nimodipin im Abstand von 4 Stunden empfohlen.
Therapeutische Gabe:
Bei bereits bestehenden, durch Vasospasmus bedingten ischämischen neurologischen Störungen nach einer Subarachnoidalblutung sollte die Behandlung so früh wie möglich beginnen und für mindestens 5 und maximal 14 Tage fortgesetzt werden. Anschließend wird für die Dauer von 7 Tagen die orale Gabe von 6× täglich 60 mg Nimodipin im Abstand von 4 Std. empfohlen.
Nebenwirkungen
Die häufigste unter der Anwendung von Nimodipin gemeldeten Nebenwirkungen (≥ 1/100 bis < 1/10) sind Hypotonie und/oder Vasodilatation.
Wechselwirkungen
Nimodipin wird über CYP3A4 metabolisiert. Daher kann es bei gleichzeitiger Anwendung von Arzneimitteln, die dieses System induzieren oder hemmen, zu Wechselwirkungen kommen.
Darüber hinaus kann der blutdrucksenkende Effekt von gleichzeitig verabreichten Antihypertensiva durch Nimodipin verstärkt werden.
In einer experimentellen Untersuchung an Affen führte die gleichzeitige intravenöse Gabe des HIV-Medikaments Zidovudin und Nimodipin als i.v.-Bolus-Gabe zu signifikant erhöhten Zidovudin-Plasmaspiegeln (AUC), wohingegen das Verteilungsvolumen und die Clearance signifikant verringert wurden.
Bei gleichzeitiger Behandlung mit potenziell nephrotoxischen Arzneimitteln (z. B. Aminoglykoside, Cephalosporine, Furosemid) sowie bei Patienten mit eingeschränkter Nierenfunktion kann sich die Nierenfunktion verschlechtern. In diesen Fällen ist deshalb eine sorgfältige Überwachung der Nierenfunktion angezeigt. Kommt es zu einer Verschlechterung der Nierenfunktion sollte ein Abbruch der Behandlung erwogen werden.
Da Grapefruitsaft das CYP3A4 hemmt, kann es bei gleichzeitiger Verabreichung aufgrund eines verringerten First-Pass-Metabolismus oder einer verlangsamten Ausscheidung zu erhöhten Plasmakonzentrationen und zu einer verlängerten Wirkdauer von Nimodipin kommen. Dadurch kann die blutdrucksenkende Wirkung verstärkt sein. Dieser Effekt kann über mindestens 4 Tage nach der letzten Einnahme von Grapefruitsaft anhalten. Während der Nimodipin-Behandlung ist deshalb der Genuss von Grapefruitsaft zu vermeiden.
Die gleichzeitige Verabreichung von Nimodipin und dem Antidepressivum Fluoxetin führte im Steady-State zu etwa 50% höheren Plasmakonzentrationen an Nimodipin. Der Fluoxetin-Plasmaspiegel war deutlich erniedrigt, während der aktive Metabolit Norfluoxetin davon nicht betroffen war.
Die gleichzeitige Anwendung von Nimodipin und Nortriptylin führte im Steady-State zu einer leichten Abnahme der Nimodipin-Exposition bei unveränderten Nortriptylin-Plasmakonzentrationen.
Kontraindikationen
Nimodipin darf nicht angewendet werden bei
- Überempfindlichkeit gegen den Wirkstoff
- gleichzeitiger Anwendung von Rifampicin oder den Antiepileptika Phenobarbital, Phenytoin und Carbamazepin, da durch diese Arzneimittel die Wirksamkeit von Nimodipin signifikant verringert werden kann.
Zusätzlich für die Indikation Behandlung von hirnorganisch bedingten Leistungsstörungen im Alter:
- schweren Leberfunktionsstörungen, insbesondere Leberzirrhose, da aufgrund einer reduzierten First-Pass-Kapazität und einer verringerten metabolischen Clearance die Bioverfügbarkeit von Nimodipin erhöht sein kann. Deshalb darf Nimodipin bei Patienten mit schwerer Leberfunktionsstörung (z. B. Leberzirrhose) nicht zur Behandlung von Hirnleistungsstörungen angewandt werden.
Schwangerschaft
Erfahrungen aus geeigneten und kontrollierten klinischen Studien mit Schwangeren liegen nicht vor. Wenn Nimodipin während der Schwangerschaft angewendet werden soll, müssen daher Nutzen und mögliche Risiken entsprechend der Schwere des Krankheitsbildes gegeneinander abgewogen werden.
Stillzeit
Nimodipin und seine Metaboliten treten in der Muttermilch in Konzentrationen von vergleichbarer Größenordnung wie im Plasma der Mutter auf. Mütter sollten daher währendder Behandlung nicht stillen.
Verkehrstüchtigkeit
Nimodipin kann auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass die Fähigkeit zum Bedienen von Maschinen oder zur aktiven Teilnahme am Straßenverkehr beeinträchtigt sein kann. Dies gilt im verstärkten Maße im Zusammenwirken mit Alkohol.
Anwendungshinweise
Bei instabiler Angina pectoris oder innerhalb der ersten vier Wochen nach einem akuten Herzinfarkt sollte das potenzielle Risiko (z. B. einer reduzierten Durchblutung der Koronararterie und myokardialen Ischämie) gegen den Nutzen (z. B. Verbesserung der Hirndurchblutung) abgewogen werden.
Bei gleichzeitiger Behandlung mit potenziell nephrotoxischen Arzneimitteln (z. B. Aminoglykoside, Cephalosporine, Furosemid) sowie bei Patienten mit eingeschränkter Nierenfunktion kann sich die Nierenfunktion verschlechtern.
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
- Fachinformation Nimodipin Carinopharm 10 mg/50 ml Infusionslösung
- Fachinformation Nimodipin HEXAL 30 mg, Filmtbl.
- Carlson AP, Hänggi D, Macdonald RL, Shuttleworth CW. Nimodipine Reappraised: An Old Drug With a Future. Curr Neuropharmacol. 2020;18(1):65-82. doi: 10.2174/1570159X17666190927113021 . PMID: 31560289 ; PMCID: PMC7327937.
Abbildung
Dr. Isabelle Viktoria Maucher, Created with Biorender
-
NIMODIPIN ALTAN 200 Mikrogramm/ml Infusionslösung, 50 ml
Ethypharm GmbH
-
Nimodipin Carinopharm 10 mg/50 ml Infusionslösung
CARINOPHARM GmbH
-
Nimodipin HEXAL® 30 mg, Filmtabletten
Hexal AG
-
Nimotop®, 30 mg, Filmtabletten
ALTAMEDICS GmbH
-
Nimotop 30 mg Filmtabletten Saudi-Arabien
ALTAMEDICS GmbH
-
Nimotop® S, 10 mg/50 ml, Infusionslösung
ALTAMEDICS GmbH
-
Nimotop® S, 30 mg, Filmtabletten
ALTAMEDICS GmbH
-
Nimotop, 30 mg ACA Filmtabletten
A.C.A. Müller ADAG Pharma AG
-
Nimotop, 30 mg Beragena Filmtabletten
Docpharm GmbH
-
Nimotop, 30 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH













