Ofatumumab
Ofatumumab ist ein monoklonaler Antikörper der sich gegen das Oberflächenantigen CD20 von B-Zellen richtet. Der Wirkstoff wird zur Behandlung von erwachsenen Patienten mit schubförmig verlaufender Multipler Sklerose mit aktiver Erkrankung eingesetzt. Zur Behandlung der chronisch lymphatischen Leukämie (CLL) wird Ofatumumab in der EU nicht mehr eingesetzt.
Ofatumumab : Übersicht
Anwendung
Der monoklonale Antikörper Ofatumumab ist unter dem Präparatenamen Kesimpta der Firma Novartis indiziert zur Behandlung von erwachsenen Patienten mit schubförmig verlaufender Multipler Sklerose (Relapsing Multiple Sclerosis, RMS) mit aktiver Erkrankung, definiert durch klinischen Befund oder Bildgebung.
Zuvor wurde Ofatumumab unter dem Namen Arzerra auch zur Behandlung von Patienten mit chronisch lymphatischer Leukämie (CLL) angewendet, die refraktär auf Fludarabin und Alemtuzumab sind. Das Unternehmen Genzyme hatte jedoch Alemtuzumab (MabCampath) aus wirtschaftlichen Gründen vom Markt genommen.Seitdem der Kombinationspartner fehlt, können Onkologen Ofatumumab formal nicht mehr entsprechend der Zulassung einsetzen, weshalb es aktuell in Europa innerhalb dieser Indikation nicht mehr angewendet wird.
Anwendungsart
Kesimpta ist als 20 mg Lösung zur Selbstverabreichung durch den Patienten mittels monatlicher subkutaner Injektion vorgesehen.
Wirkmechanismus
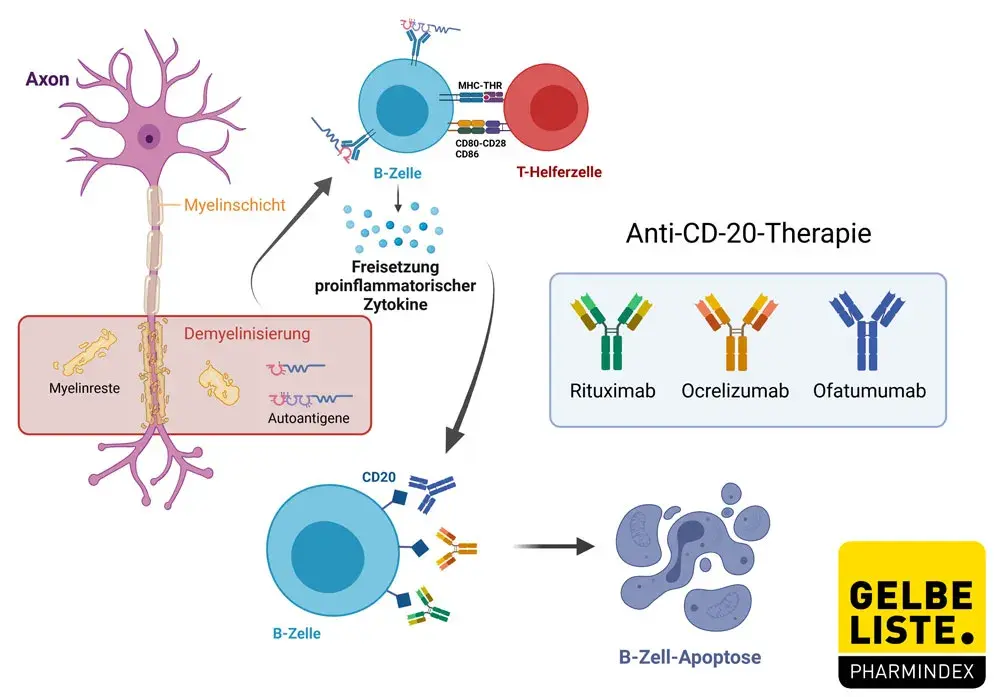
Ofatumumab ist ein humaner monoklonaler Antikörper (IgG1), der spezifisch an ein Epitop bindet, das die kleine und die große extrazellulären Schleifen des CD20-Moleküls umfasst. Das CD20-Molekül wird von B-Lymphozyten und auf B-Zell-Tumoren exprimiert.
Die Bindung von Ofatumumab an CD20 führt hauptsächlich mittels komplementabhängiger Zytolyse (Complement-dependent Cytotoxicity, CDC), in geringerem Umfang aber auch über die antikörperabhängige zellvermittelte Zytotoxizität (Antibody-dependent Cell-mediated Cytotoxicity, ADCC) zur Lyse CD20-positiver B-Zellen. Ofatumumab induziert hierbei sowohl eine Lyse von Zellen mit niedriger CD20-Expression als auch von Rituximab-resistenten Zellen.
Darüber hinaus wurde für Ofatumumab gezeigt, dass sowohl von Zellen mit hoher als auch niedriger CD20-Expression eine Lyse induziert und auch CD20 exprimierende T-Zellen zerstört.
Pharmakokinetik
Resorption
- Eine monatliche subkutane Dosis von 20 mg führt zu einer mittleren AUCtau von 483 μg*h/ml und einer mittleren Cmax von 1,43 μg/ml im Steady State.
- Es wird angenommen, dass Ofatumumab nach subkutaner Anwendung ähnlich wie andere therapeutische monoklonale Antikörper hauptsächlich über das Lymphsystem resorbiert wird.
Verteilung
Das Verteilungsvolumen im Steady State nach wiederholter subkutaner Verabreichung von Ofatumumab in einer Dosis von 20 mg wurde auf 5,42 Liter geschätzt.
Biotransformation
Ofatumumab ist ein Protein, für das der zu erwartende Stoffwechselweg im Abbau zu kleinen Peptiden und einzelnen Aminosäuren durch ubiquitär vorkommende proteolytische Enzyme besteht.
Elimination
Ofatumumab wird auf zwei Wegen eliminiert:
- einem zielvermittelten Weg, der in Zusammenhang mit der Bindung an B-Zellen steht, und
- einem zielunabhängigen Weg mit unspezifischer Endozytoseund nachfolgendem intrazellulärem Abbau wie bei anderen IgG-Molekülen.
Die zu Behandlungsbeginn vorhandenen B-Zellen führen zu einem größeren Anteil der zielvermittelten Clearance von Ofatumumab bei Einleitung der Therapie. Die Gabe von Ofatumumab bedingt eine wirksame Depletion der B-Zellen, was zu einer verminderten Gesamtclearance führt.
Die Halbwertszeit im Steady State nach wiederholter subkutaner Verabreichung von Ofatumumab in einer Dosis von 20 mg wurde auf ca. 16 Tage geschätzt.
Linearität/Nicht-Linearität
Da die Clearance mit der Zeit abnimmt, zeigt Ofatumumab eine nicht-lineare Pharmakokinetik.
Dosierung
Die empfohlene Dosis bei der Behandlung schubförmig verlaufender Multipler Sklerose beträgt 20 mg Ofatumumab als subkutane Injektion mit Initialdosen in den Wochen 0, 1 und 2 gefolgt von anschließenden monatlichen Dosen beginnend ab Woche 4.
Nebenwirkungen
Die wichtigsten und am häufigsten gemeldeten Nebenwirkungen sind:
- Infektionen der oberen Atemwege (39,4%)
- Systemische injektionsbedingte Reaktionen (20,6%)
- Reaktionen an der Injektionsstelle (10,9%)
- Harnwegsinfektionen (11,9%)
Wechselwirkungen
Folgende Wechselwirkungen sind bei der Anwendung von Ofatumumab zu beachten:
- Die Immunantwort auf einen Impfstoff könnte unter Depletion von B-Zellen beeinträchtigt sein. Es wird empfohlen, dass Patienten Impfungen vor Beginn der Therapie mit Ofatumumab abschließen.
- Bei gleichzeitiger Anwendung anderer immunsupprimierender Therapien mit Ofatumumab ist das Risiko für additive Wirkungen auf das Immunsystem zu berücksichtigen.
- Bei Beginn der Behandlung mit Ofatumumab nach einer anderen immunsupprimierenden Therapie mit langfristigen Auswirkungen auf das Immunsystem oder Beginn der Behandlung mit einer solchen Therapie nach einer Behandlung mit Ofatumumab sind aufgrund möglicher additiver immunsupprimierender Wirkungen die Wirkdauer und der Wirkmechanismus dieser Arzneimittel zu berücksichtigen.
Kontraindikation
Ofatumumab darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff, oder einen der genannten sonstigen Bestandteile
- Stark immungeschwächte Patienten
- Schwerer aktiver Infektion, bis diese abgeklungen ist
- Bekannter aktiver maligner Erkrankung
Schwangerschaft/Stillzeit
Neben erwarteten pharmakologischen Wirkungen, insbesondere der B-Zell-Depletion, haben tierexperimentelle Studien keinen Hinweis auf direkte oder indirekte schädliche Wirkungen in Bezug auf maternale Toxizität, Schwangerschaft oder embryo- fetale Entwicklung ergeben. Eine Behandlung mit Ofatumumab sollte nicht während der Schwangerschaft erfolgen, es sei denn, der mögliche Nutzen für die Mutter übersteigt das mögliche Risiko für das ungeborene Kind.
Frauen im gebärfähigen Alter müssen während und bis zu 12 Monate nach der letzten Behandlung mit Ofatumumab eine zuverlässige Verhütungsmethode anwenden.
Es ist nicht bekannt, ob Ofatumumab in die Muttermilch übergeht; Menschliche IgG-Globuline werden jedoch bekanntermaßen in die Muttermilch abgegeben. Veröffentlichte Daten deuten darauf hin, dass das Stillen von Neugeborenen und Kleinkindern nicht zu einer wesentlichen Aufnahme dieser mütterlichen Antikörper in den Blutkreislauf führt. Das Stillen soll für die Dauer der Behandlung mit Ofatumumab und für weitere 12 Monate danach unterbrochen werden.
Verkehrstüchtigkeit
Der klinische Zustand des Patienten und das Nebenwirkungsprofil von Ofatumumab sollten bei der Beurteilung der Fähigkeit des Patienten, Tätigkeiten zu verrichten, die Urteilsvermögen, motorische oder kognitive Fertigkeiten erfordern, in Betracht gezogen werden.













