Ozanimod
Der Wirkstoff Ozanimod ist eine neue Behandlungsoption zur Erstlinientherapie von Patienten mit schubförmig remittierender Multipler Sklerose (RRMS). Ozanimod ist neben Fingolimod und Siponimod der dritte S1P-Rezeptor-Modulator zur Behandlung der Multiplen Sklerose.
Ozanimod: Übersicht
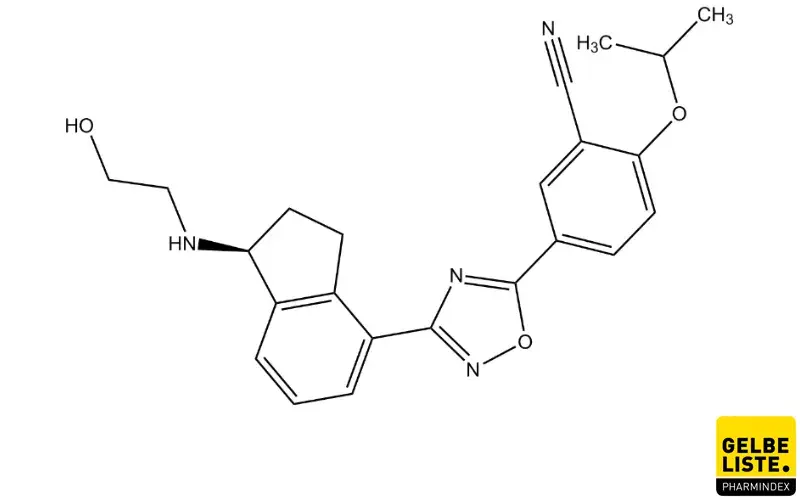
Anwendung
Ozanimod wird bei erwachsenen Patienten mit schubförmig remittierender Multipler Sklerose (RRMS) mit aktiver Erkrankung angewendet, die durch klinische oder bildgebende Befunde definiert wurde. Etwa 85 Prozent der MS-Patienten weisen bei der Erstdiagnose eine RRMS auf, während bei 10 bis 15 Prozent eine progressive MS-Form vorliegt.
Anwendungsart
Ozanimod unterliegt der Verschreibungspflicht und ist in Form von Kapseln (0,23, 0,46 und 0,92 mg) für die orale Anwendung vorgesehen. Um das Risiko von kardialen Nebenwirkungen zu reduzieren, sollte die Dosis zu Therapiebeginn oder nach längerer Unterbrechung der Behandlung langsam aufgebaut werden.
Wirkmechanismus
Das Immunsuppressivum Ozanimod ist ein Modulator der Sphingosin-1-Phosphat (S1P)-Rezeptorsubtypen 1 und 5. Ozanimod führt zur Lymphozytenretention in lymphoiden Geweben. Der Mechanismus über den Ozanimod seine therapeutischen Wirkungen bei Multipler Sklerose entfaltet ist nicht bekannt. Es wird angenommen, dass eine Verringerung der Lymphozytenmigration in das Zentralnervensystem zur Wirkung beitragen könnte.
Pharmakokinetik
Ozanimod unterliegt einer umfangreichen Metabolisierung und wird zu einer Reihe von zirkulierenden aktiven Metaboliten abgebaut. Darunter die zwei aktiven Hauptmetaboliten CC112273 und CC1084037, welche eine ähnliche Aktivität und Selektivität für S1P1 und S1P5 wie Ozanimod aufweisen.
Resorption
- Die Tmax von Ozanimod beträgt etwa 6 bis 8 Stunden, die von CC112273 ungefähr 10 Stunden.
- Die Einnahme zusammen mit einer fett- und kalorienreichen Mahlzeit hatte keinen Einfluss auf die Bioverfügbarkeit von Ozanimod (Cmax und AUC). Daher kann Ozanimod unabhängig von Mahlzeiten eingenommen werden.
Verteilung
- Das mittlere (CV %) scheinbare Verteilungsvolumen von Ozanimod (Vz/F) lag bei 5590 l (27%), was auf eine umfangreiche Verteilung in Geweben hindeutet.
- Die Bindung von Ozanimod an menschliche Plasmaproteine beträgt etwa 98,2%.
- Die Bindung von CC112273 und CC1084037 an menschliche Plasmaproteine beträgt ungefähr 99,8% bzw. 99,3%.
Biotransformation
- Ozanimod wird über unterschiedliche Biotransformationspfade, darunter die Aldehyddehydrogenase und die Alkoholdehydrogenase (ALDH/ADH), die Cytochrom-P450-(CYP)-Isoformen 3A4 und 1A1 und die mikrobielle Darmflora, weitgehend abgebaut.
- Nach mehrmaliger Gabe liegen die AUCs der zwei aktiven Hauptmetaboliten CC112273 und CC1084037 um das 13- bzw. 2,5-Fache über der AUC von Ozanimod.
- Die Monoaminoxidase B (MAO-B) scheint für die Bildung von CC112273 (über den kleinen aktiven Zwischenmetaboliten RP101075) verantwortlich zu sein, während CYP2C8 und die Oxidoreduktasen an der Metabolisierung von CC112273 beteiligt sind.
- CC1084037 wird direkt aus CC112273 gebildet und unterliegt einer reversiblen Metabolisierung zu CC112273.
- Die Interkonvertierung dieser zwei aktiven Metaboliten wird durch Carbonylreduktasen, die Alkoholdehydrogenase 1C1/1C2 und/oder durch 3β- und 11β-Hydroxysteroiddehydrogenase (HSD) vermittelt.
Elimination
- Die mittlere (CV %) scheinbare orale Clearance von Ozanimod betrug ungefähr 192 l/h (37%).
- Die mittlere (CV %) Plasma-Halbwertszeit (t1/2) lag bei ungefähr 21 Stunden (15%).
- Ozanimod erreichte seinen Steady-State innerhalb von 7 Tagen; die geschätzte Akkumulationsrate nach mehrmaliger oraler Gabe von 0,92 mg einmal täglich lag bei etwa 2.
- Die auf einem Modell basierende mittlere (CV %) effektive Halbwertszeit von CC112273 betrug bei Patienten mit RMS etwa 11 Tage (104 %), bei einer mittleren (CV %) Zeitdauer bis zum Steady-State von ungefähr 45 Tagen (45%) und einer Akkumulationsrate von etwa 16 (101%), was darauf hindeutet, dass CC112273 gegenüber Ozanimod vorherrscht.
- Die Plasmaspiegel von CC112273 und seinem direkten interkonvertierenden Metabolit CC1084037 nahmen in der terminalen Phase parallel ab und ergaben eine ähnliche t1/2 für beide Metaboliten.
- Es wird erwartet, dass das Erreichen des Steady-States und die Akkumulationsrate von CC1084037 der von CC112273 ähnlich sein werden.
- Nach einer oralen Einzeldosis von 0,92 mg [14C]-Ozanimod wurden etwa 26 % der Radioaktivität im Urin und 37% in den Fäzes wiedergefunden, vorwiegend in Form von inaktiven Metaboliten.
- Die Konzentrationen von Ozanimod, CC112273 und CC1084037 im Urin waren vernachlässigbar gering und deuteten darauf hin, dass die renale Clearance kein wichtiger Ausscheidungsweg von Ozanimod, CC112273 und CC1084037 ist.
Dosierung
Die Anfangsdosis beträgt 0,23 mg Ozanimod pro Tag für die ersten 4 Tage; Die Patienten sollten dann 3 Tage lang (an den Tagen 5, 6 und 7) eine Kapsel mit 0,46 mg pro Tag und ab dem 8. Tag täglich eine Kapsel mit 0,92 mg täglich einnehmen.
Nebenwirkungen
Die am häufigsten gemeldeten Nebenwirkungen sind:
- Nasopharyngitis (11 %),
- erhöhte Alaninaminotransferase (5 %)
- erhöhte Gamma-Glutamyltransferase (5 %).
Die häufigsten unerwünschten Arzneimittelwirkungen, die zum Behandlungsabbruch führten, hingen mit erhöhten Leberenzymen zusammen (1,1 %).
Wechselwirkungen
Mit folgenden Arzneimitteln können Wechselwirkungen bei der gleichzeitigen Anwendung mit Ozanimod auftreten:
- Brustkrebsresistenzprotein (BCRP) -Inhibitoren (Ciclosporin, Eltrombopag)
- CYP2C8-Inhibitoren (z. B. Gemfibrozil, Clopidogrel)
- CYP2C8-Induktoren (z. B. Rifampicin)
- Monoaminoxidase-Inhibitoren (z. B. Selegilin, Phenelzin)
- Arzneimittel, welche die Herzfrequenz oder die atrioventrikuläre Erregungsleitung verlangsamen (z. B. Betablocker oder Calciumkanalblocker)
- Eine Impfung während der Behandlung mit Ozanimod sowie bis zu 3 Monate danach kann weniger wirksam sein. Die Anwendung von attenuierten Lebendimpfstoffen kann ein Infektionsrisiko bergen und sollte daher während der Behandlung mit Ozanimod und für bis zu 3 Monate danach vermieden werden.
- Antineoplastische, immunmodulatorische oder nicht-kortikosteroidhaltige immunsuppressive Therapien
Kontraindikation
Ozanimod darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff oder einen genannten sonstigen Bestandteile
- Immunschwäche
- Patienten, die in den letzten 6 Monaten einen Myokardinfarkt, instabile Angina pectoris, einen Schlaganfall, eine transitorische ischämische Attacke (TIA), eine dekompensierte Herzinsuffizienz mit erforderlicher stationärer Behandlung oder eine Herzinsuffizienz der New York Heart Association (NYHA) Klasse III/IV hatten
- Patienten mit anamnestisch bekanntem oder aktuell vorliegendem atrioventrikulärem (AV) Block 2. Grades, Typ II, oder AV-Block 3. Grades oder Sick-Sinus-Syndrom, es sei denn, der Patient trägt einen funktionierenden Herzschrittmacher
- Schweren aktiven Infektionen, aktiven chronischen Infektionen wie Hepatitis und Tuberkulose
- Aktiven malignen Erkrankungen
- Schwerer Leberfunktionseinschränkung (Child-Pugh-Klasse C)
- Schwangerschaft und Frauen im gebärfähigen Alter, die keine zuverlässige Methode zur Empfängnisverhütung anwenden
Schwangerschaft/Stillzeit
Aufgrund des Risikos für den Fötus ist Ozanimod während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine zuverlässige Methode zur Empfängnisverhütung anwenden, kontraindiziert. Ozanimod und seine Metabolite werden während der Laktation bei behandelten Tieren in die Milch ausgeschieden. Aufgrund des Potenzials für schwerwiegende unerwünschte Arzneimittelwirkungen sollen Frauen, die mit Ozanimod behandelt werden, nicht stillen.
Verkehrstüchtigkeit
Ozanimod hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Klinische Studien
Die Zulassung von Ozanimod (Zeposia) basiert auf Daten aus den zwei klinischen Phase-III-Studien SUNBEAM (NCT02294058) und RADIANCE (NCT01628393) mit insgesamt 2.666 RRMS-Patienten.
Die Studien konnten zeigen, dass Ozanimod im Vergleich zu Interferon beta-1a (Avonex) eine starke Wirksamkeit aufwies. Diese wurde an der annualisierten Rückfallrate, der Anzahl und Größe der Hirnläsionen und dem Rückgang des Hirnvolumens gemessen.
In der ersten Studie, die länger als ein Jahr dauerte, war die durchschnittliche Anzahl von Rückfällen pro Jahr bei Patienten, die mit der Standarddosis von Zeposia behandelt wurden, etwa halb so hoch wie bei Patienten die mit Interferon beta-1a, behandelt wurden (0,18 gegenüber 0,35 Rückfällen).
In der zweiten Studie (SUNBEAM), die zwei Jahre dauerte, hatten Patienten, die mit der Standarddosis Zeposia behandelt wurden, durchschnittlich 0,17 Rückfälle pro Jahr, verglichen mit 0,28 bei Patienten, denen Interferon beta-1a verabreicht wurde.
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Fachinformation Zeposia
-
Zeposia 0,23 mg/0,46 mg 2care4 Hartkapseln Starterpackung
2care4 ApS
-
Zeposia 0,23 mg/0,46 mg Abacus Hartkapseln Starterpackung
Abacus Medicine A/S
-
Zeposia 0,23 mg/0,46 mg Eurim Hartkapseln Starterpackung
Eurim-Pharm Arzneimittel GmbH
-
Zeposia® 0,23 mg/0,46 mg Hartkapseln Starterpackung
Bristol-Myers Squibb GmbH & Co. KGaA
-
Zeposia 0,23 mg/0,46 mg kohlpharma Hartkapseln Starterpackung
kohlpharma GmbH
-
Zeposia 0,23 mg/0,46 mg Orifarm Hartkapseln Starterpackung
Orifarm GmbH
-
Zeposia 0,92 mg 2care4 Hartkapseln
2care4 ApS
-
Zeposia 0,92 mg Abacus Hartkapseln
Abacus Medicine A/S
-
Zeposia 0,92 mg axicorp Hartkapseln
axicorp Pharma B.V.
-
Zeposia 0,92 mg CC Pharma Hartkapseln
CC Pharma GmbH
-
Zeposia 0,92 mg Haemato Pharm Hartkapseln
HAEMATO PHARM GmbH
-
Zeposia® 0,92 mg Hartkapseln
Bristol-Myers Squibb GmbH & Co. KGaA
-
Zeposia 0,92 mg kohlpharma Hartkapseln
kohlpharma GmbH
-
Zeposia 0,92 mg Medicopharm Hartkapseln
Medicopharm AG
-
Zeposia 0,92 mg Orifarm Hartkapseln
Orifarm GmbH
-
Zeposia 0,92 mg Paranova Hartkapseln
Paranova Pack A/S
-
Zeposia 0,92 mg SynCo pharma Hartkapseln
SynCo pharma B.V.