Pembrolizumab
Pembrolizumab ist ein monoklonaler Antikörper und gehört zur Wirkstoffgruppe der PD-1-Inhibitoren. Das Medikament ist zugelassen zur Behandlung des fortgeschrittenen Melanoms, des nicht kleinzelligen Bronchialkarzinoms, des Hodgkin-Lymphoms, von Urothelkarzinomen und Tumoren im Kopf- und Hals-Bereich.
Pembrolizumab: Übersicht
Anwendung
Der Checkpoint-Inhibitor Pembrolizumab ist zugelassen als:
- Monotherapie zur Behandlung des fortgeschrittenen (nicht resezierbaren oder metastasierten) Melanoms
- Monotherapie zur adjuvanten Behandlung des Melanoms im Tumorstadium III mit Lymphknotenbeteiligung nach vollständiger Resektion
- Monotherapie zur Erstlinienbehandlung des metastasierten nicht-kleinzelligen Lungenkarzinoms (NSCLC) mit PD-L1 exprimierenden Tumoren (TPS ≥ 50%) ohne EGFR- oder ALK-positive Tumormutationen
- Kombination mit Pemetrexed und Platin-Chemotherapie zur Erstlinienbehandlung des metastasierten nicht-plattenepithelialen NSCLC ohne EGFR- oder ALK-positiven Tumormutationen
- Kombination mit Carboplatin und entweder Paclitaxel oder nab-Paclitaxel zur Erstlinienbehandlung des metastasierten plattenepithelialen NSCLC
- Monotherapie zur Behandlung des lokal fortgeschrittenen oder metastasierten NSCLC mit PD-L1 exprimierenden Tumoren (TPS ≥ 1%) nach vorheriger Chemotherapie. Patienten mit EGFR- oder ALK-positiven Tumormutationen sollten vor der Therapie mit Pembrolizumab ebenfalls eine auf diese Mutationen zielgerichtete Therapie erhalten haben.
- Monotherapie zur Behandlung des rezidivierten oder refraktären klassischen Hodgkin-Lymphoms (HL) nach Versagen einer autologen Stammzelltransplantation und einer Behandlung mit Brentuximab Vedotin (BV), oder nach Versagen einer Behandlung mit BV, wenn eine auto-Stammzelltransplantation nicht in Frage kommt
- Monotherapie zur Behandlung des lokal fortgeschrittenen oder metastasierten Urothelkarzinoms nach vorheriger Platin-basierter Therapie
- Monotherapie zur Behandlung des lokal fortgeschrittenen oder metastasierten Urothelkarzinoms bei Patienten, die nicht für eine Cisplatin-basierte Therapie geeignet sind und deren Tumoren PD-L1 mit einem kombinierten positiven Score (CPS) ≥ 10 exprimieren
- Monotherapie zur Behandlung des rezidivierten oder metastasierten Plattenepithelkarzinoms der Kopf-Hals-Region (HNSCC) mit PD-L1 exprimierenden Tumoren (TPS ≥ 50%) und einem Fortschreiten der Krebserkrankung während oder nach vorheriger Platin-basierter Therapie
- Monotherapie oder in Kombination mit Platin- und 5-Fluorouracil(5-FU)-Chemotherapie zur Erstlinienbehandlung des metastasierten oder nicht resezierbaren rezidivierten HNSCC mit PD-L1-exprimierenden Tumoren (CPS≥1)
- Kombination mit Axitinib zur Erstlinienbehandlung des fortgeschrittenen Nierenzellkarzinoms (RCC)
Anwendungsart
Pembrolizumab ist zur intravenösen Anwendung bestimmt und muss als Infusion über 30 Minuten gegeben werden.
Wirkmechanismus
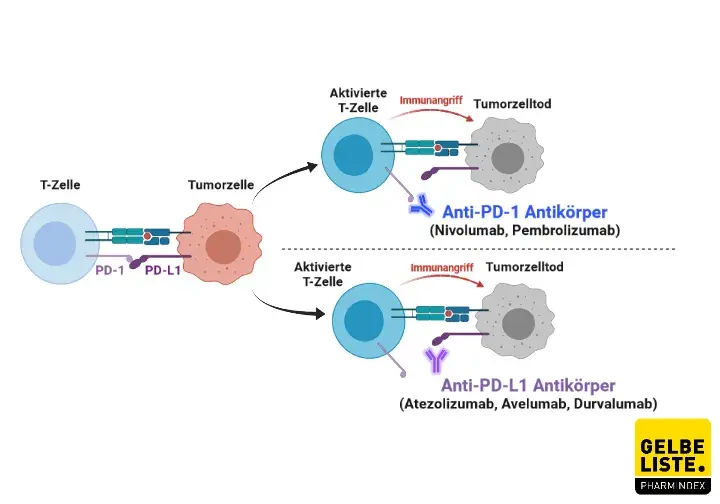
Pembrolizumab ist ein humanisierter monoklonaler Antikörper, der an den PD-1 (Programmed cell death) Rezeptor bindet und damit die Interaktion mit seinen Liganden PD-L1 (programmed cell death ligand) und PD-L2 verhindert.
Der PD-1-Rezeptor ist ein negativer Regulator der T-Zell-Aktivität, der an der Kontrolle der T-Zell-Immunreaktion beteiligt ist. Der Rezeptor wird hauptsächlich auf der Oberfläche aktivierter T-Zellen exprimiert . Binden an ihn die Liganden PD-L1 und PD-L2, wird die zytotoxische T-Zell-Immunantwort gehemmt und so überschießende Immunreaktionen verhindert. Diesen negativen Rückkopplungsmechanismus missbrauchen allerdings Tumorzellen, indem sie ebenfalls die beiden Liganden exprimieren. In der Folge wird das Immunsystem ausgebremst und daran gehindert, die Krebszellen zu attackieren.
Durch die Hemmung der Bindung des PD-1-Rezeptors an seine Liganden PD-L1 und PD-L2 verstärkt Pembrolizumab so die T-Zell-Reaktion einschließlich der Immunreaktion gegen den Tumor.
Pembrolizumab wird auch als Checkpoint-Inhibitor bezeichnet, da das Immuntherapeutikum das körpereigene Immunsystem wieder in die Lage versetzt, selbst verstärkt gegen den Krebs zu kämpfen, indem es wichtige Schaltstellen, sogenannte Checkpoints, blockiert.
Pharmakokinetik
Resorption
Pembrolizumab wird intravenös gegeben und ist daher sofort und vollständig bioverfügbar.
Verteilung
In Übereinstimmung mit einer begrenzten extravaskulären Verteilung ist das Verteilungsvolumen von Pembrolizumab im Steady State gering (~6,0 l; CV: 20 %). Wie bei Antikörpern erwartet, bindet Pembrolizumab nicht spezifisch an Plasmaproteine.
Biotransformation
Pembrolizumab wird über unspezifische Stoffwechselwege abgebaut; der Metabolismus trägt nicht zur Ausscheidung bei.
Elimination
Die Ausscheidung von Pembrolizumab ist nach Erreichen der maximalen Änderung bei Steady State annährend 23% geringer (geometrischer Mittelwert, 195 ml/Tag [CV %: 40%]) im Vergleich zur Initialdosis (252 ml/Tag [CV%: 37%]); diese Verringerung im Laufe der Zeit wird als nicht klinisch relevant betrachtet. Der geometrische Mittelwert (CV%) der terminalen Halbwertszeit beträgt 22 Tage (32%) bei Steady State.
Dosierung
Die empfohlene Dosis von Pembrolizumab als Monotherapie beträgt entweder 200 mg alle 3 Wochen oder 400 mg alle 6 Wochen als intravenöse Gabe über 30 Minuten. Die empfohlene Dosis von Pembrolizumab im Rahmen einer Kombinationstherapie beträgt 200 mg alle 3 Wochen als intravenöse Gabe über 30 Minuten.
Die Patienten sollten bis zum Fortschreiten der Krebserkrankung oder bis zum Auftreten einer unzumutbaren Toxizität behandelt werden.
Nebenwirkungen
Mögliche unerwünschte Nebenwirkungen von Pembrolizumab sind Durchfall, Müdigkeit, Exantheme, Juckreiz, Übelkeit, verminderter Appetit und Gelenkschmerzen. Häufig sind außerdem Anämie, Kopfschmerzen, Schwindel, trockene Augen, Husten, Dyspnoe und Dysgeusie.
Wechselwirkungen
Es wurden keine formalen pharmakokinetischen Wechselwirkungsstudien mit Pembrolizumab durchgeführt. Es sind allerdings keine Wechselwirkungen mit anderen Arzneimitteln zu erwarten, da Pembrolizumab durch katabolischen Abbau aus dem Blutkreislauf eliminiert wird. Aufgrund möglicher Beeinträchtigungen der pharmakodynamischen Aktivität und der Wirksamkeit von Pembrolizumab sollte eine systemische Anwendung von Kortikosteroiden oder Immunsuppressiva vor Therapiebeginn mit Pembrolizumab vermieden werden. Systemische Kortikosteroide oder andere Immunsuppressiva können jedoch nach Beginn der Therapie mit Pembrolizumab zur Behandlung von immunvermittelten Nebenwirkungen angewendet werden. Kortikosteroide können ebenfalls als Prämedikation zur antiemetischen Prophylaxe und/oder Linderung von chemotherapie-bedingten Nebenwirkungen gegeben werden, wenn Pembrolizumab in Kombination mit einer Chemotherapie angewendet wird.
Kontraindikation
Pembrolizumab darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff.
Schwangerschaft
Daten zur Anwendung von Pembrolizumab bei Schwangeren liegen nicht vor. Modelle mit trächtigen Mäusen zeigten, dass die Blockierung des PD-L1-Signalwegs die feto-maternale Toleranz stört und zu einer Erhöhung der Abortrate führt. Diese Ergebnisse deuten auf ein potenzielles Risiko hin, dass die Gabe von Pembrolizumab während der Schwangerschaft, basierend auf dem Wirkmechanismus, eine fötale Beeinträchtigung, einschließlich erhöhter Abort- und Totgeburtsraten, verursachen kann. Es ist bekannt, dass humane Immunglobuline vom G4-Typ (IgG4) plazentagängig sind. Daher besteht die Möglichkeit, dass Pembrolizumab, als IgG4-Antikörper, von der Mutter auf den sich entwickelnden Fötus übertragen werden kann. Pembrolizumab sollte während der Schwangerschaft nicht angewendet werden, es sei denn, der klinische Zustand der Frau erfordert eine Behandlung mit Pembrolizumab.
Stillzeit
Es ist nicht bekannt, ob Pembrolizumab in die Muttermilch übergeht. Da Antikörper bekanntlich in die Muttermilch übergehen können, kann ein Risiko für das Neugeborene bzw. den Säugling nicht ausgeschlossen werden. Eine Entscheidung muss darüber getroffen werden, ob das Stillen zu unterbrechen ist, oder ob auf die Behandlung mit Pembrolizumab verzichtet werden soll/die Behandlung mit Pembrolizumab zu unterbrechen ist. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie mit Pembrolizumab für die stillende Patientin zu berücksichtigen.
Verkehrstüchtigkeit
Pembrolizumab hat einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen, da bei einigen Patienten nach Gabe von Pembrolizumab über Schwindel und Müdigkeit/Erschöpfung berichtet wurde.
Wirkstoff-Informationen
Fachinformation Keytruda