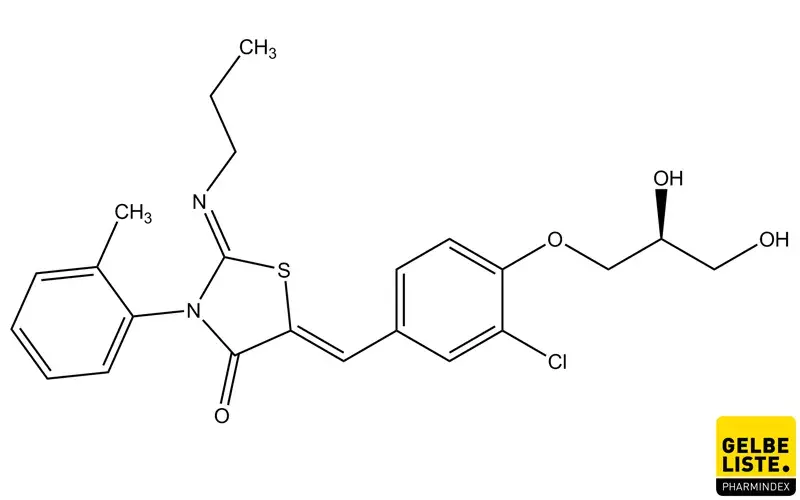
Ponesimod
Ponesimod ist ein selektiver Sphingosin-1-Phosphat-Rezeptor-1-(S1P1)-Modulator, der zur Behandlung der schubförmigen Multiplen Sklerose angewendet wird.
Ponesimod : Übersicht
Anwendung
Ponesimod (Ponvory) ist indiziert zur Behandlung erwachsener Patienten mit schubförmiger Multipler Sklerose (RMS) mit aktiver Erkrankung, die durch klinischen Befund oder Bildgebung definiert wurde. Der Nutzen von Ponesimod besteht in der Verhinderung von Schüben und dem Auftreten neuer fokaler entzündlicher Läsionen im ZNS.
Anwendungsart
Ponesimod ist für die einmal tägliche orale Anwendung vorgesehen.
Wirkmechanismus
Der Wirkmechanismus von Ponesimod bei Multipler Sklerose ist nicht vollständig geklärt. Man geht davon aus, dass der Wirkstoff an den Sphingosin-1-Phosphat-Rezeptor 1 (S1P-Rezeptor 1) bindet, der sich auf Lymphozyten befindet, wodurch der Lymphozytenaustritt aus den Lymphknoten und so die Anzahl der Lymphozyten im peripheren Blut reduziert wird. Bei der Bindung des S1P-Rezeptor 1 wirkt Ponesimod als funktioneller Antagonist, was zu dessen Internalisierung und Abbau führt. Dadurch können Lymphozyten nicht mehr dem S1P-Gradienten folgen und nicht mehr aus den Lymphknoten migrieren.
Dosierung
Die Behandlung mit Ponesimod startet mit einem Dosistitrationsschema, da es zu Behandlungsbeginn zu einer vorübergehenden Abnahme der Herzfrequenz und zu einer Verzögerung der atrioventrikulären Überleitungkommen. Das Titrationsschema kann der Fachinformation entnommen werden. Danach beträgt die empfohlene Erhaltungsdosis von Ponesimod 20 mg einmal täglich.
Nebenwirkungen
Die am häufigsten berichteten unerwünschten Arzneimittelwirkungen von Ponesimod sind:
- Nasopharyngitis (19,7%)
- erhöhte Alanin-Aminotransferase (17,9%)
- Infektionen der oberen Atemwege (11%)
Wechselwirkungen
Bei gleichzeitiger Anwendung folgender Verbindungen können Wechselwirkungen auftreten:
- Antineoplastische, immunmodulierende oder immunsuppressive Wirkstoffe: Bei gleichzeitiger Anwendung ist wegen des Risikos additiver Immuneffekte während einer solchen Therapie und in den Wochen nach der Anwendung Vorsicht geboten
- Betablocker: Der negativ chronotrope Effekt einer gleichzeitigen Anwendung von Ponesimod und Propranolol wurde in einer eigenen pharmakodynamischen Sicherheitsstudie untersucht. Die Zugabe von Ponesimod zu Propranolol im Steady-State hat eine additive Wirkung auf die Herzfrequenz.
- Impfstoffe: Impfungen können weniger wirksam sein, wenn sie während der Behandlung mit Ponesimod und bis zu einer Woche nach Absetzen von Ponesimod verabreicht werden. Die Anwendung attenuierter Lebendimpfstoffe kann ein Infektionsrisiko darstellen und sollte daher während der Behandlung mit Ponesimod und bis zu einer Woche nach Absetzen der Behandlung mit Ponesimod vermieden werden.
- Induktoren mehrerer Stoffwechselwege: Die gleichzeitige Anwendung von Ponesimod mit starken Induktoren mehrerer Stoffwechselwege von Ponesimod kann die systemische Exposition von Ponesimod verringern. Es ist unklar, ob diese Verringerung klinisch relevant ist.
Kontraindikation
Ponesimod darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff oder einen der genannten sonstigen Bestandteile
- Immunsupprimiertem Zustand
- Patienten, die in den letzten sechs Monaten einen Myokardinfarkt, eine instabile Angina pectoris, einen Apoplex, eine transitorische ischämische Attacke (TIA), eine dekompensierte Herzinsuffizienz, die eine Hospitalisierung erforderlich machte, hatten
- Herzinsuffizienz der Klasse III oder IV gemäß New York Heart Association (NYHA)
- AV-Block 2. Grades vom Mobitz-Typ II, AV-Block 3. Grades oder bei Sick-Sinus-Syndrom, es sei denn, der Patient hat einen funktionstüchtigen Herzschrittmacher
- Schweren aktiven Infektionen
- Aktiven chronischen Infektionen
- Aktiven malignen Erkrankungen
- Mittelschwerer oder schwerer Leberfunktionsstörung (Child-Pugh-Klassen B bzw. C)
- Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine zuverlässige Verhütungsmethode anwenden
Schwangerschaft/Stillzeit
Schwangerschaft
Die Anwendung von Ponesimod ist während der Schwangerschaft kontraindiziert, da tierexperimentelle Studien eine Reproduktionstoxizität gezeigt haben. Wird eine Frau während der Therapie schwanger, muss Ponesimod sofort abgesetzt werden. Darüber hinaus muss eine medizinische Beratung über das mit der Behandlung verbundene Risiko schädlicher Auswirkungen auf den Fötus erfolgen und Folgeuntersuchungen durchgeführt werden. Auf der Grundlage klinischer Erfahrungen bei Patienten, die einen anderen S1P-Rezeptor-Modulator erhalten, ist die Anwendung mit einem erhöhten Risiko für schwere angeborene Fehlbildungen verbunden.
Stillzeit
Es ist nicht bekannt, ob Ponesimod oder seine Metabolite in die Muttermilch übergehen. Da eine Studie an laktierenden Ratten auf eine Ausscheidung von Ponesimod in die Milch hindeutet, kann ein Risiko für das Neugeborene/Kind nicht ausgeschlossen werden. Ponesimod soll deshalb während der Stillzeit nicht eingenommen werden.
Verkehrstüchtigkeit
Ponesimod hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Anwendungshinweise
Elektrokardiogramm (EKG) vor Behandlungsbeginn
Vor Beginn der Behandlung mit Ponesimod ist bei allen Patienten ein (EKG) durchzuführen, um festzustellen, ob Erregungsleitungsstörungen bestehen. Bei Patienten mit bestimmten Vorerkrankungen wird eine Überwachung der Erstdosis empfohlen. Zu Behandlungsbeginn mit Ponesimod kann es nämlich zu einer vorübergehenden Abnahme der Herzfrequenz und zu einer Verzögerung der atrioventrikulären Überleitungkommen, weshalb ein Titrationsschema angewendet wird, um die Erhaltungsdosis von 20 mg Ponesimod zu erreichen.
Besondere Vorsicht ist deshalb auch bei Patienten geboten, die gleichzeitig Betablocker erhalten. Patienten mit bestimmten vorbestehenden Herzerkrankungen wie Sinusbradykardie, AV-Block 1. oder 2. Grades (Mobitz TypI), Myokardinfarkt oder Herzinsuffizienz in der Anamnese, sollen vier Stunden nach der Erstdosis überwacht werden.
Eine Überwachung über vier Stunden wird empfohlen, wenn vier Stunden nach Gabe der Dosis:
- Die Herzfrequenz <45 Schläge pro Minute beträgt.
- Die Herzfrequenz sich auf dem niedrigsten Wert befindet, was darauf hindeutet, dass die maximale pharmakodynamische Wirkung auf das Herz möglicherweise noch nicht eingetreten ist.
- Das EKG einen neu auftretenden AV-Block 2. Grades oder höher zeigt.
Infektionsrisiko
Aufgrund einer reversiblen Sequestrierung von Lymphozyten in lymphatischem Gewebe bewirkt Ponesimod eine dosisabhängige Reduktion der peripheren Lymphozytenzahl auf 30 bis 40 Prozent der Ausgangswerte, weshalb das Infektionsrisiko erhöht sein kann.
Makulaödem
Ponesimod erhöht das Risiko für ein Makulaödem, weshalb eine augenärztliche Untersuchung des Augenhintergrundes, einschließlich der Makula, bei allen Patienten vor Behandlungsbeginn und jederzeit erneut dann empfohlen wird, sobald ein Patient während der Behandlung mit Ponesimod von einer Veränderung des Sehvermögens berichtet.
Auswirkungen auf die Atemwege
Bei mit Ponesimod behandelten Patienten wurden dosisabhängige Verminderungen des forcierten exspiratorischen Volumens über eine Sekunde (FEV1) und Verminderungen der Diffusions-Lungenkapazitätfür Kohlenmonoxid (DLCO) beobachtet, die meist im ersten Monat nach Behandlungsbeginn auftraten. Bei Patienten mit schwerer Atemwegserkrankung, Lungenfibrose oder chronisch-obstruktiver Lungenerkrankung muss Ponesimod dealb mit Vorsicht angewendet werden.
Leberschädigung
Die Behandlung mit Ponesimod kann zu einer Erhöhung der Transaminasen führen, weshalb vor Behandlungsbeginn die aktuellen Transaminasen- und Bilirubinwerte geprüft werden sollen.
Erhöhter Blutdruck
Die Behandlung mit Ponesimod kann zu einem leichten, reversiblen Anstieg des Blutdrucks führen, weshalb dieser unter der Therapie regelmäßig überwacht und entsprechend eingestellt werden soll.
Kutane Neoplasien
Da ein potenzielles Risiko für Hautmalignome besteht, sollen mit Ponesimod behandelte Patienten vor einer ungeschützten Exposition gegenüber Sonnenlicht gewarnt werden. Bei diesen Patienten darf keine gleichzeitige Phototherapie mit UV-B-Strahlung oder eine PUVA (Psoralen Plus UV-A)-Photochemotherapie durchgeführt werden.
Frauen im gebärfähigen Alter
Ausgehend von tierexperimentellen Studien kann Ponesimod fetale Schäden verursachen, weshalb der Wirkstoff während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine zuverlässige Verhütungsmethode anwenden, kontraindiziert ist.
Posteriores reversibles Enzephalopathiesyndrom (PRES)
Bei Patienten, die einen S1P-Rezeptor-Modulator erhalten, wurden seltene Fälle eines posterioren reversiblen Enzephalopathiesyndroms berichtet. Bei der Behandlung mit Ponesimod wurden im Rahmen des klinischen Entwicklungsprogramms solche Fälle zwar nicht berichtet, doch sollte bei unerwarteten neurologischen oder psychiatrischen Symptomen/Anzeichen (z.B. kognitive Ausfälle, Verhaltensänderungen, kortikale Sehstörungen oder andere neurologische kortikale Symptome/Anzeichen), die auf einen Anstieg des intrakraniellen Drucks hindeuten, der Arzt umgehend eine vollständige körperliche und neurologische Untersuchung veranlassen und ein MRT in Betracht ziehen.
Alternativen
Neben Pomesimod sind noch folgeende weitere S1P1-Modulatoren zugelassen:
- Fingolimod (Gilenya)
- Ozanimod (Zeposia)
- Siponimod (Mayzent)
Wirkstoff-Informationen
-
Ponvory 20 mg Abacus Filmtabletten
Abacus Medicine A/S
-
Ponvory 20 mg axicorp Filmtabletten
axicorp Pharma B.V.
-
Ponvory 20 mg B2B Medical Filmtabletten
B2B Medical GmbH
-
Ponvory 20 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Ponvory 20 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
Ponvory 20 mg Filmtabletten
Laboratoires Juvise Pharmaceuticals
-
Ponvory 20 mg Haemato Pharm Filmtabletten
HAEMATO PHARM GmbH
-
Ponvory 20 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Ponvory 20 mg Orifarm Filmtabletten
Orifarm GmbH
-
Ponvory 20 mg Originalis Filmtabletten
Originalis B.V.
-
Ponvory 20 mg Paranova Filmtabletten
Paranova Pack A/S
-
Ponvory 20 mg SynCo pharma Filmtabletten
SynCo pharma B.V.
-
Ponvory Abacus Packung zur Einleitung der Behandlung
Abacus Medicine A/S
-
Ponvory Eurim Packung zur Einleitung der Behandlung
Eurim-Pharm Arzneimittel GmbH
-
Ponvory Orifarm Packung zur Einleitung der Behandlung
Orifarm GmbH
-
Ponvory Packung zur Einleitung der Behandlung
Laboratoires Juvise Pharmaceuticals