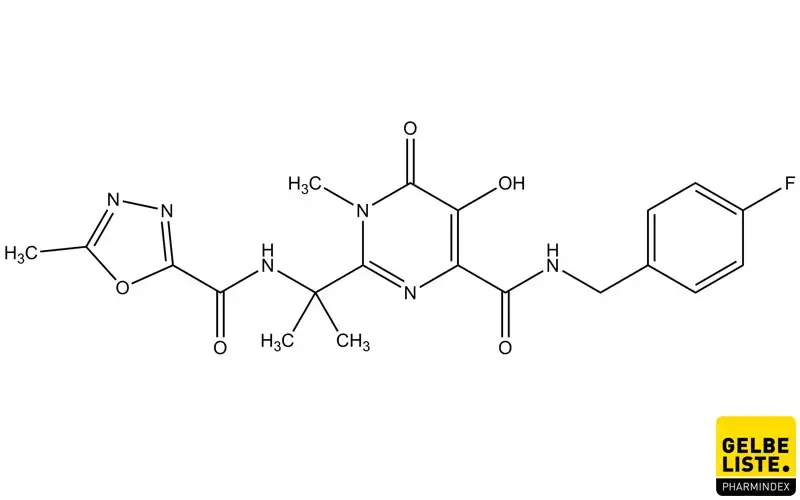
Raltegravir
Der antiretrovirale Wirkstoff Raltegravir ist ein Integrase-Inhibitor, der in Kombination mit anderen HIV-Therapeutika zur Therapie einer Infektion mit HI-Viren Typ-1 (HIV-1) eingesetzt wird.
Raltegravir: Übersicht
Anwendung
Der Integrase-Inhibitor Raltegravir ist in Kombination mit anderen HIV-Therapeutika indiziert zur Behandlung einer Infektion mit dem Humanen Immundefizienz-Virus 1 (HIV-1).
HIV wird unterschieden in HIV-1 (weltweit) und HIV-2 (vorwiegend in Westafrika), die sich wiederum in weitere Subtypen gliedern lassen.
Im Allgemeinen bezieht sich die Anwendung auf Infektionen mit HIV-1.
Anwendungsart
Raltegravir ist als Filmtablette (400 und 600 mg), Kautablette (25 und 100 mg) sowie als Granulat zur Herstellung einer Suspension zum Einnehmen (100 mg) erhältlich. Die Einnahme kann nahrungsunabhängig erfolgen.
Die Filmtabletten sollten weder gekaut, noch zerdrückt oder geteilt werden, da dadurch Änderungen im pharmakokinetischen Profil zu erwarten sind.
Die Therapie sollte nur durch einen Arzt eingeleitet werden, der in der Behandlung von HIV-Infektionen erfahren ist.
Wirkmechanismus
Raltegravir ist ein antiretroviraler Wirkstoff aus der Gruppe der Integrase-Inhibitoren, die Bestandteil einer antiretroviralen Therapie (ART) sein können.
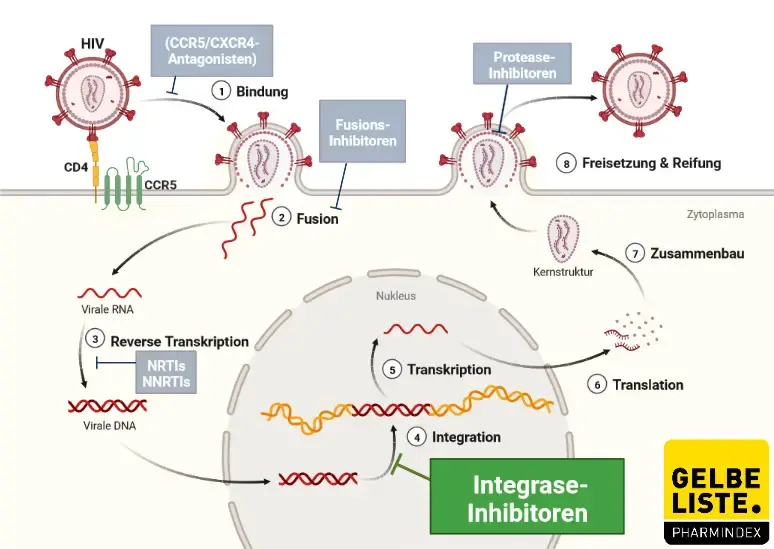
Humane Immundefizienz-Viren sind lymphotrope Lentiviren aus der Familie der Retroviren. Jedes individuelle Viruspartikel enthält zwei RNA-Stränge, die von einem Capsid-Protein (p24) und einer Lipidmembran mit Hüllproteinen (gp120, gp41) umschlossen sind.
Nach Eintritt in die Zielzelle wird mit Hilfe des viruseigenen Enzyms Reverse Transkriptase (RT) die virale RNA in provirale DNA umgeschrieben. Das Enzym RT dient in diesem Fall als weiterer Angriffspunkt für antiretrovirale Wirkstoffe, die sogenannten Reverse-Transkriptase-Inhibitoren (RTI).
Die provirale DNA wird nach Transport in den Nukleus durch eine virale Integrase in das Wirtsgenom integriert, sodass prinzipiell jede infizierte Zelle während ihrer gesamten Lebensdauer neue Viruspartikel generieren kann. Die virale Integrase dient als Angriffspunkt für die Integrase-Inhibitoren, denen auch Raltegravir angehört.
Raltegravir hemmt die katalytische Aktivität des Enzyms Integrase und verhindert dadurch die kovalente Insertion oder Integration des HIV-Genoms in das Wirtszellgenom. Verläuft die Integration des HIV-Genoms nicht erfolgreich, entfällt die Steuerung der Produktion neuer infektiöser Viruspartikel. Folglich verhindert die Hemmung der Integration die Ausbreitung der Virusinfektion.
Pharmakokinetik
Das pharmakokinetische Profil variiert in Abhängigkeit der Darreichungsform.
Resorption
- Raltegravir wird mit einer tmax von ca. 3 Stunden rasch resorbiert (festgestellt bei gesunden Probanden nach Anwendung einer oralen Einzeldosis Raltegravir im nüchternen Zustand).
- AUC und cmax von Raltegravir steigen im Bereich zwischen 100 mg und 1600 mg dosisproportional an.
- Bei 2x täglicher Anwendung wird der pharmakokinetische Steady-State-Zustand rasch (etwa innerhalb der ersten 2 Tage der Einnahme) erreicht.
- AUC und cmax zeigen nur eine geringe bis gar keine Akkumulation.
- Die absolute Bioverfügbarkeit von Raltegravir wurde nicht bestimmt.
- Die Darreichungsform der Raltegravir 600-mg-Filmtablette, welche für das Regime von 1200 mg 1x täglich verwendet wird, hat eine höhere relative Bioverfügbarkeit als die Darreichungsform der Raltegravir 400-mg-Filmtablette (um 21 bis 66%).
- Nach der Resorption zeigen beide Darreichungsformen eine ähnliche systemische Pharmakokinetik.
- In den Pivotalstudien zur Sicherheit und Wirksamkeit bei HIV-positiven Patienten wurde Raltegravir ohne Berücksichtigung der Mahlzeiten eingenommen.
- Die Einnahme von mehreren Dosen Raltegravir nach einer mäßig fettreichen Mahlzeit führte zu einem klinisch nicht bedeutsamen Anstieg (13%) der Raltegravir-AUC im Vergleich zur Nüchterneinnahme.
- Die Einnahme von Raltegravir nach einer sehr fettreichen Mahlzeit erhöht die AUC und die cmax um das ca. 2-fache.
- Die Einnahme von Raltegravir nach einer fettarmen Mahlzeit erniedrigt die AUC und die cmax um 46% bzw. um 52%.
- Eine Nahrungsaufnahme scheint die pharmakokinetische Variabilität im Vergleich zum Nüchternzustand zu erhöhen.
- Eine fettarme Mahlzeit mit Raltegravir 1200 mg 1x täglich führt zu einer Abnahme der AUC0-∞ um 42% und der cmax um 52%.
- Die Einnahme mit einer sehr fettreichen Mahlzeit führt zu einem Anstieg der AUC0-∞ um 1,9% und zu einer Abnahme der cmax um 28%.
- Im Allgemeinen wird eine beträchtliche Variabilität in der Pharmakokinetik von Raltegravir beobachtet.
- Ursachen der Variabilität können Unterschiede in der Kombination mit Mahlzeiten und den Begleitmedikationen sein.
Verteilung
- Raltegravir wird im Konzentrationsbereich zwischen 2 und 10 μM zu annähernd 83% an humane Plasmaproteine gebunden.
- Bei Ratten ist Raltegravir leicht plazentagängig, passiert die Blut-Hirn-Schranke jedoch nicht in nennenswertem Umfang.
- In zwei Studien war Raltegravir bei HIV-1 infizierten Patienten, die 400 mg Raltegravir 2x täglich erhielten, leicht im Liquor cerebrospinalis nachzuweisen (in der ersten Studie mit n = 18 betrug die mediane Konzentration im Liquor cerebrospinalis 5,8% der entsprechenden Plasmakonzentration, in der zweiten Studie mit n = 16 betrug die mediane Konzentration im Liquor cerebrospinalis 3% der entsprechenden Plasmakonzentration, wobei diese medianen Anteile etwa 3-6-fach niedriger als der Anteil freien Raltegravirs im Plasma liegen).
Metabolismus (Biotransformation)
- Studien mit Isoform-selektiven chemischen Hemmsubstanzen und cDNA-exprimierten UDP-Glukuronosyltransferasen (UGT) zeigen, dass UGT1A1 das hauptsächlich für die Bildung von Raltegravir-Glukuronid verantwortliche Enzym ist.
- Diese Daten sprechen für die UGT1A1-vermittelte Glukuronidierung als Hauptausscheidungsmechanismus für Raltegravir beim Menschen.
Elimination
- Die apparente terminale Halbwertszeit beträgt ca. 9 Stunden, mit einer kürzeren α-Phase-Halbwertszeit (etwa 1 Stunde), die sehr stark die AUC bedingt.
- Nach Anwendung einer oralen Dosis Raltegravir werden ungefähr 51% bzw. 32% der Dosis über den Fäzes bzw. Urin ausgeschieden.
- In den Fäzes wurde ausschließlich Raltegravir nachgewiesen, das vermutlich hauptsächlich aus der Hydrolyse des mit der Galle sezernierten Raltegravir-Glukuronids stammt.
- Im Urin wurden die beiden Komponenten Raltegravir und Raltegravir-Glukuronid nachgewiesen, die ca. 9% bzw. 23% der angewendeten Dosis entsprechen.
Unterschiedliche Patientenpopulationen
- Kinder und Jugendliche: Basierend auf einer Studie mit gesunden erwachsenen Probanden zum Vergleich der Darreichungsformen liegt die orale Bioverfügbarkeit der Kautabletten und des Granulats zur Herstellung einer Suspension zum Einnehmen höher als die der 400-mg-Filmtabletten. In dieser Studie führte die Einnahme der Kautabletten mit einer fettreichen Mahlzeit im Vergleich zur Einnahme auf nüchternen Magen zu einer durchschnittlichen Verringerung der AUC um 6% und der cmax um 62%. Die Einnahme der Kautablette mit einer fettreichen Mahlzeit verändert die Pharmakokinetik von Raltegravir nicht in klinisch relevantem Ausmaß, sodass die Kautabletten unabhängig von der Nahrungsaufnahme eingenommen werden können. Der Einfluss von Nahrung auf das Granulat zur Herstellung einer Suspension zum Einnehmen wurde nicht untersucht.
- Leberfunktionsstörung: Raltegravir wird hauptsächlich über Glukuronidierung in der Leber eliminiert. Bei Erwachsenen waren keine klinisch relevanten pharmakokinetischen Unterschiede zwischen Patienten mit mäßig eingeschränkter Leberfunktion und gesunden Probanden feststellbar. Der Einfluss einer schweren Leberfunktionsstörung auf die Pharmakokinetik von Raltegravir ist bislang nicht untersucht worden.
Dosierung
Erwachsene
- Empfohlene Tagesdosis: 2x täglich 400 mg (1 Filmtablette)
Kinder und Jugendliche
- Empfohlene Tagesdosis für Kinder und Jugendliche mit einem Gewicht von mindestens 25 kg: 2x täglich 400 mg (1 Filmtablette)
Unterschiedliche Darreichungsformen
- Raltegravir steht auch als Kautablette und als Granulat zur Herstellung einer Suspension zum Einnehmen zur Verfügung (detaillierte Dosierungsangaben können der jeweiligen Fachinformationen für die Kautabletten und das Granulat zur Herstellung einer Suspension zum Einnehmen entnommen werden).
- Wenn ein Patient nicht in der Lage ist, Tabletten zu schlucken, kann beispielsweise die Gabe der Kautabletten erwogen werden.
- Die Höchstdosis der Kautablette beträgt 300 mg 2x täglich.
- Da die pharmakokinetischen Profile der Darreichungsformen unterschiedlich sind, sollten die 400-mg-Filmtabletten oder 600-mg-Filmtabletten weder durch die Kautabletten noch durch das Granulat zur Herstellung einer Suspension zum Einnehmen ersetzt werden.
- Die Kautabletten und das Granulat zur Herstellung einer Suspension zum Einnehmen wurden nicht bei HIV-infizierten Jugendlichen (12 bis 18 Jahre) oder Erwachsenen untersucht.
- Raltegravir steht auch als 600-mg-Filmtablette zur 1x täglichen Einnahme von 1200 mg (zwei 600-mg-Filmtabletten) für Erwachsene, Kinder und jugendliche Patienten (mit einem Gewicht von mindestens 40 kg) zur Behandlung therapienaiver Patienten oder von Patienten, deren Viruslast bereits durch ein Regime mit 400 mg 2x täglich supprimiert ist, zur Verfügung (die 400-mg-Filmtablette ist nicht für das Therapieschema von 1x täglich 1200 mg geeignet).
Nebenwirkungen
Die häufigsten Nebenwirkungen, die im Zusammenhang mit Raltegravir auftreten können, umfassen:
- Gastrointestinale Beschwerden (Bauchschmerzen, Diarrhö, Flatulenz, Übelkeit, Erbrechen, Dyspepsie)
- Kopfschmerzen
- Hautausschlag
- Appetitminderung
- Alpträume
- Insomnie
- Depression
- Schwindel
- Schwächegefühl und Müdigkeit
- Psychomotorische Hyperaktivität und Verhaltensstörung
- Blutbildveränderungen (Erhöhungen von ALT und AST, atypische Lymphozyten, Hypertriglyzeridämie, Erhöhung der Lipase, Erhöhung der Pankreas Amylase)
Zu den schwerwiegenden Nebenwirkungen zählen:
- Immunrekonstitutionssyndrom (entzündliche Reaktion auf asymptomatische oder residuale opportunistische Infektionen zum Zeitpunkt der Therapieeinleitung bei schwerem Immundefekt)
- Ausschlag
- Rhabdomyolyse
Wechselwirkungen
Eine antiretrovirale Therapie sollte immer aus einer Kombination mehrerer Wirkstoffe bestehen, wodurch sich allerdings auch das Wechselwirkungsrisiko erhöht.
Einfluss von Raltegravir auf die Pharmakokinetik anderer Arzneimittel
- Raltegravir ist kein Substrat der CYP-Enzyme, inhibiert jedoch in vitro die Organo-Anion-Transporter (OAT) OAT1 (IC50 von 109 μM) und OAT3 (IC50 von 18,8 μM).
- Demnach ist Vorsicht geboten, wenn Raltegravir zusammen mit empfindlichen OAT1 und/oder OAT3 Substraten angewendet wird.
Einfluss anderer Arzneimittel auf die Pharmakokinetik von Raltegravir
- Induktoren UGT1A1: Da Raltegravir hauptsächlich über UGT1A1 verstoffwechselt wird, sollte eine Kombination von Raltegravir mit starken Induktoren der UGT1A1 (z.B. Rifampicin) mit Vorsicht erfolgen. Rifampicin erniedrigt die Plasmaspiegel von Raltegravir, wobei der Einfluss auf die Wirksamkeit von Raltegravir nicht bekannt ist. Wenn eine Kombination mit Rifampicin jedoch unvermeidlich ist, kann bei Erwachsenen eine Verdoppelung der Dosis von Raltegravir in Erwägung gezogen werden.
- Inhibitoren UGT1A1: Eine Kombination von Raltegravir mit Arzneimitteln, die als starke Inhibitoren der UGT1A1 bekannt sind (z.B. Atazanavir), kann den Plasmaspiegel von Raltegravir erhöhen. Weniger starke Inhibitoren der UGT1A1 (z.B. Indinavir, Saquinavir) können ebenfalls den Plasmaspiegel von Raltegravir erhöhen (im Vergleich zu Atazanavir in geringerem Ausmaß).
- Antazida: Antazida, die mehrwertige Metallkationen enthalten, können die Resorption von Raltegravir durch Chelatbildung vermindern und so zu reduzierten Plasmaspiegeln von Raltegravir führen. Die Einnahme aluminium- und magnesiumhaltiger Antazida innerhalb von 6 Stunden vor oder nach Einnahme von Raltegravir reduziert die Plasmaspiegel von Raltegravir signifikant, weshalb die Kombination aluminium- und/oder magnesiumhaltiger Antazida mit Raltegravir nicht empfohlen wird. Die Kombination von Raltegravir mit kalziumcarbonathaltigen Antazida vermindert die Plasmaspiegel von Raltegravir ebenfalls, wobei diese Interaktion nicht als klinisch relevant erachtet wird (keine Dosisanpassung erforderlich).
- pH-Wert beeinflussende Arzneimittel: Arzneimittel, die den pH-Wert im Magen erhöhen (z.B. Omeprazol), können die Resorptionsrate von Raltegravir erhöhen und folglich zu erhöhten Plasmaspiegeln von Raltegravir führen (das Sicherheitsprofil bei Patienten in Phase-III-Studien, die Protonenpumpenhemmer oder H2-Antagonisten einnahmen, war allerdings vergleichbar mit dem bei Patienten, die diese Antazida nicht einnahmen, weshalb keine Dosisanpassung bei der Einnahme von Protonenpumpenhemmern oder H2-Antagonisten erforderlich ist).
Wirkstoffspezifische pharmakokinetische Interaktionsdaten können der Fachinformation entnommen werden.
Kontraindikationen
Raltegravir ist kontraindiziert bei Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels.
Schwangerschaft
Weitreichende Erfahrungen an schwangeren Frauen nach Exposition mit Raltegravir 400 mg 2x täglich im ersten Trimenon (mehr als 1000 prospektiv beobachtete Schwangerschaftsausgänge) deuten nicht auf eine Fehlbildungstoxizität hin. Tierexperimentelle Studien haben hingegen eine
Reproduktionstoxizität gezeigt.
Weitergehende Erfahrungen an schwangeren Frauen nach Exposition mit Raltegravir 400 mg 2x täglich im zweiten und/oder dritten Trimenon (zwischen 300-1000 prospektiv beobachtete Schwangerschaftsausgänge) deuten ebenfalls nicht auf ein erhöhtes Risiko einer fetalen/neonatalen Toxizität hin.
Raltegravir 400 mg 2x täglich kann während der Schwangerschaft angewendet werden, wenn dies aus klinischer Sicht notwendig ist.
Es liegen allerdings keine Daten für die Anwendung von Raltegravir 1200 mg 1x täglich in der Schwangerschaft vor, weshalb die Anwendung von Raltegravir 1200 mg während der Schwangerschaft nicht empfohlen wird.
Register für Schwangerschaften unter antiretroviraler Therapie (Antiretroviral Pregnancy Registry)
- Ein Register für Schwangerschaften unter antiretroviraler Therapie wurde zur Überwachung der maternalen bzw. fetalen Verläufe von Patientinnen, denen versehentlich während ihrer Schwangerschaft Raltegravir verordnet wurde, eingerichtet.
- Die Ärzte sind aufgefordert, schwangere Patientinnen in dieses Register einzutragen.
Im Allgemeinen sollten bei der Entscheidung über die Anwendung antiretroviraler Arzneimittel bei der Therapie HIV-infizierter schwangerer Frauen und der damit verbundenen Verminderung des Risikos einer vertikalen Übertragung von HIV auf das Neugeborene Daten aus Tierstudien sowie klinische Erfahrungen bei schwangeren Frauen berücksichtigt werden, wenn die Sicherheit für den Fetus zu beurteilen ist.
Stillzeit
Raltegravir und Metaboliten werden in die Muttermilch ausgeschieden, sodass Auswirkungen auf das gestillte Neugeborene/Kind wahrscheinlich sind.
Auch Daten, die aus tierexperimentellen Studien zur Pharmakodynamik und Toxikologie zur Verfügung stehen, haben gezeigt, dass Raltegravir und seine Metaboliten in die Muttermilch ausgeschieden werden.
Ein Risiko für das Neugeborene/Kind kann insgesamt nicht ausgeschlossen werden, weshalb Raltegravir während der Stillzeit nicht angewendet werden sollte.
Generell wird empfohlen, dass HIV-infizierte Mütter ihre Säuglinge nicht stillen, um die Übertragung von HIV zu verhindern.
Verkehrstüchtigkeit
Raltegravir kann einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben. Die Patienten sollten darüber informiert werden, dass im Zusammenhang mit der Anwendung von Raltegravir Schwindel auftreten kann. Der klinische Zustand des Patienten und das Nebenwirkungsprofil von Raltegravir sollten bei der Beurteilung der Fähigkeit des Patienten, ein Fahrzeug zu führen, Fahrrad zu fahren oder Maschinen zu bedienen, berücksichtigt werden.
Anwendungshinweise
HIV-Übertragung
- Obwohl es sich gezeigt hat, dass die erfolgreiche Virussuppression durch eine antiretrovirale Therapie das Risiko einer sexuellen Übertragung erheblich reduziert, kann ein Restrisiko nicht ausgeschlossen werden.
- Demnach sollten Vorsichtsmaßnahmen zur Vermeidung der Übertragung gemäß nationaler Leitlinien getroffen werden.
Lebererkrankung
- Verträglichkeit und Wirksamkeit von Raltegravir sind bei Patienten mit schweren Lebererkrankungen nicht erwiesen, weshalb Raltegravir bei Patienten mit schwerer Leberfunktionsstörung mit Vorsicht angewendet werden sollte.
- Patienten mit einer vorbestehenden Funktionsstörung der Leber einschließlich chronischer Hepatitis zeigen während einer antiretroviralen Kombinationstherapie häufiger Veränderungen der Leberfunktion und sollten mit den üblichen Maßnahmen überwacht werden (falls bei diesen Patienten eine Verschlechterung der Lebererkrankung auftritt, sollte eine Unterbrechung bzw. eine Einstellung der Therapie erwogen werden).
- Patienten mit chronischer Hepatitis B oder C, die mit einer antiretroviralen Kombinationstherapie behandelt werden, haben ein erhöhtes Risiko für schwerwiegende und potenziell tödliche hepatische Nebenwirkungen.
Myopathie und Rhabdomyolyse
- Unter Therapie mit Raltegravir können Myopathien und Rhabdomyolyse auftreten.
- Bei Patienten, die bereits eine Myopathie oder Rhabdomyolyse in der Vergangenheit hatten oder prädisponierenden Faktoren ausgesetzt sind, (einschließlich Arzneimitteln, die derartige Erkrankungen hervorrufen können) sollte Raltegravir mit Vorsicht angewendet werden.
Schwere Haut- und Überempfindlichkeitsreaktionen
- Schwerwiegende, potenziell lebensbedrohliche und letale Hautreaktionen wurden bei Patienten berichtet, die Raltegravir eingenommen hatten (in den meisten Fällen in Kombination mit anderen Arzneimitteln, die mit diesen Reaktionen einhergehen können).
- Darunter waren Fälle von Stevens-Johnson-Syndrom und Lyell-Syndrom (toxischer epidermaler Nekrolyse).
- Überempfindlichkeitsreaktionen wurden ebenfalls berichtet und waren durch Hautausschlag, Allgemeinsymptome und manchmal Organfehlfunktionen einschließlich Leberversagen gekennzeichnet.
- Raltegravir sowie weitere in Betracht kommende Arzneimittel müssen sofort abgesetzt werden, wenn die Patienten Anzeichen schwerer Haut- oder Überempfindlichkeitsreaktionen entwickeln (wie schwerer Hautausschlag oder Ausschlag mit Fieber, allgemeines Unwohlsein, Müdigkeit, Muskel- oder Gelenkschmerzen, Blasenbildung, orale Läsionen, Konjunktivitis, Gesichtsödem, Hepatitis, Eosinophilie, Angioödem, auch andere Symptome sind möglich).
- Der klinische Zustand und die Leber-Transaminasen sollten überwacht und eine geeignete Therapie eingeleitet werden.
- Jegliche Verzögerung des Absetzens der Behandlung mit Raltegravir oder anderer in Betracht kommender Arzneimittel nach dem Beginn eines schweren Hautausschlags kann zu einer lebensbedrohlichen Reaktion führen.
Immunrekonstitutionssyndrom
- Bei HIV-infizierten Patienten mit schwerem Immundefekt kann sich zum Zeitpunkt der Einleitung einer antiretroviralen Kombinationstherapie (CART) eine entzündliche Reaktion auf asymptomatische oder residuale opportunistische Pathogene entwickeln, die zu schweren klinischen Zuständen oder Verschlechterung von Symptomen führt (typischerweise werden solche Reaktionen innerhalb der ersten Wochen oder Monate nach Beginn der CART beobachtet).
- Entsprechende Beispiele sind CMV-Retinitis, disseminierte und/oder lokalisierte mykobakterielle Infektionen und Pneumonien durch Pneumocystis jiroveci (früher bekannt als Pneumocystis carinii).
- Jedes Entzündungssymptom ist zu bewerten und, falls notwendig, eine geeignete Behandlung einzuleiten.
- Es liegen auch Berichte über Autoimmunerkrankungen (wie z. B. Morbus Basedow und Autoimmunhepatitis) vor, die im Rahmen einer Immun-Reaktivierung auftraten (allerdings ist der Zeitpunkt des Auftretens sehr variabel und diese Ereignisse können viele Monate nach Beginn der Behandlung auftreten).
Osteonekrose
- Obwohl von einer multifaktoriellen Ätiologie (einschließlich Anwendung von Kortikoiden, Alkoholkonsum, ausgeprägte Immunsuppression und erhöhtem Body-Mass-Index) ausgegangen wird, wurden insbesonders bei Patienten mit fortgeschrittener HIV-Infektion und/oder langdauernder antiretroviraler Kombinationstherapie (CART) Fälle von Osteonekrose berichtet.
- Die Patienten müssen darauf hingewiesen werden, dass sie beim Auftreten von Gelenkbeschwerden und -schmerzen, bei Gelenksteifigkeit oder Bewegungseinschränkungen ihren Arzt aufsuchen sollen.
Depression
- Über Depression, auch mit Suizidgedanken und suizidalem Verhalten, wurde unter Therapie mit Raltegravir berichtet (insbesondere bei Patienten mit einer Depression oder psychiatrischen Erkrankung in der Vorgeschichte).
- Bei Patienten mit einer Depression oder psychiatrischen Erkrankung in der Vorgeschichte ist Vorsicht geboten.
Arzneimittelinteraktionen
- Die gleichzeitige Anwendung von Raltegravir mit aluminium- und magnesiumhaltigen Antazida reduziert die Plasmaspiegel von Raltegravir, weshalb die Kombination von Raltegravir mit aluminium- und/oder magnesiumhaltigen Antazida nicht empfohlen wird.
- Bei Kombination von Raltegravir mit starken Induktoren der Uridin-Diphosphat-Glukuronosyltransferase (UGT) 1A1 (z.B. Rifampicin) ist Vorsicht geboten, denn Rifampicin reduziert den Plasmaspiegel von Raltegravir, wobei der Einfluss auf die Wirksamkeit von Raltegravir nicht bekannt ist (wenn eine Kombination mit Rifampicin unvermeidlich ist, kann bei Erwachsenen eine Verdoppelung der Dosis von Raltegravir in Erwägung gezogen werden).
Alternativen
Zur antiretroviralen Therapie (einer HIV-1-Infektion) können alternativ bzw. ergänzend folgende Wirkstoffe eingesetzt werden:
Entry-Inhibitoren
- CCR5-Antagonisten: Maraviroc
- Fusionshemmer: Enfuvirtid
Reverse-Transkriptase-Inhibitoren (RTI)
Nukleosidische Reverse-Transkriptase-Inhibitoren (NRTI):
Nukleotidische Reverse-Transkriptase-Inhibitoren (NtRTI):
Nicht-nukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI):
Andere Integrase-Inhibitoren (INI, INSTI)
HIV-Protease-Inhibitoren (PI)
- Atazanavir
- Darunavir
- Fosamprenavir
- Indinavir
- Lopinavir
- Saquinavir
- Tipranavir
- Ritonavir (meist als „Booster“, Kennzeichnung /r)
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
- EMA: ISENTRESS
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- AWMF: Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion
- RKI: HIV-Infektion/AIDS
Abbildung
Adapted from „HIV Sites for Therapeutic Intervention”, by BioRender.com
-
ISENTRESS® 25 mg Kautabletten
MSD Sharp & Dohme GmbH
-
ISENTRESS® 100 mg Granulat zur Herstellung einer Suspension zum Einnehmen
MSD Sharp & Dohme GmbH
-
ISENTRESS® 100 mg Kautabletten
MSD Sharp & Dohme GmbH
-
Isentress 400 mg 101 Carefarm Filmtabletten
1 0 1 Carefarm GmbH
-
Isentress 400 mg Abacus Filmtabletten
Abacus Medicine A/S
-
Isentress 400 mg ACA Filmtabletten
A.C.A. Müller ADAG Pharma AG
-
Isentress 400 mg Allomedic Filmtabletten
Allomedic GmbH
-
Isentress 400 mg axicorp Filmtabletten
axicorp Pharma B.V.
-
Isentress 400 mg Canoma Filmtabletten
Canoma Pharma GmbH
-
Isentress 400 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Isentress 400 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
Isentress 400 mg European Filmtabletten
European Pharma B.V.
-
Isentress 400 mg Fd Pharma Filmtabletten
FD Pharma GmbH
-
ISENTRESS® 400 mg Filmtabletten
MSD Sharp & Dohme GmbH
-
Isentress 400 mg Haemato-Pharm Filmtabletten
HAEMATO PHARM GmbH
-
Isentress 400 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Isentress 400 mg Medicopharm Filmtabletten
Medicopharm AG
-
Isentress 400 mg Orifarm Filmtabletten
Orifarm GmbH
-
Isentress 400 mg Originalis Filmtabletten
Originalis B.V.
-
Isentress 400 mg Paranova Filmtabletten
Paranova Pack A/S
-
Isentress 400 mg SynCo pharma Filmtabletten
SynCo pharma B.V.
-
Isentress 600 mg 101 Carefarm Filmtabletten
1 0 1 Carefarm GmbH
-
Isentress 600 mg Abacus Filmtabletten
Abacus Medicine A/S
-
Isentress 600 mg Allomedic Filmtabletten
Allomedic GmbH
-
Isentress 600 mg axicorp Filmtabletten
axicorp Pharma B.V.
-
Isentress 600 mg Canoma Filmtabletten
Canoma Pharma GmbH
-
Isentress 600 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Isentress 600 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
ISENTRESS® 600 mg Filmtabletten
MSD Sharp & Dohme GmbH
-
Isentress 600 mg Haemato-Pharm Filmtabletten
HAEMATO PHARM GmbH
-
Isentress 600 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Isentress 600 mg Medicopharm Filmtabletten
Medicopharm AG
-
Isentress 600 mg Orifarm Filmtabletten
Orifarm GmbH
-
Isentress 600 mg Paranova Filmtabletten
Paranova Pack A/S
-
Isentress 600 mg SynCo pharma Filmtabletten
SynCo pharma B.V.
-
Raltegravir beta 600 mg Filmtabletten
betapharm Arzneimittel GmbH











