Remdesivir
Remdesivir ist ein Nukleosidanalogon mit einer antiviralen Breitbandaktivität (Ebola, Marburg, MERS und SARS). Das Virostatikum inhibiert die virale RNA-Polymerase und ist unter erheblichen Auflagen zur Behandlung von COVID-19 zugelassen.
Remdesivir: Übersicht
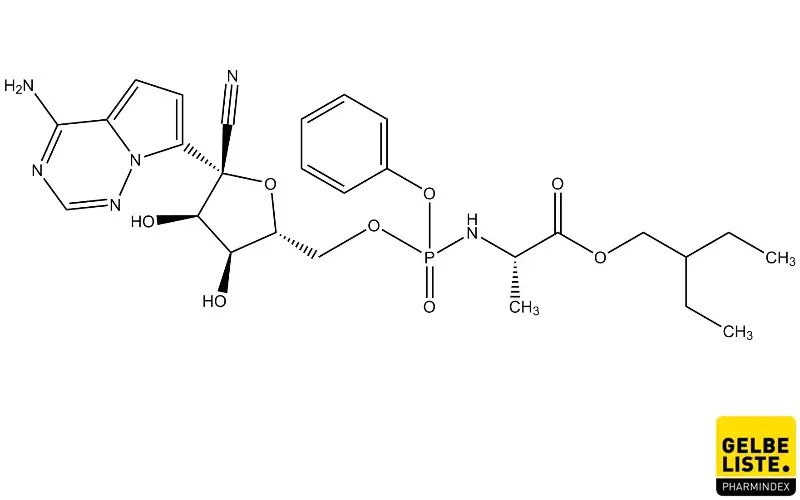
Anwendung
Remdesivir (Veklury®) der Firma Gilead wurde ursprünglich für die Behandlung der Viruserkrankung Ebola entwickelt. Das Virostatikum ist zugelassen zur Behandlung von COVID-19 bei Erwachsenen und Jugendlichen (im Alter von mindestens 12 Jahren und mit einem Körpergewicht von mindestens 40 kg) mit einer Pneumonie, die eine zusätzliche Sauerstoffzufuhr erfordert. Bei der Zulassung handelt es sich um eine sogenannte bedingte Zulassung („conditional marketing authorisation“, CMA). Im Gegensatz zu einer regulären Zulassung sind bei einer CMA sind weniger umfangreiche Daten für die Zulassung erforderlich. Sie kommt in Situationen in Betracht, wenn das Arzneimittel zur Behandlung einer seltenen und/oder lebensbedrohlichen Krankheit bestimmt ist und das Nutzen-Risiko-Verhältnis als positiv eingestuft wurde.
Anwendungsart
Remdesivir ist als Lösung und Lyophilisat erhältlich. Das Konzentrat für die Infusionslösung wird als sterile, konservierungsmittelfreie, klare, farblose bis gelbe konzentrierte Lösung auf Wasserbasis geliefert, die 5 mg/ml Remdesivir enthält und vor der intravenösen Verabreichung in Infusionsflüssigkeiten verdünnt wird.
Wirkmechanismus
Remdesivir inhibiert virale RNA-Polymerasen und hat ein breites Wirkungsspektrum gegen Mitglieder der Filoviren (z. B. EBOV, MARV), CoVs (z. B. SARS-CoV, MERS-CoV) und Paramyxoviren (z. B. Respiratory Syncytial Virus [RSV]), Nipah-Virus [NiV] und Hendra-Virus).
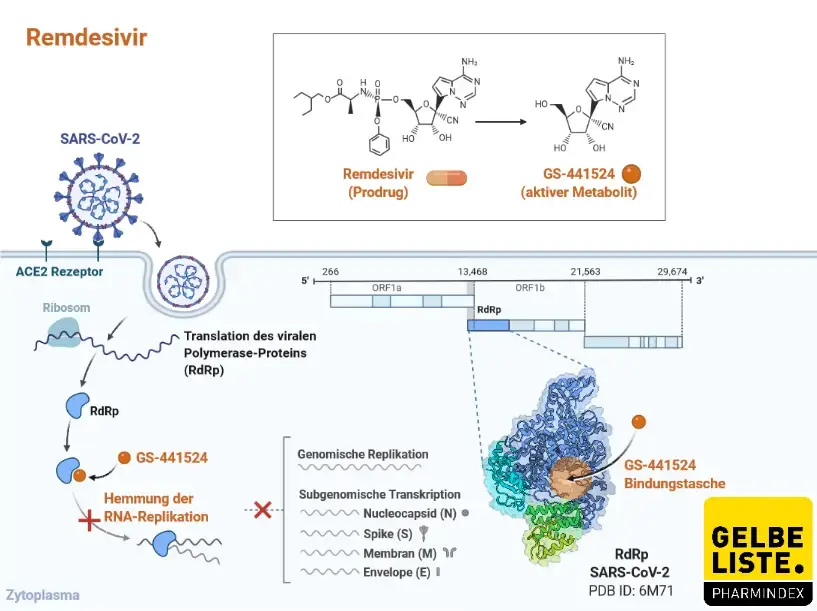
Nach Applikation gibt Remdesivir das Monophosphat-Nucleosid-Analogon GS-441524 effizient in Zellen ab. Innerhalb der Zellen wird das GS-441524-Monophosphat schnell in das pharmakologisch aktive Nucleosidtriphosphat GS-443902 umgewandelt. Ein effizienter Metabolismus von Remdesivir und / oder der Diastereomerenmischung GS-466547 zum Nucleosidtriphosphat GS-443902 wurde in mehreren Zelltypen nachgewiesen. Biochemische Studien zeigen, dass das Nucleosidtriphosphat GS-443902 als Analogon von Adenosintriphosphat (ATP) wirkt und mit dem natürlichen ATP-Substrat konkurriert. Dies führt zur selektiven Hemmung der EBOV-RNA-abhängigen RNA-Polymerase. Der primäre Mechanismus der Hemmung ist der Einbau des Nucleosidtriphosphats GS-443902 in entstehende RNA-Ketten durch EBOV-RNA-abhängige RNA-Polymerase, was zu einer verzögerten Beendigung der RNA-Kette während der Virusreplikation führt.
Weiterhin wurde gezeigt, dass ein verzögerter Kettenabbruch der Wirkungsmechanismus von Remdesivir bei der Inhibition der MERS-CoV- (vorläufige Daten), RSV- [Warren 2016] und NiV- [Jordan 2018] Polymerasen ist.
Pharmakokinetik
Remdesivir (GS-5734) ist ein einzelnes Diastereomer-Monophosphoramidat-Prodrug eines Monophosphat-Nucleosid-Analogons (GS-441524). Der rasche Abfall der Remdesivir-Plasmaspiegel geht mit dem sequentiellen Auftreten des Zwischenmetaboliten GS-704277 und des Nukleosidmetaboliten GS-441524 einher. In Zellen wandelt sich das GS-441524-Monophosphat schnell in das pharmakologisch aktive Analogon von Adenosintriphosphat (GS-443902) um, das virale RNA-Polymerasen hemmt.
Metabolisierung
Sowohl Ratte als auch Affe bildeten den Zwischenmetaboliten GS-704277 und den Nukleosidmetaboliten GS-441524. GS-441524 ist der vorherrschende Metabolit, der in allen nichtklinischen Studien beobachtet wurde.
Remdesivir ist nicht zur oralen Verabreichung geeignet, da seine schlechte Leberstabilität wahrscheinlich zu einer fast vollständigen Clearance führen würde. Zusätzlich wurde untersucht, dass auch eine intramuskuläre Applikation suboptimal ist:
Studien zur Beurteilung der i.m.-Applikation zeigten eine langsame und variable Freisetzung aus dem Muskel, Hinweise auf einen i.m.-Metabolismus und ein verzögertes Auftreten des pharmakologisch aktiven Triphosphats GS-443902 in PBMCs (Peripheral Blood Mononuclear Cell, Periphere mononukleäre Blutzellen).
Zusammengefasst: Die intravenöse Applikation gibt GS-443902 schneller und konsistenter in Zielzellen ab und wird deshalb bevorzugt.
Die Stabilität und die Halbwertszeit (HWZ) von Remdesivir in menschlichem Plasma wurde in der Studie AD-399-2012 bestimmt; Die HWZ betrug 69 Minuten. Remdesivir war im Rattenplasma instabiler (HWZ ≤ 0,9 min), was mit einer höheren Esteraseaktivität im Nagetierplasma zusammenhängen könnte.
Verteilung
Nach intravenöser Applikation von [14C] Remdesivir an Ratten und Affen war die Radioaktivität in die meisten Geweben verteilt. In Niere, Nierenmark, Leber und Arterienwand wurde ein hohes Maß an Radioaktivität gefunden. In Hirngeweben von Ratten wurde nur eine geringe oder keine Radioaktivität festgestellt, was darauf hindeutet, dass die von [14C] Remdesivir abgeleitete Radioaktivität die Blut-Hirn-Schranke schlecht passiert. Sowohl bei Ratten als auch bei Affen wurde im Hoden eine geringe Radioaktivität festgestellt, was dafür spricht, dass von [14C] Remdesivir abgeleitete Radioaktivität die Blut-Hoden-Schranke passieren kann. Es wurde keine Melaninbindung beobachtet. Der vorherrschende zirkulierende Metabolit war das Nucleosidanalogon GS-441524 sowohl bei Ratten als auch bei Affen.
Remdesivir zeigte in allen getesteten Spezies eine mäßige Proteinbindung mit einer freien Fraktion im Bereich von 8,0% bei Ratten bis 14,2% bei Cynomolgus-Affen. Die freie Fraktion beim Menschen betrug 12,1%. GS-704277 und GS-441524 zeigten eine sehr geringe Proteinbindung im Plasma aller Spezies (mittlere freie Fraktion im Bereich von 85% bis 127%).
Elimination
Studien an Ratten und Affen zeigten, dass die renale und biliäre Ausscheidung die Haupteliminationswege waren.
In der Studie GS-US-399-4231 wurde gesunden Probanden radioaktiv markiertes [14C] -Remdesivir als intravenöse Einzeldosis verabreicht (n = 8): Die mittlere Wiederfindung der [14C]-Radioaktivität in Kot und Urin betrug ungefähr 92%, wobei der größte Teil der radioaktiven Dosis aus dem Urin gewonnen wurde (ungefähr 74%). Die im Urin nachgewiesenen vorherrschenden Verbindungen waren GS-441524 (49%), gefolgt von Remdesivir (10%) und anderen Metaboliten, die 6% der gesamten radioaktiven Dosis (jeweils weniger als 2%) ausmachten. Im Kot machte M14 12% der radioaktiven Dosis aus; Alle anderen Metaboliten waren in Spuren vorhanden und machten 1% der gesamten Radioaktivität aus (jeweils weniger als 0,5%).
Linearität/Nicht-Linearität
Beim Menschen zeigt Remdesivir eine Dosisproportionalität in seiner PK bei Dosen von 3 mg bis 225 mg (Studie GS-US-399-1812). Bei Rhesusaffen wurde ein dosisproportionaler Anstieg der Remdesivir-Plasmaexposition über 3 mg / kg und 10 mg / kg (AD-399-2002 bzw. AD-399-2022) beobachtet.
Dosierung
Hinweis: Remdesivir wird aktuell zur Behandlung der Coronavirus-Krankheit 2019 (COVID-19) untersucht (siehe ClinicalTrials.gov). Zu diesem Zeitpunkt wurden Sicherheit und Wirksamkeit noch nicht nachgewiesen. Basierend auf laufenden klinischen Studien (Gilead 2020; NIH 2020a; NIH 2020b; NIH 2020c) wird Remdesivir mit 200 mg als Einzeldosis am Tag 1, gefolgt von 100 mg einmal täglich über eine Gesamtdauer von 5 bis 10 Tagen angewendet. Auf Basis der bisherigen Erkenntnisse erscheint ein Einsatz vor allem in der Frühphase der Erkrankung sinnvoll. Die Therapiedauer sollte dabei in der Regel fünf Tage betragen.
Die optimale Behandlungsdauer für COVID-19 ist nicht bekannt.
Im Rahmen der EUA (emergency use authorization) der FDA für Remdesivir zur Behandlung von COVID-19 gilt Folgendes:
- Die empfohlene Dosis für Erwachsene und pädiatrische Patienten mit einem Gewicht von ≥ 40 kg, die eine invasive mechanische Beatmung und / oder eine extrakorporale Membranoxygenierung (ECMO) benötigen, ist eine Einzeldosis von 200 mg, die am ersten Tag über 30 bis 120 Minuten intravenös infundiert wird gefolgt von einmal täglichen Erhaltungsdosen von 100 mg, die 9 Tage lang (Tage 2 bis 10) über 30 bis 120 Minuten intravenös infundiert wird.
- Die empfohlene Dosis für Erwachsene und pädiatrische Patienten mit einem Gewicht von ≥ 40 kg, die keine invasive mechanische Beatmung und / oder ECMO benötigen, ist eine Einzeldosis von 200 mg, die am ersten Tag über 30 bis 120 Minuten intravenös infundiert wird, gefolgt von einmal täglichen Erhaltungsdosen von 100 mg intravenös über 30 bis 120 Minuten für 4 Tage (Tage 2 bis 5). Wenn ein Patient keine klinische Besserung zeigt, kann die Behandlung um bis zu 5 weitere Tage (d.h. bis zu insgesamt 10 Tage) verlängert werden.
- Die empfohlene Dosis für pädiatrische Patienten mit einem Körpergewicht zwischen 3,5 kg und <40 kg, die eine invasive mechanische Beatmung und / oder ECMO benötigen, ist eine Einzeldosis Remdesivir 5 mg / kg i.v. (über 30 bis 120 Minuten infundiert) am Tag 1, gefolgt von Remdesivir 2,5 mg / kg i.v. (über 30 bis 120 Minuten infundiert) einmal täglich für 9 Tage (Tage 2 bis 10).
- Die empfohlene Dosis für pädiatrische Patienten mit einem Körpergewicht zwischen 3,5 kg und <40 kg, die keine invasive mechanische Beatmung und / oder ECMO benötigen ist eine einzelne Beladungsdosis von Remdesivir 5 mg / kg i.v. (infundiert über 30 bis 120 Minuten) an Tag 1, gefolgt von Remdesivir 2,5 mg / kg i.v. (infundiert über 30 bis 120 Minuten) einmal täglich für 4 Tage (Tage 2 bis 5).
- Wenn ein Patient keine klinische Besserung zeigt, kann die Behandlung um bis zu 5 zusätzliche Tage (d.h. Bis zu insgesamt 10 Tage) verlängert.werden.
Nebenwirkungen
Es wurden Studien durchgeführt, um die möglichen Auswirkungen von Remdesivir auf die Atemwege, das ZNS und das Herz-Kreislauf-System nach intravenöser Applikation zu untersuchen. In einer Atemwegsicherheitsstudie an Ratten hatte Remdesivir keinen Einfluss auf das Atemzugvolumen oder das Minutenvolumen. Die Atmungsraten erhöhten sich jedoch bei Tieren, denen ≥ 20 mg / kg verabreicht wurde. Nach 24 Stunden kehrten die Atmungsraten wieder auf die Kontrollwerte zurück. Remdesivir hatte keinen Einfluss auf das ZNS von Ratten und keinen Einfluss auf die kardiovaskulären Parameter bei Affen. Bei Dosierungen von bis zu 50 bzw. 10 mg / kg Remdesivir zeigte in vitro nur eine schwache Hemmung des hERG-Kanals. Die IC20- und IC50-Werte für die Hemmwirkung betrugen 7,5 µM bzw. 28,9 µM.
Klinische Sicherheit
Bis zum 14. Februar 2020 wurden vier vom Antragsteller gesponserte Phase-I-PK-Studien durchgeführt, in denen 138 gesunden Probanden Remdesivir verabreicht wurde. Die Studien untersuchten:
- Einzeldosen, 2-stündige intravenöse Applikation der Remdesivir-Lösungsformulierung in Dosen im Bereich von 3 bis 225 mg,
- Einzeldosen i.v.-Applikation der lyophilisierten Formulierung für 30 Minuten (75 mg) oder 2 Stunden (75 und 150 mg) und
- Mehrfachdosen i.v.-Applikation von Remdesivir 150 mg einmal täglich für 7 oder 14 Tage.
Die beobachteten Nebenwirkungen basieren auf gepoolten verfügbaren Nebenwirkungsdaten aus von Gilead gesponserten Studien GS-US-399-1812, GS-US-399-1954, GS-US-399-4321 und GS-US-399-5505. Die in mindestens 5 Probanden in diesen 4 Studien (n=138) beobachteten Nebenwirkungen waren:
- Phlebitis (n=8)
- Obstipation (n=7)
- Kopfschmerzen ((n=6)
- Ekchymose (n=5)
- Übelkeit (n=5)
- Schmerzen der Extremitäten (n=5)
Erhöhtes Risiko für Transaminase-Erhöhungen
Im klinischen Entwicklungsprogramm von Remdesivir wurden Transaminase-Erhöhungen beobachtet, auch bei gesunden Freiwilligen und Patienten mit COVID-19. Bei gesunden Probanden, die 14 Tage lang täglich bis zu 150 mg erhielten, wurden bei der Mehrzahl der Patienten Alanin-Aminotransferase (ALT)-Erhöhungen beobachtet, einschließlich Erhöhungen bis zum 10-fachen der Grundwerte bei einem Probanden ohne Anzeichen einer klinischen Hepatitis; Es wurden keine unerwünschten Ereignisse ≥ Grad 3 beobachtet. Transaminase-Erhöhungen wurden auch bei Patienten mit COVID-19 berichtet, die Remdesivir erhielten, einschließlich eines Patienten mit einer ALT-Erhöhung bis zum 20-fachen der Obergrenze des Normalwerts. Da bei einigen Patienten über Transaminase-Erhöhungen als Bestandteil von COVID-19 berichtet wurde, ist es schwierig, den Beitrag von Remdesivir zu Transaminase-Erhöhungen bei dieser Patientenpopulation zu erkennen.
Wechselwirkungen
Es wurden keine in-vivo-Interaktionsstudien durchgeführt.
In vitro wurde gezeigt, dass Remdesivir ein Substrat für CYP2C8, CYP2D6 und CP3A4 ist. Weiterhin ist Remdesivir ein Substrat für OATP1B1 und P-gp. Der Einfluss dieser Transporter auf die Remdesivir-Disposition wird jedoch wahrscheinlich durch den parenteralen Verabreichungsweg minimiert.
Remdesivir ist ein Inhibitor von CYP3A4, OATP1B1, OATP1B3, BSEP, MRP4 und NTCP in vitro, aber sein Potenzial für signifikante Arzneimittel-Wechselwirkungen, ist durch seine schnelle Clearance begrenzt. GS-704277 und GS-441524 sind keine Inhibitoren von humanen BSEP-, MRP2-, MRP4- oder NTCP-Transportern. Während eine Hepatozytenspender-abhängige Induktion der mRNA-Spiegel von CYP1A2 und CYP2B6 beobachtet wurde, zeigte Remdesivir keine Induktion der CYP3A4-mRNA- oder CYP3A4 / 5-Aktivität. Es wurden keine Hinweise auf eine Induktion durch GS-441524 oder GS-704277 beobachtet. In Reporterzelllinien wurde konsistent kein Potential zur Induktion von Enzymen oder Transportern über PXR oder AhR festgestellt.
Die gleichzeitige Anwendung von Remdesivir und Chloroquin oder Hydroxychloroquin wird aufgrund von in-vitro-Daten, die eine antagonistische Wirkung von Chloroquin auf die intrazelluläre Stoffwechselaktivierung und antivirale Aktivität von Remdesivir nachweisen, nicht empfohlen.
Kontraindikationen
Remdesivir darf nicht angewendet werden bei:
- bekannter Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile
- schwerer Leberfunktionsstörung
- schwerer Nierenfunktionsstörung
- Patienten mit einer eGFR < 30 ml/min
- Patienten mit einem Alanin-Aminotransferase (ALT)-Wert ≥ dem 5-Fachen der normalen Obergrenze zu Therapiebeginn
In folgenden Situationen gibt es bisher keinen Nachweis eines klinischen Nutzens bei der Anwendung von Remdesivir, weshalb hier kein Einsatz empfohlen wird:
- Patienten ohne Sauerstoffbedarf
- invasiv beatmete Patienten
- bei Niereninsuffizienz (GFR < 30 ml/min)
- Leberfunktionsstörung (GPT ≥ dem 5-Fachen der ULN oder GPT-Anstieg und Zeichen einer Hepatitis oder gleichzeitigem Anstieg von Bilirubin, AP oder INR)
Schwangerschaft/Stillzeit
Remdesivir sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für Mutter und Fötus rechtfertigt. In nichtklinischen Studien zur Reproduktionstoxizität zeigte Remdesivir keine nachteilige Wirkung auf die Embryofetalentwicklung, wenn schwangeren Tieren der vorherrschende zirkulierende Metabolitvon Remdesivir (GS-441524) verabreicht wurde, in einer Konzentration die viermal so hoch war (Ratten und Kaninchen) wie die empfohlene menschliche Dosis.
Anwendungshinweise
Einsatz trotz Anwendungsbeschränkungen
Ist ein Einsatz trotz Anwendungsbeschränkungen vorgesehen, soll eine Beratung durch das Infektiologie-Beratungsnetzwerk des Ständigen Arbeitskreises der Kompetenz- und Behandlungszentren für Krankheiten durch hochpathogene Erreger (STAKOB) und der Deutschen Gesellschaft für Infektiologie (DGI) erfolgen und das Ergebnis dokumentiert werden.
Leberfunktionsstörung
Es gibt keine spezifischen Studien mit Remdesivir an Patienten mit einer Leberfunktionsstörung. Ein erheblicher Anteil der Patienten mit akuter Ebola-Virus-Krankheit, die mit Remdesivir behandelt wurden, wiesen bei der Präsentation mittelschwere bis schwere Leber- und Nierenanomalien auf. Remdesivir wurden keine Nieren- oder Leberanomalien zugeschrieben. Angesichts des Nutzen-Risiko-Verhältnisses bei Patienten mit akuter CoV-Infektion wird derzeit keine Dosisänderung empfohlen. Remdesvir ist bei Patienten mit schwerer Leberfunktionsstörung kontraindiziert.
Nierenfunktionsstörung
Es gibt keine spezifischen Studien, die mit Remdesivir an Patienten mit Nierenfunktionsstörung durchgeführt wurden. Die Ausgangsverbindung Remdesivir weist nur eine geringe Nierenausscheidung auf. Da jedoch 49% einer radioaktiven Dosis als Metabolit GS-441524 im Urin gefunden wurden, kann eine Nierenfunktionsstörung theoretisch zu einer erhöhten Plasma-Exposition gegenüber diesem Metaboliten führen. Beide Formulierungen (Lösungsformulierung, Remdesivir (GS-5734) und lyophilisierte Formulierung, Remdesivir (GS-5734) enthalten Sulfobutylether-β-Cyclodextrin-Natrium (SBECD) als Löslichkeitsverstärker. Der Hilfsstoff SBECD wird renal ausgeschieden und reichert sich bei Patienten mit verminderter Nierenfunktion an. Angesichts des Nutzen-Risiko-Verhältnisses bei Patienten mit akuter CoV-Infektion wird derzeit bei Patienten mit leichter und mittelschwerer Nierenfunktionsstörung keine Dosisänderung empfohlen. Remdesivir ist allerdings bei Patienten mit schwerer Nierenfunktionsstörung kontraindiziert.
Hepatische Labortests
Hepatische Labortests sollten bei allen Patienten vor Beginn der Behandlung mit Remdesivir und täglich während der Behandlung mit Remdesivir durchgeführt werden. Remdesivir sollte bei Patienten mit ALT ≥ 5-facher Obergrenze des Normalwerts zu Studienbeginn nicht eingeleitet werden. Remdesivir sollte bei Patienten abgesetzt werden, die folgende Parameter entwickeln:
- ALT ≥ 5-fache Obergrenze des Normalwerts während der Behandlung mit Remdesivir. Remdesivir kann neu gestartet werden, wenn die ALT <5-mal die Obergrenze des Normalwerts beträgt.
- ALT-Erhöhung wird von Anzeichen oder Symptomen einer Leberentzündung oder einer Zunahme von konjugiertem Bilirubin, alkalischer Phosphatase oder des INR begleitet.
Studienlage
Für die Zulassung wurde die multizentrische, doppelblinde randomisierte kontrollierte Studie NIAID-ACTT-1 eingereicht.
Seitens des Herstellers wurden zwei internationale, multizentrische Phase-III-Studien (SIMPLE) durchgeführt:
- Die erste SIMPLE-Studie untersuchte die Sicherheit und Wirksamkeit von 5-tägigen- und 10-tägigen-Dosierungsschemata von Remdesivir bei Krankenhauspatienten mit schweren Manifestationen von COVID-19.
- Die zweite SIMPLE-Studie prüfte die Sicherheit und Wirksamkeit von 5-tägigen und 10-tägigen Dosierungsschemata bei Patienten mit mäßigen Manifestationen von COVID-19 im Vergleich zum Behandlungsstandard.
Wirkstoff-Informationen
- EMA: Summary on compassionate use Remdesivir Gilead
- FDA: FACT SHEET FOR HEALTH CARE PROVIDERSEMERGENCY USE AUTHORIZATION (EUA) OF REMDESIVIR (GS-5734™)
- AKDAE: Neue Arzneimittel: Remdesivir
- RKI: Wie ist die aktuelle Datenlage zur Behandlung von COVID-19 mit Remdesivir?
Abbildung
Adapted from „Remdesivir Potential Repurposed Drug Candidate for COVID-19”, by BioRender.com













