Romiplostim
Romiplostim ist ein durch rekombinante DNA-Technologie hergestelltes Fusionsprotein, das für die Behandlung von Patienten mit einer primären Immunthrombozytopenie indiziert ist, die gegenüber anderen Therapien refraktär sind. Es handelt sich um einen Thrombopoietin-Rezeptor-Agonisten, der zu einer Erhöhung der Thrombozytenwerte führt.
Romiplostim: Übersicht
Anwendung
Romiplostim (Nplate) ist indiziert für die Behandlung von Patienten mit primärer Immunthrombozytopenie (ITP), die gegenüber anderen Therapien refraktär sind (z.B. Kortikosteroide, Immunglobuline). Bei ITP ist die Thrombozytenzahl durch vermehrten Abbau und verminderte Neubildung von Thrombozyten deutlich verringert.
Mit dem Orphan Drug kam es zu einem Paradigmenwechsel in der ITP-Behandlung, da Romiplostim der erste zugelassene Wirkstoff war, der als Thrombopoetin (TPO)-Rezeptor-Agonist die Bildung von Thrombozyten im Knochenmark stimuliert.
Anwendungsart
Romiplostim wird einmal pro Woche als subkutane Injektion angewendet.
Wirkmechanismus
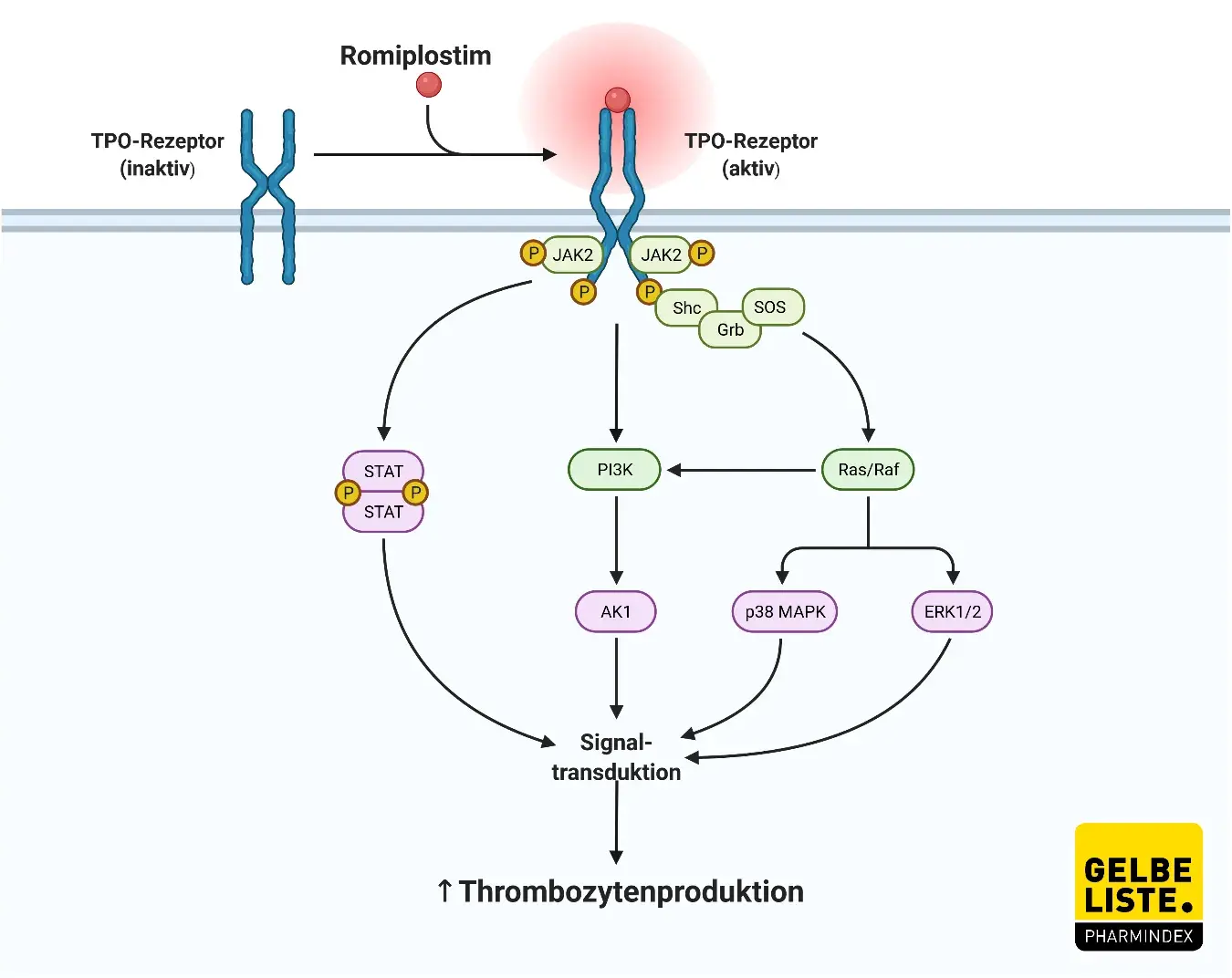
Romiplostim ist ein rekombinantes Fc-Peptid-Fusionsprotein („Peptibody“) bestehend aus einer humanen Immunglobulin-IgG1-Fc-Domäne, bei der jede Einzelketten-Untereinheit am C-Terminus kovalent an eine Peptidkette mit zwei TPO-Rezeptor-bindenden Domänen gebunden ist. Durch die Bindung an den TPO-Rezeptor kommt es zum Wachstum von Knochenmark-Megakaryozyten-Kolonie bildenden Zellen, was zu einer erhöhten Blutplättchenproduktion über JAK2- und STAT5-Kinasewege führt.
Pharmakokinetik
Resorption
- Nach subkutaner Applikation von 3 bis 15 μg/kg Romiplostim wurden maximale Serumkonzentrationen bei ITP-Patienten nach 7 bis 50 Stunden (im Median 14 Stunden) erreicht.
- Die Serumkonzentrationen variierten innerhalb der Patientenpopulation und korrelierten nicht mit der angewendeten Dosis.
- Die Serumkonzentrationen von Romiplostim scheinen invers mit den Thrombozytenzahlen zu korrelieren.
Verteilung
- Das Verteilungsvolumen von Romiplostim nach intravenöser Anwendung sank bei gesunden Probanden nicht-linear von 122 über 78,8 auf 48,2 ml/kg bei intravenösen Dosen von 0,3, 1,0 bzw. 10 μg/kg.
- Dieser nicht-lineare Abfall des Verteilungsvolumens stimmt mit der zielvermittelten Bindung von Romiplostim (an Megakaryozyten und Thrombozyten) überein, welche bei Anwendung höherer Dosen gesättigt sein könnte.
Elimination
- Die Eliminations-Halbwertszeit von Romiplostim bei ITP-Patienten variierte von 1 bis 34 Tagen (im Median 3,5 Tage).
- Die Ausscheidung von Serum-Romiplostim hängt teilweise vom TPO-Rezeptor auf den Thrombozyten ab.
- Als Ergebnis für eine angewendete Dosis weisen Patienten mit hohen Thrombozytenzahlen niedrige Serumkonzentrationen auf und umgekehrt.
- In einer anderen klinischen ITP-Studie konnte nach 6 wöchentlichen Dosen von Romiplostim (3 μg/kg) keine Akkumulation bzgl. der Serumkonzentration festgestellt werden.
Besondere Populationen
- Die Pharmakokinetik von Romiplostim scheint nicht in einem klinisch signifikanten Ausmaß durch Alter, Gewicht und Geschlecht beeinflusst zu werden.
Dosierung
Die Anfangsdosis von Romiplostim beträgt 1 μg/kg bezogen auf das aktuelle Körpergewicht. Die einmal pro Woche anzuwendende Dosis von Romiplostim sollte so lange in Schritten von 1 μg/kg erhöht werden, bis der Patient eine Thrombozytenzahl von ≥ 50 × 109/l erreicht hat. Die Thrombozytenzahlen sollten so lange wöchentlich bestimmt werden, bis eine stabile Thrombozytenzahl (≥ 50 × 109/l für mindestens 4 Wochen ohne Dosisanpassung) erreicht wurde. Danach sollten die Thrombozytenzahlen monatlich überprüft werden.
Eine maximale, einmal pro Woche anzuwendende Dosis von 10 μg/kg darf nicht überschritten werden.
Dosisberechnung:
- Anfangsdosis oder nachfolgende, einmal pro Woche anzuwendende Dosis: Aktuelles Körpergewicht bei Behandlungsbeginn in kg × Dosis in μg/kg = Individuelle Patientendosis in μg
- Anzuwendendes Volumen: Dosis in μg × 1 ml / 500 μg = Zu injizierende Menge in ml
Nebenwirkungen
Romiplostim ist im Allgemeinen gut verträglich und die unerwünschten Effekte meist moderat. Sehr häufig (≥1/10) kann es unter der Behandlung zu folgenden Nebenwirkungen kommen:
- Infektion der oberen Atemwege
- Überempfindlichkeit
- Kopfschmerzen
- Schmerzen im Oropharynx und/oder Oberbauch
Die schwersten Nebenwirkungen beinhalten:
- erneutes Auftreten von Thrombozytopenie und Blutungen nach Absetzen der Behandlung
- Retikulinvermehrung im Knochenmark
- thrombotische/thromboembolische Komplikationen
- Medikationsfehler und Progression eines vorbestehenden MDS zu AML
Wechselwirkungen
Wenn Romiplostim mit anderen Arzneimitteln zur ITP-Behandlung kombiniert wird, sollten die Thrombozytenzahlen überwacht werden, damit diese nicht außerhalb des empfohlenen Bereiches liegen. In klinischen Studien wurden Kortikosteroide, Danazol und/oder Azathioprin, intravenöse Immunglobuline (IVIG) und Anti-D-Immunglobuline für die ITP-Behandlung in Kombination mit Romiplostim eingesetzt. Diese können bei gleichzeitiger Anwendung reduziert oder abgesetzt werden, doch sollten dann die Thrombozytenzahlen überwacht werden.
Kontraindikation
Romiplostim darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der genannten sonstigen Bestandteile des Arzneimittels. Darüber hinaus sollte Romiplostim nicht bei Patienten mit mäßiger bis schwerer Leberfunktionsstörung (Child-Pugh-Klassifikation ≥ 7) angewendet werden, es sei denn, der erwartete Nutzen übersteigt bei einer mit TPO-Agonisten behandelten Thrombozytopenie in Zusammenhang mit einer Leberinsuffizienz das bekannte Risiko einer Pfortaderthrombose bei diesen Patienten.
Schwangerschaft/Stillzeit
Schwangerschaft
Tierexperimentelle Studien haben gezeigt, dass Romiplostim die Plazenta passiert und die fötalen Thrombozytenzahlen erhöht. Darüber hinaus traten Postimplantationsverluste und eine leicht erhöhte perinatale Mortalität der Jungtiere auf. Die Anwendung von Romiplostim während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die nicht verhüten, wird nicht empfohlen.
Stillzeit
Es ist nicht bekannt, ob Romiplostim und/oder seine Metabolite in die Muttermilch übergehen. Da ein Risiko für das Neugeborene/Kind kann nicht ausgeschlossen werden kann muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Romiplostim verzichtet werden soll/die Behandlung mit Romiplostim zu unterbrechen ist. Dabei sollen sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau berücksichtigt werden.
Verkehrstüchtigkeit
Romiplostim hat einen mäßigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. In klinischen Studien traten bei einigen Patienten leichte bis mäßige, vorübergehende Schwindelanfälle auf.
Anwendungshinweise
Absetzen der Behandlung
Wenn die Thrombozytenzahl nach vierwöchiger Behandlung mit Romiplostim mit der höchsten wöchentlichen Dosis von 10 μg/kg nicht auf einen Wert steigt, der ausreichend hoch ist, um klinisch signifikante Blutungen zu vermeiden, sollte die Behandlung abgebrochen werden.
Erneutes Auftreten von Thrombozytopenie und Blutungen nach Ende der Behandlung
- Nach Absetzen der Romiplostim-Behandung ist ein erneutes Auftreten einer Thrombozytopenie wahrscheinlich.
- Bei gleichzeitiger Behandlung mit Antikoagulanzien oder Thrombozytenaggregationshemmern besteht ein erhöhtes Blutungsrisiko, wenn die Behandlung mit Romiplostim abgesetzt wird.
- Patienten sollten nach Absetzen hinsichtlich eines Abfalls ihrer Thrombozytenzahl engmaschig überwacht und zur Vermeidung von Blutungen medizinisch betreut werden. Es wird empfohlen, nach dem Abbruch der Behandlung mit Romiplostim die ITP-Behandlung gemäß der aktuellen Behandlungsrichtlinien wieder aufzunehmen.
- Zusätzliche medizinische Maßnahmen können den Abbruch der Behandlung mit Antikoagulanzien und/oder Thrombozytenaggregationshemmern, die Aufhebung der Antikoagulation oder Thrombozytentransfusionen einschließen.
Erhöhtes Retikulin im Knochenmark
- Durch TPO-Rezeptor-Stimulation kann es zu erhöhtem Retikulin im Knochenmark kommen, was zu einer Vermehrung von Megakaryozyten führt, die in der Folge Zytokine freisetzen können.
- Morphologische Veränderungen der peripheren Blutzellen können auf ein erhöhtes Retikulin hindeuten, das mittels Knochenmarkbiopsie nachgewiesen werden kann. Daher werden vor und während einer Behandlung mit Romiplostim Untersuchungen auf morphologische Zellabnormitäten mittels eines peripheren Blutausstrichs und großen Blutbilds („complete blood count“, CBC) empfohlen.
- Bei Wirkungsverlust und abnormem peripherem Blutausstrich sollte die Anwendung von Romiplostim abgebrochen, eine ärztliche Untersuchung vorgenommen und eine Knochenmarkbiopsie mit entsprechender Färbung zum Retikulinnachweis in Betracht gezogen werden.
- Ein Vergleich mit einer früheren Knochenmarkbiopsie sollte bei Verfügbarkeit durchgeführt werden.
- Falls die Wirkung erhalten bleibt und beim Patienten ein abnormer peripherer Blutausstrich beobachtet wird, sollte der Arzt die klinisch angemessenen Schlüsse ziehen, welche die Erwägung einer Knochenmarkbiopsie einschließen und das Risiko-Nutzen-Verhältnis der Behandlung und alternativer ITP-Therapieoptionen erneut beurteilt werden.
Thrombotische / thromboembolische Komplikationen
Thrombozytenzahlen oberhalb des Normbereiches stellen ein Risiko für thrombotische / thromboembolische Komplikationen dar. Die Häufigkeit thrombotischer/thromboembolischer Ereignisse, die in klinischen Studien beobachtet wurden, lag für Romiplostim bei 6,0% und für Placebo bei 3,6%. Es ist Vorsicht geboten wenn Romiplostim angewendet wird:
- bei Patienten mit bekannten Risikofaktoren für Thromboembolie einschließlich, aber nicht beschränkt auf ererbte (z. B. Faktor-V-Leiden) oder
- erworbene Risikofaktoren (z. B. AT III-Mangel, Antiphospholipid-Syndrom)
- fortgeschrittenes Alter
- Patienten mit verlängerten Immobilisationsperioden
- Malignome
- Kontrazeptiva und Hormonersatztherapie
- Operation/Trauma
- Adipositas und Rauchen.
Bei Patienten mit chronischer Lebererkrankung wurden unter Romiplostim-Anwendung Fälle von thromboembolischen Ereignissen, einschließlich Pfortaderthrombose berichtet. Romiplostim sollte in diesen Populationen mit Vorsicht angewendet werden und die Anleitung zur Dosisanpassung befolgt werden.
Medikationsfehler
- Eine Überdosierung kann zu einem übermäßigen Anstieg der Thrombozytenzahlen führen, der mit thrombotischen/thromboembolischen Komplikationen in Zusammenhang steht. Wenn die Thrombozytenzahlen übermäßig erhöht sind, ist Romiplostim abzusetzen und die Thrombozytenzahlen sind zu überwachen.
- Die Wiederaufnahme der Behandlung ist entsprechend der Empfehlungen zur Dosierung und Anwendung durchzuführen.
- Eine Unterdosierung kann zu niedrigeren Thrombozytenzahlen als erwartet und zu möglichen Blutungen führen. Die Thrombozytenzahlen sollten überwacht werden.
Progression vorbestehender Myelodysplas tischer Syndrome (MDS)
- Ein positives Nutzen-Risiko-Verhältnis für Romiplostim ist nur für die Behandlung einer mit ITP assoziierten Thrombozytopenie nachgewiesen.
- Romiplostim darf nicht bei anderen Erkrankungen angewendet werden, die mit Thrombozytopenie einhergehen.
- Die Diagnose der ITP bei Erwachsenen und älteren Patienten sollte durch den Ausschluss von anderen mit Thrombozytopenie einhergehenden klinischen Entitäten bestätigt worden sein. Insbesondere muss die Diagnose eines MDS ausgeschlossen sein.
- Eine Knochenmarkpunktion und -biopsie sollte in der Regel während der Dauer der Erkrankung und Behandlung durchgeführt worden sein, insbesondere bei Patienten über 60 Jahre und bei solchen mit systemischen Symptomen oder abnormen Zeichen, wie z.B. erhöhten peripheren Blastenzellen.
- In klinischen Studien zur Behandlung von MDS-Patienten mit Romiplostim wurden Fälle von vorübergehenden Blastenanstiegen und Fälle einer Krankheitsprogression von MDS zu AML beobachtet.
- In einer randomisierten, Placebo-kontrollierten Studie mit MDS-Patienten wurde die Behandlung mit Romiplostim aufgrund einer numerischen Häufung von Krankheitsprogression zu AML und einer Erhöhung zirkulierender Blasten von mehr als 10% bei Patienten, die mit Romiplostim behandelt wurden, vorzeitig beendet.
- Bei den beobachteten MDS-Fällen mit Krankheitsprogression zu einer AML war für Patienten mit einer initialen MDS-Klassifikation RAEB-1 eine Krankheitsprogression zu AML wahrscheinlicher als für Patienten mit einem MDS geringeren Risikos.
- Außerhalb von klinischen Studien darf Romiplostim nicht zur Behandlung einer durch MDS bedingten Thrombozytopenie oder zur Behandlung einer Thrombozyto-penie anderer Ursachen als ITP angewendet werden.
Verlust des Ansprechens auf Romiplostim
Ein Verlust des Ansprechens oder das Versagen, ein Ansprechen der Thrombozyten durch die Behandlung mit Romiplostim innerhalb des empfohlenen Dosisbereiches aufrechtzuerhalten, sollte eine Suche nach ursächlichen Faktoren, einschließlich Immunogenität und Vermehrung von Retikulin im Knochenmark, nach sich ziehen.
Auswirkungen von Romiplostim auf rote und weiße Blutzellen
Veränderungen in den Parametern roter (Verringerung) und weißer (Anstieg) Blutzellen wurden in präklinischen Toxizitätsstudien (Ratte und Affe) und auch bei ITP-Patienten beobachtet. Eine gleichzeitige Anämie und Leukozytose (innerhalb eines vierwöchigen Zeitfensters) kann bei Patienten unabhängig vom Splenektomie-Status auftreten. Diese Auswirkungen wurden allerdings häufiger bei Patienten beobachtet, die sich vorher einer Splenektomie unterzogen hatten. Eine Überwachung dieser Parameter sollte bei Patienten, die mit Romiplostim behandelt werden, in Erwägung gezogen werden.
Alternativen
Die medikamentöse Behandlung einer Thrombozytopenie richtet sich maßgeblich nach deren Ätiologie. Weitere zugelassene Thrombopoetin-Rezeptoragonisten sind: Avatrombopag und Eltrombopag. Für die therapierefraktäre Immunthrombozytopenie (ITP) wurde ein SYK-Inhibitor (Fostamatinib) zugelassen, welcher die Sequestrierung von Thrombozyten in der Milz hemmt.
Studienlage
Die Wirksamkeit von Romiplostim wurde in zwei placebokontrollierten, doppelblinden Studien untersucht: Studie 1 (NCT00102323) splenektomierte, heterogen vorbehandelte Patienten (n= 63); Studie 2 (NCT00102336) nicht-splenektomierte, gegenüber Vorbehandlung refraktäre Patienten (n=62). Der primäre Endpunkt war definiert als dauerhaftes Ansprechen (wöchentliche Thrombozytenzahl von ≥50 x 109/l, mindestens 6 mal während der Studienwochen 18 bis 25 ohne Einsatz von Notfalltherapien zur Erhöhung der Thrombozytenzahl). Unter Romiplostim wurde er in Studie 1 bei 38% und in Studie 2 bei 61% gegenüber 0% bzw. 5% der Patienten (Placebo) erreicht.
Wirkstoff-Informationen
- Fachinformation Nplate
- P&T: Romiplostim (Nplate), a Treatment Option for Immune (Idiopathic) Thrombocytopenic Purpura
Abbildung: Adapted from „Thrombopoietin Receptor Signaling”, by BioRender.com
-
Nplate 125 Mikrogramm kohlpharma Pulver zur Herstellung einer Injektionslösung
kohlpharma GmbH
-
Nplate 125 Mikrogramm Orifarm Pulver zur Herstellung einer Injektionslösung
Orifarm GmbH
-
Nplate® 125 Mikrogramm Pulver zur Herstellung einer Injektionslösung
Amgen GmbH
-
Nplate 250 Mikrogramm Abacus Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Abacus Medicine A/S
-
Nplate 250 Mikrogramm axicorp B.V. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
axicorp Pharma B.V.
-
Nplate 250 Mikrogramm CC Pharma Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
CC Pharma GmbH
-
Nplate 250 Mikrogramm Eurim Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Eurim-Pharm Arzneimittel GmbH
-
Nplate 250 Mikrogramm kohlpharma Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
kohlpharma GmbH
-
Nplate 250 Mikrogramm kohlpharma Pulver zur Herstellung einer Injektionslösung
kohlpharma GmbH
-
Nplate 250 Mikrogramm Orifarm Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Orifarm GmbH
-
Nplate 250 Mikrogramm Orifarm Pulver zur Herstellung einer Injektionslösung
Orifarm GmbH
-
Nplate 250 Mikrogramm Paranova Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Paranova Pack A/S
-
Nplate® 250 Mikrogramm Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Amgen GmbH
-
Nplate® 250 Mikrogramm Pulver zur Herstellung einer Injektionslösung
Amgen GmbH
-
Nplate 500 Mikrogramm Abacus Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Abacus Medicine A/S
-
Nplate 500 Mikrogramm axicorp Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
axicorp Pharma B.V.
-
Nplate 500 Mikrogramm CC Pharma Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
CC Pharma GmbH
-
Nplate 500 Mikrogramm Eurim Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Eurim-Pharm Arzneimittel GmbH
-
Nplate 500 Mikrogramm kohlpharma Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
kohlpharma GmbH
-
Nplate 500 Mikrogramm Orifarm Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Orifarm GmbH
-
Nplate 500 Mikrogramm Paranova Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Paranova Pack A/S
-
Nplate® 500 Mikrogramm Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Amgen GmbH
-
Nplate® 500 Mikrogramm Pulver zur Herstellung einer Injektionslösung
Amgen GmbH











