SARS-CoV-2-Spike-Glycoprotein (mRNA-codiert, mRNA-1273)
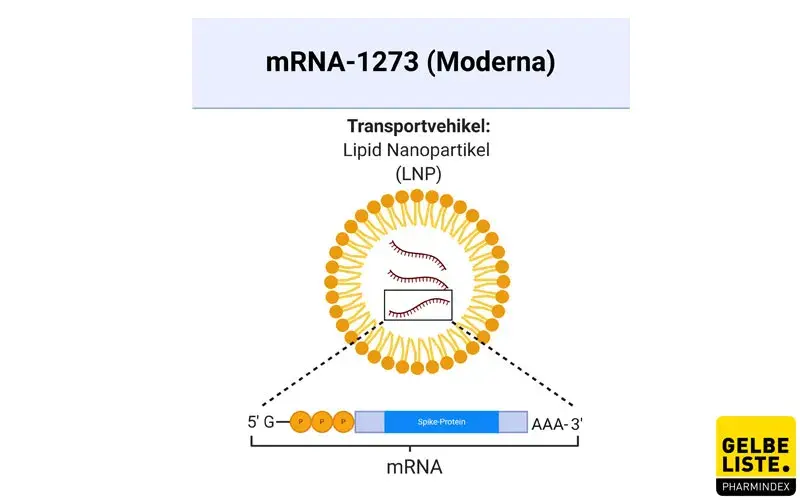
Bei mRNA-1273 (Spikevax) handelt es sich um einen durch Lipidnanopartikel verkapselten Corona-Impfstoff auf mRNA-Basis des amerikanischen Biotechnologieunternehmens Moderna. Die Vakzine ist in der EU zur aktiven Immunisierung gegen SARS-CoV-2 für Personen ab 12 Jahren zugelassen.
SARS-CoV-2-Impfstoff (mRNA-1273): Übersicht
Aktuelles
- Aktuelle Nachrichten zum Impfstoff
- Alle weiteren Informationen rund um Impfstoffbestellungen, Lagerung, Haltbarkeit, Transport, Herstellung und Updates finden Sie hier.
Anwendung
Der Corona-Impfstoff mRNA-1273 wurde von Moderna und dem US-National Institute of Allergy and Infectious Diseases (NIAID) entwickelt. Es handelt sich um einen durch Lipidnanopartikel verkapselten Impfstoff auf mRNA-Basis, der für ein präfusionsstabilisiertes Spike (S)-Protein von SARS-CoV-2 in voller Länge kodiert.
Die Vakzine ist in der EU zur aktiven Immunisierung gegen SARS-CoV-2 bei Personen ab 12 Jahren zugelassen. Die Impfung ist strikt intramuskulär (i.m.) und keinesfalls intradermal, subkutan oder intravaskulär zu verabreichen.
Anwendungsart
Der Impfstoff wird in Mehrfachdosis-Durchstechflaschen mit 10 Dosen als weiße bis cremefarbene, sterile, konservierungsmittelfreie gefrorene Suspension zur intramuskulären Injektion bereitgestellt. Nach dem Auftauen können maximal 10 Dosen (jeweils 0,5 ml) aus jeder Durchstechflasche entnommen werden.
- Die Vakzine mRNA-1273 ist eine gefrorene Suspension, die vor der intramuskulären Applikation unter gekühlten Bedingungen zwischen 2°C und 8°C für zweieinhalb Stunden aufgetaut werden muss.
- Vor der Verabreichung sollten die Fläschchen, nachdem sie aufgetaut wurden, 15 Minuten bei Raumtemperatur stehen.
- Alternativ kann der Impfstoff auch eine Stunde lang bei Raumtemperatur zwischen 15°C und 25°C auftauen.
- Nach dem Auftauen und zwischen jeder Entnahme sollen die Fläschchen vorsichtig geschwenkt aber nicht geschüttelt werden.
- Wurde der Impfstoff einmal aufgetaut, darf er nicht wieder eingefroren werden.
CAVE: Anders als BNT162b2 wird mRNA-1273 NICHT verdünnt.
Lagerung/Haltbarkeit
-
Ungeöffnet:
7 MonateUpdate: 9 Monate bei -25ºC bis -15ºC oder maximal 30 Tage bei 2°C bis 8°C lichtgeschützt oder bis zu 12 Stunden bei 8°C bis 25°C. - Nach dem Auftauen sollte der Impfstoff nicht erneut eingefroren werden.
- Nach dem ersten Gebrauch: Die chemische und physikalische Stabilität während des Gebrauchs wurde 6 Stunden lang bei 2°C bis 25°C nach der ersten Punktion nachgewiesen. Aus mikrobiologischer Sicht sollte das Produkt sofort verwendet werden. Wenn der Impfstoff nicht sofort verwendet wird, liegt die Verantwortung für die Lagerzeiten und -bedingungen beim Benutzer.
Herstellung einer Einmaldosis-Spritze
Aufziehen
- Entnahme der benötigen Anzahl Durchstechflaschen aus dem Kühlschrank und vor Verabreichung 15 Minuten bei Raumtemperatur stehen lassen.
- Impfstoff nicht schütteln oder verdünnen!
- Der Impfstoff ist nach dem Auftauen applikationsfertig und wird nicht verdünnt.
- Prüfen: weiße bis cremefarbene Dispersion, mögliche weiße oder transparente Partikel, keine Fremdpartikel oder Verfärbung.
- Entnahme von 0,5 ml Impfdosis in jeweils eine neue handelsübliche Einmalspritze mit einer neuen Einmalkanüle.
- Die diskonnektierte Spritze mit einer neuen, zur i.m. Applikation geeigneten handelsüblichen (Sicherheits-) Kanüle versehen. Das Totraumvolumen der Kanüle ist bei der Volumenabmessung zu berücksichtigen.
- Nach erster Entnahme Anbruchs-Datum und -Uhrzeit auf der Durchstechflasche notieren.
- Vor jeder weiteren Entnahme die Durchstechflasche erneut vorsichtig schwenken.
- Reste kleiner 0,5 ml sind zu entsorgen. Aus hygienischen Gründen dürfen Reste mehrerer Durchstechflaschen nicht gemischt werden.
- mRNA-1273 enthält kein Konservierungsmittel, weshalb der Impfstoff aus mikrobiologischer Sicht sofort verwendet werden sollte.
- Die angebrochenen Durchstechflaschen sind 6 Stunden bei 2 bis 25°C physikalischchemisch stabil. Die Lagerung bei 2 bis 8°C ist aus mikrobiologischen Gründen zu bevorzugen.
- Angebrochene Durchstechflaschen dürfen nicht transportiert werden.
Prüfen
- Kontrollieren Sie ob die Flüssigkeit sowohl in der Durchstechflasche als auch in der Spritze weiß bis cremefarben ist
- Kontrollieren Sie ob das Volumen der Spritze 0,5 ml beträgt.
- Die COVID-19 Vaccine Moderna kann weiße oder durchscheinende produktbezogene Partikel enthalten.
- Wenn die Dosierung nicht korrekt ist oder Verfärbungen oder andere Fremdpartikel vorliegen darf der Impfstoff nicht verabreicht werden.
Transport
- Ein Transport sollte bevorzugt bei -20°C erfolgen.
- In flüssiger Form bei 2°C bis 8°C, nur unter besonderen Vorsichtsmaßnahmen, maximal 12 Stunden.
- Transport in geeigneten Kühlbehältern.
- Mehrdosenbehältnisse dürfen während des Transports nicht wieder einfrieren!
- Transport gut gepolstert im Originalkarton (wenn dies nicht möglich ist, sollten die einzelnen Vials gut gepolstert sein).
- Kein mehrmaliger Transport (auch wenn die maximale Transportzeit nicht überschritten wird).
- Kein Transport nach Entnahme der ersten Dosis.
Wirkmechanismus
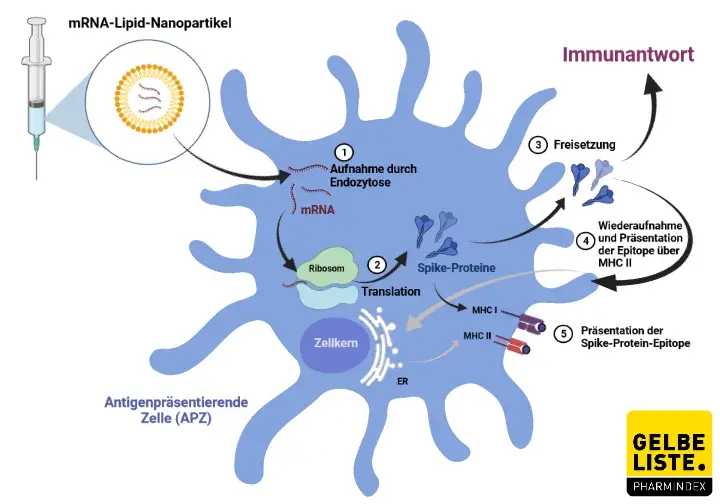
Die Nucleosid-modifizierte mRNA ist in Lipidpartikeln formuliert, die die Abgabe der Nucleosid-modifizierten mRNA in Wirtszellen ermöglicht, wo schließlich das SARS-CoV-2 S-Antigen exprimiert werden kann. Der Impfstoff kodiert für eine Version des Spike-Proteins mit einer Modifikation namens 2P, bei der das Protein zwei stabilisierende Mutationen enthält, bei denen die ursprünglichen Aminosäuren durch Proline ersetzt werden. Sobald das Protein aus der Zelle ausgeschleust wurde, wird es schließlich vom Immunsystem erkannt, das mit der Bildung von Antikörpern beginnt.
Dosierung
Der Impfstoff mRNA-1273 wird intramuskulär im Abstand von 28 Tagen als Serie von zwei Dosen mit jeweils 0,5 ml (100 μg mRNA eingebettet in SM-102-Lipidnanopartikel) verabreicht.
- Es liegen keine Daten zur Austauschbarkeit von mRNA-1273 mit anderen COVID-19-Impfstoffen vor, um die Impfserie zu vervollständigen.
- Personen, die eine Dosis des Moderna-Impfstoffs erhalten haben, sollten deshalb auch die zweite Dosis von Moderna erhalten, um die Impfserie abzuschließen.
Hilfsstoffe
Folgende Hilfsstoffe sind enthalten:
- das proprietäre, ionisierbare Lipid SM-102
- 1,2-Dimyristoyl-rac-glycero-3-methoxypolyethylenglycol-2000 [PEG2000-DMG]
- Cholesterol
- 1,2-Distearoyl-sn-glycero-3-phosphocholin [DSPC]
- Tromethamin
- Tromethaminhydrochlorid
- Essigsäure
- Natriumacetat
- Saccharose
Nebenwirkungen
Nebenwirkungen, die in der klinischen Studie berichtet wurden, umfassen (Angaben gegenüber Placebo):
- Schmerzen an der Injektionsstelle (83.7% vs. 19.8%)
- Müdigkeit (68,5% vs. 36,1%)
- Kopfschmerzen (63,0% vs. 36,5%)
- Myalgie (59,6% vs. 20,1%)
- Arthralgie (44,8% vs. 17,2%)
- Schüttelfrost (43,4% vs. 9,5%)
- Übelkeit / Erbrechen (21,3% vs. 7,3%)
- Axilläre Lymphadenopathie (10,2% vs. 4,8%)
- Fieber (14,8% vs. 0,6%)
- Schwellung und Erythem an der Injektionsstelle (0.7% vs. <0,1%)
Über lokale Nebenwirkungen, die innerhalb von sieben Tagen nach jeder Dosis auftraten, berichteten 84,2% (nach der ersten Dosis) beziehungsweise 88,8% (nach der zweiten Dosis) der Impfstoffgruppe. In der Placebogruppe berichteten 19,8% beziehungsweise 18,8% über lokale Nebenwirkungen.
Lokale Nebenwirkungen, die länger als sieben Tage nach jeder Dosis anhielten, wurden sowohl von Impfstoffempfängern als auch Personen der Placebogruppe berichtet (3,7% vs. 1,3%). Häufige lokale Reaktionen, die in der jüngeren Alterskohorte bei Impfstoff- vs. Placebo-Empfängern über sieben Tage anhielten, waren Schmerzen (1,5% vs. 0,6%) und axilläre Lymphadenopathie (2,5% vs. 0,7%) sowie in der älteren Alterskohorte Schmerzen (1,2% vs.0,6%) und Erythem (0,7% vs. <0,1%).
Zu den häufigsten systemischen Nebenwirkungen in der Impfstoffgruppe gegenüber der Placebogruppe zählten Kopfschmerzen (63,0% vs. 36,5%), Myalgie (59,6% vs. 20,1%), Arthralgie (44,8% vs. 17,2%) und Schüttelfrost (43,4% vs. 9,5%).
Die am häufigsten berichteten systemischen Nebenwirkungen, die über sieben Tage anhielten, waren in der Impfstoffgruppe gegenüber der Placebogruppe im Alter von 18 bis 64 Jahren Müdigkeit (5,7% vs. 5,0%), Kopfschmerzen (4,8% vs. 4,0%), Myalgie (2,7% vs. 2,7%) und Arthralgie (2,6% vs. 2,8%); in der älteren Kohorte waren es Müdigkeit (5,8% vs. 4,5%), Arthralgie (3,7% vs. 3,8%), Myalgie (2,9% vs. 2,7%) und Kopfschmerzen (2,8% vs. 2,7%).
Myokarditis
Das erhöhte Risiko einer Myokarditis nach der Impfung mit Spikevax ist bei jüngeren Männern am höchsten. In zwei großen europäischen pharmako-epidemiologischen Studien wurde das erhöhte Risiko bei jüngeren Männern nach der zweiten Dosis Spikevax abgeschätzt. Eine Studie zeigte, dass in einem Zeitraum von 7 Tagen nach der zweiten Dosis etwa 1,316 (95 %-KI: 1,299-1,333) zusätzliche Fälle von Myokarditis bei 12- bis 29-jährigen Männern pro 10 000 Personen im Vergleich zu nicht exponierten Personen auftraten. In einer anderen Studie wurden in einem Zeitraum von 28 Tagen nach der zweiten Dosis 1,88 (95%-KI: 0,956-2,804) zusätzliche Fälle von Myokarditis bei 16- bis 24-jährigen Männern pro 10 000 Personen im Vergleich zu nicht exponierten Personen festgestellt.
Vollständiger Sicherheitsbericht des Paul-Ehrlich-Instituts vom 27.12.2020 bis 30.11.2021
Wechselwirkungen
Es liegen keine Daten zur Beurteilung der gleichzeitigen Anwendung von mRNA-1273 mit anderen Impfstoffen vor. Die STIKO rät, dass zu anderen planbaren Impfungen ein Mindestabstand eingehalten wird: 14 Tage vor Beginn und 14 Tage nach Ende der Impfserie.
Kontraindikation
mRNA-1273 darf nicht angewendet werden bei bekannter Vorgeschichte einer schweren allergischen Reaktion (z. B. Anaphylaxie) auf eine Komponente des Impfstoffs.
Schwangerschaft
Empfehlung der COVID-19-Impfung für schwangere und stillende Frauen der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe e.V. :
Die COVID-19-Impfung von Schwangeren mit mRNA-basierten Impfstoffen
- führt nicht vermehrt zu schwangerschaftsspezifischen Komplikationen: Die systematische Nachbeobachtung mRNA-basiert geimpfter Schwangerer im US-amerikanischen V-safe Pregnancy Register (100.599 registrierte Frauen, die einen mRNA-Impfstoff in der Schwangerschaft erhielten; 4.711 analysierte Schwangerschaften; Stand 26.04.2021) zeigt keinen Hinweis für vermehrte Komplikationen (Abort, Totgeburt, Frühgeburt, fetale Wachstumseinschränkung, Fehlbildungen, neonatales Versterben).
- führt nicht zu einem erhöhten Morbiditäts- oder Mortalitätsrisiko für die Schwangere oder die Feten.
- weist keine Unterschiede im Nebenwirkungsprofil im Vergleich zu Nicht-Schwangeren auf.
- kann durch die durch Impfimmunisierung gebildeten und transplazentar übertragenen mütterlichen Antikörper einen potenziellen Infektionsschutz (Leihimmunität) für das Neugeborene bewirken. So kann neben der Schwangeren potenziell auch das Kind geschützt werden
Stillzeit
Die DGGG empfiehlt nach informierter partizipativer Entscheidungsfindung und nach Ausschluss allgemeiner Kontraindikationen, stillenden Frauen eine mRNA-basierte Impfung gegen COVID-19 anzubieten und zu ermöglichen.
Die COVID-19-Impfung von Stillenden mit mRNA-basierten Impfstoffen
- weist eine gleichwertige Antikörperbildung und ein ähnlich geringes Nebenwirkungsprofil wie in der Schwangerschaft und bei nicht-schwangeren Frauen auf.
- kann eine Nestimmunität hervorrufen, da impfinduzierte Antikörper in der Muttermilch nachgewiesen werden können.
- erfordert keine Stillpause oder -verzicht, da die mRNA des Impfstoffes nicht in der Muttermilch nachgewiesen werden konnte.
Verkehrstüchtigkeit
mRNA-1273 hat keinen oder vernachlässigbaren Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Einige der Nebenwirkungen können jedoch vorübergehend die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen.
Studienlage
Grundlage der Zulassung bildet die klinische Phase-III-Studie mRNA-1273-P3018 (NCT04470427), in der 30.351 Teilnehmer mit negativem SARS-CoV-2-Status zu Studienbeginn im Verhältnis 1:1 randomisiert wurden und entweder intramuskuläre Injektionen von 100 µg des mRNA-1273-Impfstoffs (n=15.181) oder Placebo (n=15.166) an den Tagen 1 und 29 erhielten.
Das Durchschnittsalter betrug 52 Jahre (Bereich 18-95); 22.831 (75,2%) der Teilnehmer waren zwischen18 und 64 Jahre alt und 7.520 (24,8%) der Teilnehmer waren 65 Jahre und älter.
Die demografischen Merkmale der Probanden in der mRNA-1273-Gruppe und der Placebogruppe waren vergleichbar.
Die Randomisierung erfolgte nach Alter und Gesundheitsrisiko:
- 18 bis <65 Jahre ohne Komorbiditäten (kein Risiko für schweren COVID-19-Verlauf),
- 18 bis <65 Jahre mit Komorbiditäten (Risiko für schweren COVID-19-Verlauf)
- ≥ 65 Jahre mit oder ohne Komorbiditäten
Teilnehmer, die immunkomprimiert waren und Teilnehmer mit einer bekannten SARS-CoV-2-Infektion in der Vorgeschichte wurden von der Studie ausgeschlossen.
Die Studie ermöglichte außerdem die Einbeziehung von Teilnehmern mit stabilen vorbestehenden Erkrankungen (keine signifikante Therapieänderung, Verschlechterung der Erkrankung oder Krankenhauseinweisung 3 Monate vor Aufnahme), sowie von Teilnehmern mit stabiler HIV-Infektion.
Insgesamt wurden 24.907 (82,1%) Teilnehmer aufgenommen, die ein erhöhtes berufliches Risiko für eine SARS-CoV-2-Infektion aufwiesen. 7613 Personen (25,1%) waren hiervon im Gesundheitswesen tätig.
Primärer Endpunkt
Der primäre Endpunkt wurde definiert als Wirksamkeit des Impfstoffs zur Verhinderung von protokolldefiniertem COVID-19 bis mindestens 14 Tage nach der zweiten Dosis. Für die Wirksamkeitsanalyse waren nach Studiendesign 151 COVID-19-Fälle vorgesehen.
Wirksamkeit von 94 Prozent
Ein erster Zwischenanalysezeitpunkt erfolgte bei 53 COVID-19-Fällen und ein zweiter bei 106 COVID-19-Fällen. Aus den Daten ließ sich eine Impfstoffwirksamkeit, die mindestens 14 Tage nach der zweiten Dosis auftrat, von 94,1% (95%-Konfidenzintervall von 89,3% bis 96,8%) ableiten. In der Impfstoffgruppe wurden 11 COVID-19-Fälle gemeldet, wohingegen es in der Placebogruppe 185 Fälle waren.
Anwendungshinweise
Anaphylaktische Reaktionen
Für akute anaphylaktische Reaktionen muss eine medizinische Notfallausrüstung zur Verfügung stehen. Eine Nachbeobachtung sollte für mindestens 15 Minuten gewährleistet sein. Wenn nach der ersten Dosis anaphylaktische Reaktionen auftreten soll die zweite Impfung nicht erfolgen.
Akute Infektionen
Bei akuten Infektionen sollte die Impfung verschoben werden. Milde Krankheitssymptome sind kein Grund, die Impfung zu verschieben.
Gerinnungsstörungen
Bei antikoagulierten Personen oder Personen mit Gerinnungsstörungen, bei denen eine intramuskuläre Injektion kontraindiziert ist, sollte die Impfung nur erfolgen, wenn der Nutzen die Risiken übersteigt. Nach sorgfältiger Nutzen Risiko-Abwägung kann eine intramuskuläre Injektion mit einer dünnen Nadel (23 G oder 25 G) und anschließender Kompression mit einem Tupfer auf die Injektionsstelle erfolgen.
Immunsupprimierte Personen
Immunsupprimierte Personen, einschließlich Personen, die eine immunsuppressive Therapie erhalten, können eine verminderte Immunantwort auf die Impfung zeigen. Es liegen keine Daten zur gleichzeigen Gabe von Immunsuppressiva oder zu Personen, die schon eine Impfung mit einem anderen COVID19 Impfstoff erhalten haben, vor.
Alternativen
Neben mRNA-1273 sind in der EU noch vier weitere Corona-Impfstoffe zugelassen, darunter:
- BNT162b2 (Comirnaty) von BioNTech/Pfizer
- AZD1222 (Vaxzevria) von AstraZeneca
- Ad26.COV2.S (COVID-19 Vaccine Janssen) von Janssen
- NVX-CoV2373 (Nuvaxovid) von Novavax
Eine umfangreiche Vergleichsseite der zugelassenen Impfstoffe finden Sie hier.
- FDA Briefing Document: Moderna COVID-19 Vaccine
- Moderna: Fact sheet for healthcare providers
- EMA: EMA recommends COVID-19 Vaccine Moderna for authorisation in the EU
- EMA: product information
- KVWL: COVID-19 Vaccine Moderna
- DGGG: Empfehlung der COVID-19-Impfung für schwangere und stillende Frauen











