SARS-CoV-2-Spike-Glycoprotein, trimer (NVX-CoV2373)
NVX-CoV2373 (Nuvaxovid) ist ein proteinbasierter Corona-Impfstoff des US-Herstellers Novavax, der virusähnliche Partikel (Virus like Particles, VLP) enthält, die das Spike-Protein von SARS-CoV-2 präsentieren und zusammen mit dem patentierten Saponin-basierten Matrix-M-Adjuvans von Novavax in Nanopartikeln formuliert sind.
NVX-CoV2373: Übersicht
Anwendung
NVX-CoV2373 (Nuvaxovid) ist ein proteinbasierter Corona-Impfstoff des US-Herstellers Novavax, der als fünfte COVID-19-Vakzine in der EU zur Vorbeugung von COVID-19 zugelassen wurde.
Anwendungsart
Nuvaxovid wird intramuskulär in den Deltamuskel des Oberarms appliziert.
Lagerung/Haltbarkeit
NVX-CoV2373 wird bei 2°C bis 8°C gelagert und ist in einer gebrauchsfertigen Flüssigformulierung von 5 ml mit 10 Dosen verpackt.
-
Ungeöffnet: 9 Monate bei 2°C bis 8 °C, vor Licht geschützt. Der Impfstoff ist bei 25°C bis zu 12 Stunden nachweislich stabil. Eine Aufbe-
wahrung bei 25 °C entspricht jedoch nicht den empfohlenen Aufbewahrungs- oder Transportbedingungen - Angebrochene Durchstechflasche: Aus mikrobiologischer Sicht sollte der Impfstoff nach Anbruch (erster Nadeleinstich) sofort verwendet werden. Wird der Impfstoff nicht sofort verwendet, liegen die Lagerzeiten und -bedingungen während des Gebrauchs in der Verantwortung des Anwenders.
Herstellung
Die Herstellung von Nuvaxovid erfolgt durch rekombinante DNA-Technologie unter Verwendung eines Baculovirus-Expressionssystems in einer Insektenzellinie, die von Sf9-Zellen der Spezies Spodoptera frugiperda abgeleitet ist.
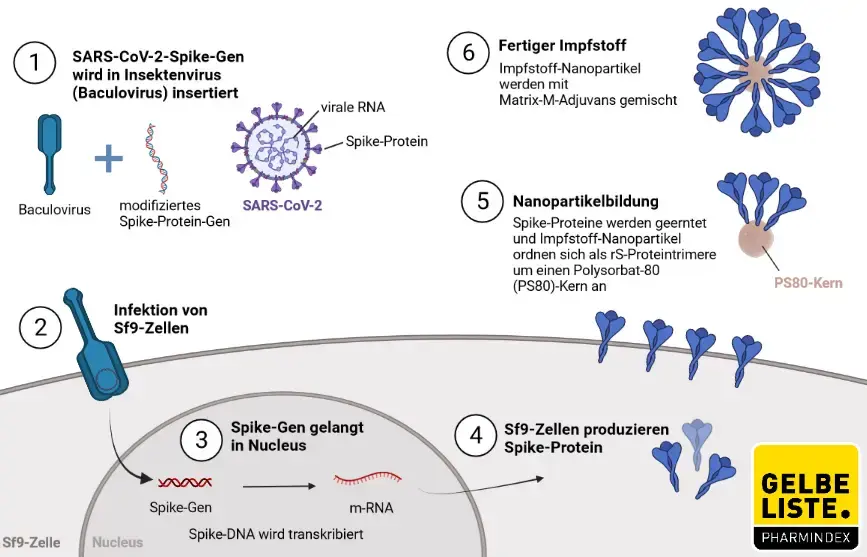
Wirkmechanismus
Nuvaxovid ist ein proteinbasierter Impfstoff, der virusähnliche Partikel (Virus like Particles, VLP) enthält, die das Spike-Protein von SARS-CoV-2 präsentieren und zusammen mit einem Matrix-M1-Adjuvans in Nanopartikeln formuliert sind. Dieses Adjuvans verbessert die Immunantwort und stimuliert neutralisierende Antikörper. Das patentierte Matrix-M-Adjuvans auf Saponin-Basis von Novavax konnte eine starke und gut verträgliche Wirkung zeigen. Nach Herstellerangaben stimuliert es den Eintritt von Antigen-präsentierenden Zellen in die Injektionsstelle, verbessert die Antigen-Präsentation in lokalen Lymphknoten und verstärkt die Immunantwort. Die beiden Impfstoffkomponenten lösen B- und T-Zell-Immunantworten auf das Spike-Protein aus, einschließlich neutralisierender Antikörper.
Dosierung
Nuvaxovid wird intramuskulär in zwei Dosen zu je 0,5 ml verabreicht. Es wird empfohlen die zweite Dosis 3 Wochen nach der ersten Dosis zu verabreichen. Eine Dosis (0,5 ml) enthält 5 Mikrogramm des SARS-CoV-2-Spike-Proteins* und wird mit Matrix-M Adjuvans Matrix-M ergänzt, das pro 0,5-ml-Dosis Fraktion-A (42,5 Mikrogramm) und Fraktion-C (7,5 Mikrogramm) von Quillaja saponaria Molina-Extrakt enthält.
* hergestellt durch rekombinante DNA-Technologie unter Verwendung eines Baculovirus-Expressionssystems in einer Insektenzellinie, die von Sf9-Zellen der Spezies Spodoptera frugiperda abgeleitet ist.
Nebenwirkungen
Die Sicherheit von Nuvaxovid wurde anhand einer Zwischenanalyse gepoolter Daten aus fünf laufenden klinischen Studien in Australien, Südafrika, Großbritannien, den Vereinigten Staaten und Mexiko bewertet. Zum Zeitpunkt der Analyse erhielten insgesamt 49.950 Teilnehmer im Alter von 18 Jahren und älter mindestens eine Dosis Nuvaxovid (n=30.058) oder Placebo (n=19.892). Das Durchschnittsalter lag bei 48 Jahren (Spanne 18 bis 95 Jahre). Die mediane Nachbeobachtungsdauer betrug 70 Tage nach der zweiten Dosis. Bei 32.993 Teilnehmern (66%) erfolgte die Nachbeobachtung über mehr als zwei Monate nach der zweiten Dosis.
Von den gepoolten Reaktogenitätsdaten, die Teilnehmer ab 18 Jahren einschlossen, die in die beiden Phase-III-Studien aufgenommen wurden und mindestens eine Dosis Nuvaxovid (n=19.898) oder Placebo (n=10.454) erhielten, waren die häufigsten Nebenwirkungen:
- Empfindlichkeit an der Injektionsstelle (75%)
- Schmerzen an der Injektionsstelle (62%)
- Müdigkeit (53%)
- Muskelschmerzen (51%)
- Kopfschmerzen (50%)
- Unwohlsein (41%)
- Arthralgie (24%)
- Übelkeit oder Erbrechen (15%)
Die Nebenwirkungen waren in der Regel leicht bis mittelschwer mit einer medianen Dauer von ≤ 2 Tagen für lokale Nebenwirkungen und ≤ 1 Tag für systemische Ereignisse nach der Impfung.
Insgesamt trat eine höhere Inzidenz von Nebenwirkungen in jüngeren Altersgruppen auf: Die Inzidenz der genannten Nebenwirkungen war bei Erwachsenen im Alter von 18 bis unter 65 Jahren höher Jahre als bei den über 65-Jährigen.
Lokale und systemische Nebenwirkungen wurden nach der zweiten Impfung häufiger berichtet als nach der ersten Impfung.
Wechselwirkungen
- Die gleichzeitige Anwendung von Nuvaxovid mit inaktivierten Influenza-Impfstoffen wurde an einer begrenzten Zahl von Teilnehmern in einer explorativen klinischen Sub-Studie untersucht.
- Die Antikörperantwort auf SARS-CoV-2 viel geringer aus, wenn Nuvaxovid gleichzeitig mit einem inaktivierten Influenza-Impfstoff verabreicht wurde. Die klinische Bedeutung davon ist unbekannt.
- Die gleichzeitige Anwendung von Nuvaxovid mit anderen Impfstoffen wurde nicht untersucht.
Kontraindikationen
Nuvaxovid darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile:
- Dinatriumhydrogenphosphat-Heptahydrat
- Natriumdihydrogenphosphat-Monohydrat
- Natriumchlorid
- Polysorbat 80
- Natriumhydroxid (zur Einstellung des pH-Wertes)
- Salzsäure (zur Einstellung des pH-Wertes)
Adjuvans (Matrix-M):
- Cholesterin
- Phosphatidylcholin (einschließlich all-rac-α-Tocopherol)
- Kaliumdihydrogenphosphat
- Kaliumchlorid
- Dinatriumhydrogenphosphat-Dihydrat
- Natriumchlorid
Schwangerschaft
Bisher liegen nur sehr begrenzte Erfahrungen mit der Anwendung von Nuvaxovid bei Schwangeren vor. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf Schwangerschaft, embryonale/fötale Entwicklung, Geburt oder postnatale Entwicklung. Eine Anwendung während der Schwangerschaft sollte nur dann erfolgen, wenn der mögliche Nutzen die potenziellen Risiken für die Mutter und den Fötus überwiegt.
Stillzeit
Es ist nicht bekannt, ob Nuvaxovid in die Muttermilch übergeht. Es wird davon ausgegangen, dass Nuvaxovid keine Auswirkungen auf das gestillte Neugeborene/Kind hat, weil die systemische Exposition der stillenden Frau gegenüber Nuvaxovid vernachlässigbar ist.
Verkehrstüchtigkeit
Nuvaxovid hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Einige der möglichen Nebenwirkungen können
jedoch vorübergehend die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen.
Studienlage
Grundlage der Zulassung bilden die Ergebnisse zweier klinischer Hauptstudien, die zeigen, dass Nuvaxovid bei der Vorbeugung von COVID-19 bei Menschen ab 18 Jahren wirksam war. An den Studien nahmen insgesamt über 45.000 Personen teil.
Studie 1 (2019nCoV-301)
Studie 1 ist eine laufende multizentrische, randomisierte, beobachterblinde, placebokontrollierte klinische Phase-III-Studie an Teilnehmern ab 18 Jahren in den USA und Mexiko. Bei der Einschreibung waren die Teilnehmer stratifiziert nach Alter (18 bis 64 Jahre und ≥ 65 Jahre) und im Verhältnis 2:1 der Behandlung mit Nuvaxovid oder Placebo zugeordnet. Die primäre Wirksamkeitsanalysepopulation (als Per-Protocol Efficacy [PP-EFF]-Analyseset bezeichnet) umfasste 25.452 Teilnehmer, die entweder Nuvaxovid (n=17.312) oder Placebo (n=8.140) bekamen.
Ergebnisse
Die Impfstoffwirksamkeit von Nuvaxovid zur Verhinderung von COVID-19 sieben Tage nach der zweiten Dosis betrug 90,4% (95%-KI: 82,9 – 94,6). Bei den 17.312 Nuvaxovid-Teilnehmern wurden keine Fälle von schwerem COVID-19 gemeldet, verglichen mit 4 Fällen von schwerem COVID-19 bei den 8.140 Probanden der Placebo-Gruppe.
Subgruppenanalysen des primären Wirksamkeitsendpunkts zeigten ähnliche Wirksamkeitspunktschätzungen für männliche und weibliche Teilnehmer und ethnische Gruppen sowie bei Teilnehmern mit medizinischen Komorbiditäten, die mit einem hohen Risiko für schweres COVID-19-Verläufe verbunden sind. Es gab keine signifikanten Unterschiede in der Gesamtwirksamkeit des Impfstoffs bei Teilnehmern mit einem erhöhten Risiko für schweres COVID-19, einschließlich derer mit einer oder mehreren Komorbiditäten, die das Risiko für schweres COVID-19 erhöhen (z. B. BMI ≥ 30 kg/m2, chronische Lungenerkrankung, Diabetes mellitus Typ 2, Herz-Kreislauf-Erkrankungen und chronische Nierenerkrankungen).
Wirksamkeit gegenüber Corona-Varianten
Für 61 der 77 Endpunktfälle (79%) lagen Sequenzierungsdaten vor. Von diesen wurden 48 von 61 (79%) als besorgniserregende Varianten (VOC) oder Varianten von Interesse (VOI) identifiziert. Die am häufigsten identifizierten besorgniserregenden Varianten waren: Alpha mit 31/61 Fällen (51%), Beta (2/61,4%) und Gamma (2/61,4%), während die häufigsten Varianten von Interesse Iota mit 8/61 Fälle (13%) und Epsilon (3/61,5%) waren.
Studie 2 (2019nCoV-302)
Studie 2 ist eine laufende multizentrische, randomisierte, beobachterblinde, placebokontrollierte klinische Phase-III-Studie an Teilnehmern im Alter von 18 bis 84 Jahren in Großbritannien. Bei der Einschreibung wurden die Teilnehmer stratifiziert nach Alter (18 bis 64 Jahre; 65 bis 84 Jahre), und Nuvaxovid oder Placebo zugeteilt.
Die Einschreibung wurde im November 2020 abgeschlossen. Die Teilnehmer werden bis zu 12 Monate nach der Grundimmunisierung zur Bewertung der Sicherheit und Wirksamkeit gegen COVID-19 nachbeobachtet. Das Set zur primären Wirksamkeitsanalyse (PP-EFF) umfasste 14.039 Teilnehmer, die entweder Nuvaxovid (n=7.020) oder Placebo (n=7.019) erhielten.
Ergebnisse
Die Impfstoffwirksamkeit von Nuvaxovid zur Verhinderung von COVID-19 sieben Tage nach der zweiten Dosis betrug 89,7% (95%-KI: 80,2 – 94.6). Bei den 7.020 Nuvaxovid-Teilnehmern wurden keine Fälle von schwerem COVID-19 gemeldet, verglichen mit 4 Fällen von schwerem COVID-19 bei den 7.019 Probanden unter Placebo.
Wirksamkeit gegenüber Corona-Varianten
Für 95 der 106 Endpunktfälle (90%) lagen Daten zu Coronavarianten vor: 66 von 95 Fällen (69%) wurden als Alpha-Variante identifiziert, während die anderen Fälle als Nicht-Alpha klassifiziert wurden.
Omikron-Wirkung wird angezweifelt
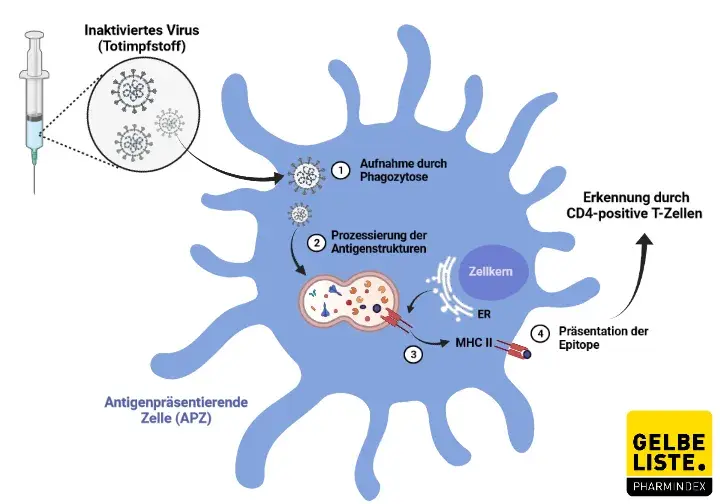
Da Nuvaxovid im Gegensatz zu den anderen vier zugelassenen Corona-Impfstoffen nur eine humorale Immunantwort erzeugt, wird die Wirksamkeit des Impfstoffs gegenüber der neuen Omikron-Variante von Fachleuten sehr kritisch beäugt. Omikron muss nämlich hauptsächlich zytotoxisch bekämpft werden, da die Variante die humorale Immunantwort unterlaufen kann.
Zur Erklärung: Sowohl die beiden mRNA-Impfstoffe Comirnaty und Spikevax, als auch die zwei Vektor-Impfstoffe Vaxzevria und die COVID-19-Vakzine Janssen sind "Totimpfstoffe", die sich allerdings aufgrund der zellinternen Spike-Protein-Produktion wie "Lebendimpfstoffe" verhalten; Totimpfstoffe können nur eine humorale Immunantwort bewirken (Antikörper durch B-Zellen), während Lebenimpfstoffe sowohl eine humorale als auch zytotoxische Immunantwort auslösen (Antikörper durch B-Zellen, zytotoxische Antwort durch T-und NK-Zellen).
Alternativen
Neben NVX-CoV2373 von Novavax sind in der EU noch vier weitere Corona-Impfstoffe zugelassen, darunter:
- BNT162b2 (Comirnaty) von BioNTech/Pfizer
- mRNA-1273 (Spikevax) von Moderna
- AZD1222 (Vaxzevria) von AstraZeneca
- Ad26.COV2.S (COVID-19 Vaccine Janssen) von Janssen
Eine umfangreiche Vergleichsseite der zugelassenen Impfstoffe finden Sie hier.
- NIH: U.S. clinical trial results show Novavax vaccine is safe and prevents COVID-19
- Novavax: Novavax COVID-19 Vaccine Demonstrates 90% Overall Efficacy and 100% Protection Against Moderate and Severe Disease in PREVENT-19 Phase 3 Trial
- EMA: Fachinformation Nuvaxovid
- EMA: EMA recommends Nuvaxovid for authorisation in the EU, 20.12.2021
Abbildung
Created with Biorender in Anlehnung an Corporate overview and investor deck, Nasdaq: NVAX | September 2021











