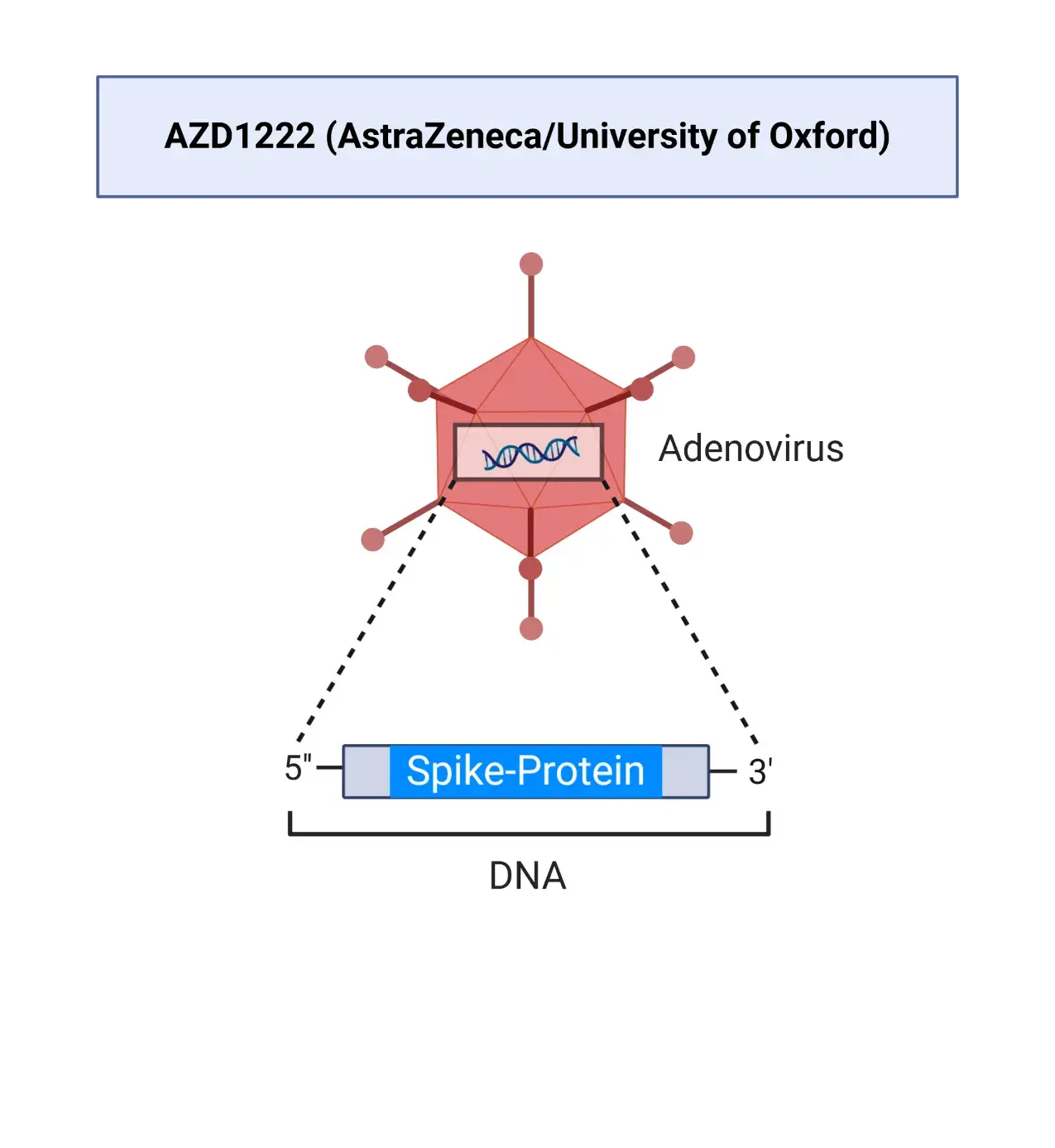
SARS-CoV-2-Spike-Glycoprotein (ChAdOx1-S)
AZD1222 (Vaxzevria) ist ein Corona-Impfstoff des britisch-schwedischen Pharmakonzerns AstraZeneca und der Universität Oxford. Der Impfstoff wird aus einer geschwächten Version eines Erkältungsvirus (Adenovirus) ChAdOx1 hergestellt, der Infektionen bei Schimpansen verursacht und genetisch so verändert wurde, dass er replikationsdefizient ist. ChAd steht für den Schimpansen-Adenovirus.
SARS-CoV-2-Impfstoff (AZD1222): Übersicht
Anwendung
Der replikationsdefiziente Schimpansen-Adenovirus-Vektor AZD1222 von AstraZeneca ist unter dem Namen "Vaxzevria" zur aktiven Immunisierung von Personen ab 18 Jahren zur Vorbeugung der Coronavirus-Krankheit 2019 (COVID-19) indiziert.
- Aufgrund neuer Daten empfahl die STIKO seit dem 4. März 2021 den Corona-Impfstoff AZD1222 von AstraZeneca auch für über 65-Jährige.
- Auf Basis der verfügbaren Daten zu den kürzlich gemeldeten sehr schweren thromboembolischen Nebenwirkungen 4 bis 16 Tage nach der Impfung, die überwiegend bei Personen im Alter unter 60 Jahren auftraten, und unter Hinzuziehung externer Experten hat die Ständige Impfkommission (STIKO) am 30. März 2021 mehrheitlich entschieden, den Corona-Impfstoff AZD1222 von AstraZeneca nur noch für Personen ab einem Alter von 60 Jahren zu empfehlen.
Alle Updates zu Lagerung, Transport, Herstellung, Haltbarkeit etc. im Vergleich zu den anderen zugelassenen Corona-Impfstoffen finden Sie hier.
Zuvor sollte aus Sicht der STIKO der Corona-Impfstoff AZD1222 nur bei 18- bis 64-Jährigen angewendet werden. Die Wirksamkeit bei Älteren war zu diesem Zeitpunkt nicht ausreichend belegt. Abgesehen von dieser Einschränkung wurdeder Impfstoff jedoch als gleichermaßen geeignet wie die bereits zugelassenen Corona-Impfstoffe angesehen. Auch die EMA räumte ein, dass bei älteren Teilnehmern (über 55 Jahre) noch nicht genügend Ergebnisse vorliegen, um eine Aussage darüber zu treffen, wie gut der Impfstoff in dieser Gruppe wirke. Da jedoch ein Schutz erwartet wird, weil auch in dieser Altersgruppe eine Immunantwort beobachtet wurde, waren die wissenschaftlichen Experten der EMA der Ansicht, dass der Impfstoff bei älteren Erwachsenen angewendet werden kann.
Hinweise der STIKO
- Tritt nach Verabreichung der 1. Impfstoffdosis eine labordiagnostisch gesicherte (positive PCR) SARS-CoV-2-Infektion auf, soll die Verabreichung der 2. Impfstoffdosis etwa 6 Monate nach Genesung bzw. Diagnosestellung erfolgen
- Im Allgemeinen wird eine Nachbeobachtungszeit nach der COVID-19-Impfung von mindestens 15 Minuten empfohlen. Längere Nachbeobachtungszeiten von bis zu 30 Minuten sollten vorsichtshalber bei bestimmten Risikopersonen eingehalten werden, z. B. bei Personen mit Gerinnungshemmung, stärkeren oder anaphylaktischen Reaktionen auf Impfungen in der Anamnese.
Anwendungsart
AZD1222 wird intramuskulär im Abstand von 4 bis maximal 12 Wochen (28 bis 84 Tage) in den Deltamuskel verabreicht. Die STIKO empfiehlt einen Abstand von 12 Wochen. Es wird empfohlen, dass Personen, die eine erste Dosis AZD1222 erhalten haben, die zweite Dosis vom gleichen Hersteller bekommen. Die Impfung ist strikt intramuskulär (i.m.) und keinesfalls intradermal, subkutan oder intravaskulär zu verabreichen. Der Impfstoff ist applikationsfertig und wird vor der Applikation nicht verdünnt.
Aussehen
Die Lösung ist farblos bis leicht braun, klar bis leicht undurchsichtig und partikelfrei mit einem pH-Wert von 6,6.
Lagerung/Haltbarkeit
- Der Impfstoff sollte zum Schutz vor Licht in der Originalverpackung aufbewahrt werden.
- Ungeöffnet: 6 Monate bei 2°C bis 8°C.
- Nach dem ersten Gebrauch soll der Impfstoff so bald wie möglich und innerhalb von 6 Stunden verabreicht werden.
- Der Impfstoff kann während des Gebrauchs zwischen 2°C und 25°C gelagert werden.
Herstellung einer Einmaldosis-Spritze
- Der Impfstoff ist applikationsfertig und wird vor der Applikation nicht verdünnt.
- Inhalt durch vorsichtige Schwenkbewegungen homogenisieren. Nicht schütteln.
- Prüfen: farblose bis leicht bräunliche, klare bis leicht trübe Suspension, keine Partikel oder Verfärbung.
- Wischdesinfektion des Stopfens
- Entnahme von 0,5 ml Impfdosis in jeweils eine neue handelsübliche Einmalspritze mit einer neuen Einmalkanüle.
- Die diskonnektierte Spritze mit einer neuen zur i.m. Applikation geeigneten handelsüblichen (Sicherheits-) Kanüle versehen. Das Totraumvolumen der Kanüle ist bei der Volumenabmessung zu berücksichtigen.
- Reste kleiner 0,5 ml sind zu entsorgen. Aus hygienischen Gründen dürfen Reste mehrerer Durchstechflaschen nicht gemischt werden.
- Nach erster Entnahme Anbruchs-Datum und -Uhrzeit auf der Durchstechflasche notieren.
- Der Impfstoff enthält kein Konservierungsmittel. Aus mikrobiologischer Sicht sollte das Produkt deshalb sofort verwendet werden.
- Die angebrochenen Durchstechflaschen sind 48 Stunden bei 2 bis 8°C physikalisch-chemisch stabil. Innerhalb dieses Zeitraums kann der Impfstoff einmalig für max. 6 Stunden bei bis zu 30°C gelagert werden. Nach Ablauf dieser Zeit ist der Impfstoff zu verwerfen und darf nicht wieder bei 2 bis 8°C gelagert werden.
Wirkmechanismus
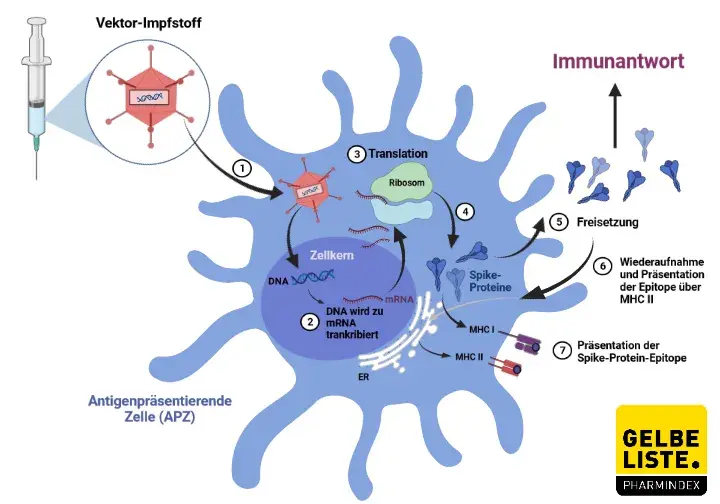
AZD1222 besteht aus einem replikationsdefizienten Schimpansen-Virusvektor, der auf einer geschwächten Version eines Erkältungsvirus (Adenovirus) basiert, das Infektionen bei Schimpansen verursacht und das genetische Material des SARS-CoV-2-Virus-Spike-Proteins enthält. Nach der Impfung wird das Oberflächen-Spike-Protein produziert, das das Immunsystem darauf vorbereitet, das SARS-CoV-2-Virus anzugreifen, wenn es zu einer Infektion kommen sollte.
Dosierung
Das Impfregime besteht aus zwei Dosen mit 5 x 1010 Viruspartikeln entsprechend 0,5 ml der Vakzine im Abstand von mindestens vier bis maximal zwölf Wochen. Die STIKO empfiehlt einen Abstand von 12 Wochen.
Hilfsstoffe
- L-Histidin
- L-Histidinhydrochlorid-Monohydrat
- Magnesiumchlorid-Hexahydrat
- Polysorbat80
- Ethanol
- Sucrose
- Natriumchlorid
- Dinatriumedetat-Dihydrat
- Wasser für Injektionszwecke
Nebenwirkungen
Die am häufigsten berichteten Nebenwirkungen in klinischen Studien waren:
- Empfindlichkeit an der Injektionsstelle (>60%)
- Schmerzen an der Injektionsstelle, Kopfschmerzen, Müdigkeit (>50%)
- Myalgie, Unwohlsein (>40%)
- Pyrexie, Schüttelfrost (>30%)
- Arthralgie, Übelkeit (>20%)
Die meisten Nebenwirkungen waren von leichter bis mittelschwerer Ausprägung und verschwanden normalerweise innerhalb weniger Tage nach der Impfung. Im Vergleich zur ersten Dosis waren die gemeldeten Nebenwirkungen nach der zweiten Dosis milder und weniger häufig.
Bei älteren Probanden (≥65 Jahre) waren Nebenwirkungen im Allgemeinen milder und seltener.
Zahlreiche Staaten hatten im März 2021 das Verimpfen von AZD1222 gestoppt, nachdem Fälle von Sinusvenenthrombosen in zeitlichem Zusammenhang mit der Impfung gemeldet wurden. Auch Bundesgesundheitsminister Jens Spahn folgte am 15. März 2021 den Empfehlungen des Paul-Ehrlich-Instituts (PEI) und setzte Verimpfungen der AstraZeneca Vakzine in Deutschland offiziell aus. Die EMA empfahl daraufhin in einer Stellungnahme, die Impfungen gegen das Coronavirus mit dem Impfstoff von AstraZeneca fortsetzen. Es folgte ein Rote-Hand-Brief.
Idiopathische thrombozytopenische Purpura (ITP)/Thrombozytopenie
Im Zusammenhang mit der Impfung mit Vaxzevria wurden Fälle einer ITP mit und ohne Blutungen berichtet, darunter auch vereinzelte Fälle mit fulminanten Hirnblutungen. Thrombozytopenie ist als Nebenwirkung in der Produktinformation genannt.
Guillain-Barré-Syndrom
Es sind mehr Fälle eines Guillain-Barré-Syndroms (GBS) nach Vaxzevria gemeldet worden, als aufgrund der Anzahl geimpfter Personen zufällig erwartet wurde. Ob es sich um ein neues Risikosignal handeln könnte, wird weiter vom Paul-Ehrlich-Institut untersucht.
Kapillarlecksyndrom (Capillary-Leak-Syndrom, CLS)
- Es wurden sehr seltene Fälle des Kapillarlecksyndroms in den ersten Tagen nach der Impfung mit Vaxzevria berichtet. In einigen Fällen zeigte sich eine Vorgeschichte von CLS in der Anamnese. Es wurde ein Fall mit tödlichem Ausgang berichtet.
- Vaxzevria ist jetzt bei Personen kontraindiziert, die eine positive Anamnese von CLS haben (siehe Rote-Hand-Brief)
- Das CLS ist durch akute Ödembildung gekennzeichnet, die hauptsächlich die Gliedmaßen betrifft. Gleichzeitig treten Hypotonie, Hämokonzentration und Hypoalbuminämie auf. Patienten mit einer akuten CLS-Episode nach der Impfung benötigen eine sofortige Diagnosestellung und Behandlung. Eine intensivmedizinische unterstützende Therapie ist in der Regel angezeigt.
Den vollständigen Sicherheitsbericht des Paul-Ehrlich-Instituts vom 27.12.2020 bis 30.06.2021 finden Sie hier.
Wechselwirkungen
- Es wurden keine Interaktionsstudien durchgeführt.
- Die gleichzeitige Anwendung von AZD1222 mit anderen Impfstoffen wurde nicht untersucht.
- Die STIKO rät, dass zu anderen planbaren Impfungen ein Mindestabstand eingehalten wird: 14 Tage vor Beginn und 14 Tage nach Ende der Impfserie.
Kontraindikation
AZD1222 darf nicht appliziert werden:
- bei Überempfindlichkeit gegen den Wirkstoff oder einen der Hilfsstoffe.
- wenn nach vorheriger Impfung mit diesem Impfstoff ein Thrombose-mit-Thrombozytopenie-Syndrom (TTS) aufgetreten ist.
- bei Personen, die schon einmal ein Kapillarlecksyndrom erlitten haben.
Schwangerschaft/Stillzeit
Schwangerschaft
Es liegen nur begrenzte Erfahrungen mit der Anwendung von AZD1222 bei schwangeren Frauen vor. Vorläufige Tierstudien weisen nicht auf direkte oder indirekte schädliche Auswirkungen in Bezug auf Schwangerschaft, Embryofetalentwicklung, Geburt oder postnatale Entwicklung hin. Tierversuche sind noch nicht abgeschlossen. Die Verabreichung von AZD1222 in der Schwangerschaft sollte deshalb nur in Betracht gezogen werden, wenn der potenzielle Nutzen die potenziellen Risiken für Mutter und Fötus überwiegt.
Zur Anwendung der COVID-19-Impfstoffe in der Schwangerschaft und Stillzeit liegen aktuell keine Daten vor. Die STIKO empfiehlt die generelle Impfung in der Schwangerschaft derzeit nicht. Eine akzidentelle Impfung in der Schwangerschaft ist jedoch keine Indikation für einen Schwangerschaftsabbruch. Schwangeren mit Vorerkrankungen und einem daraus resultierenden hohen Risiko für eine schwere COVID-19-Erkrankung kann in Einzelfällen nach Nutzen-Risiko-Abwägung und nach ausführlicher Aufklärung eine Impfung angeboten werden.
Stillzeit
Es ist nicht bekannt ob Ad26.COV2.S in die Muttermilch übergeht. Die Ständige Impfkommission (STIKO) hält es jedoch für unwahrscheinlich, dass eine Impfung der Mutter während der Stillzeit ein Risiko für den Säugling darstellt (siehe COVID-19 Impfempfehlung). Nach bisherigem Kenntnisstand ist mit der Verabreichung von Nicht-Lebendimpfstoffen während der Stillzeit kein erhöhtes Risiko für die Stillende oder den Säugling verbunden.
Die Deutsche Gesellschaft für Gynäkologie und Geburtshilfe (DGGG) weist in einer Stellungnahme darauf hin, dass auch die Society for Maternal Fetal Medicine (SMFM) keinen Grund zu der Annahme sieht, dass der Impfstoff ein Sicherheitsrisiko in der Stillperiode für Mutter und/oder Säugling darstellt. Ein biologisch nachvollziehbarer Mechanismus, der Schaden verursachen könnte, sei derzeit nicht bekannt. Zum jetzigen Zeitpunkt liegen jedoch keine aussagekräftigen Studien zum Übertritt von Impf-Bestandteilen in die Muttermilch vor.
Die DGGG empfiehlt, dass in der Beratung und Aufklärung die (potenziellen) Vorteile einer Impfung für Mutter und Säugling dargestellt und eine partizipative Entscheidungsfindung ermöglicht werden. Der Entwicklungs- und Gesundheitsnutzen des Stillens sollte dabei zusammen mit dem klinischen Bedarf der Frau an einer Immunisierung gegen COVID-19 (in Abhängigkeit von Risikofaktoren für eine SARS-CoV-2-Infektion/schwere COVID-19) berücksichtigt werden, und über das Fehlen von Sicherheitsdaten für den Impfstoff bei stillenden Frauen soll informiert werden. Bei erhöhtem Sicherheitsbedürfnis der Stillenden kann eine individuelle Festlegung eines stillfreien Zeitraums von ein bis drei Tagen nach der Impfung in Erwägung gezogen werden. Internationale Empfehlungen sehen hier jedoch keine Notwendigkeit für die Verzögerung eines Stillbeginns, einer Stillunterbrechung oder des Abstillens nach Impfung.
Verkehrstüchtigkeit
AZD1222 hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Bestimmte Nebenwirkungen können jedoch vorübergehend die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen.
Studienlage
COV001
COV001 ist eine verblindete, multizentrische, randomisierte, kontrollierte Studie der Phase I/II zur Beurteilung der Sicherheit, Immunogenität und Wirksamkeit von AZD1222 bei 1.077 gesunden Erwachsenen in fünf Prüfzentren in Grossbritannien. Die Teilnehmer im Alter zwischen 18 und 55 Jahren erhalten nach dem Zufallsprinzip entweder eine oder zwei intramuskuläre Dosen AZD1222 mit 5x1010 Viruspartikeln oder ein Vergleichspräparat, den Meningokokken-Impfstoff MenACWY. Den Studienteilnehmern wird mehrmals bis zu einem Jahr nach der Impfung Blut abgenommen und klinische Beurteilungen zur Sicherheit sowie zur Immunogenität durchgeführt. Jede Woche wird ein PCR-Test auf COVID-19 durchgeführt. Dieser wird 3 bis 5 Tage nach Auftreten der Symptome wiederholt, wenn die erste Probe negativ ist, und 7 Tage nach einem positiven PCR-Test.
COV002
COV002 ist eine einfach verblindete, multizentrische, randomisierte, kontrollierte Phase II/III-Studie zur Beurteilung der Sicherheit, Wirksamkeit und Immunogenität von AZD1222 bei 12.390 Studienteilnehmern in Grossbritannien. Die bisherigen Studienteilnehmer sind 18 Jahre oder älter, gesund oder haben medizinisch stabile chronische Erkrankungen und ein erhöhtes Risiko für eine Exposition gegenüber dem Coronavirus SARS-CoV-2. Die Teilnehmer erhalten eine oder zwei intramuskuläre Dosen einer halben Dosis (~2,5x1010 Viruspartikel) oder einer vollen Dosis (~5x1010 Viruspartikel) AZD1222 oder des Vergleichsimpfstoffs MenACWY gegen Meningokokken. Den Studienteilnehmern wird mehrmals bis zu einem Jahr nach der Impfung Blut abgenommen und klinische Beurteilungen zur Sicherheit sowie zur Immunogenität durchgeführt. Verdachtsfälle mit kompatiblen Symptomen werden zur virologischen Bestätigung von COVID-19 mittels PCR getestet. Darüber hinaus werden wöchentliche Abstriche zum Nachweis von Infektionen und zur Beurteilung der Wirksamkeit des Impfstoffs gegen Infektionen durchgeführt.
COV003
COV003 ist eine einfach verblindete, multizentrische, randomisierte, kontrollierte Phase-III-Studie zur Beurteilung der Sicherheit, Wirksamkeit und Immunogenität von AZD1222 bei 10.300 Teilnehmern in Brasilien. Die bisherigen Studienteilnehmer sind 18 Jahre oder älter, gesund oder haben medizinisch stabile chronische Erkrankungen und ein erhöhtes Risiko für eine Exposition gegenüber dem Coronavirus SARS-CoV-2. Die Teilnehmer erhalten nach dem Zufallsprinzip entweder zwei intramuskuläre Dosen einer vollen Dosis (~5x1010 Viruspartikel) AZD1222 oder eines Vergleichsimpfstoffs, des Meningokokken-Impfstoffs MenACWY, als erste Dosis und ein Kochsalz-Placebo als zweite Dosis. Den Studienteilnehmern wird mehrmals bis zu einem Jahr nach der Impfung Blut abgenommen und klinische Beurteilungen zur Sicherheit sowie zur Immunogenität durchgeführt. Verdachtsfälle mit kompatiblen Symptomen werden zur virologischen Bestätigung von COVID-19 mittels PCR getestet.
COV005
COV005 ist eine verblindete, multizentrische, randomisierte, kontrollierte Phase I/II-Studie zur Beurteilung der Sicherheit, Wirksamkeit und Immunogenität von AZD1222 bei 2.070 Studienteilnehmern in Südafrika. Die Studienteilnehmer im Alter zwischen 18 und 65 Jahren, mit oder ohne HIV, erhalten nach dem Zufallsprinzip entweder zwei intramuskuläre Dosen AZD1222 mit 5–7,5x1010 Viruspartikeln oder ein Kochsalz-Placebo. Den Studienteilnehmern wird mehrmals bis zu einem Jahr nach der Impfung Blut abgenommen und klinische Beurteilungen zur Sicherheit sowie zur Immunogenität durchgeführt. Regelmässige PCR-Tests auf COVID-19 werden bis zu einem Jahr nach der Impfung vorgenommen.
Zulassungsrelevante Ergebnisse
Eine Zwischenanalyse klinischer Studien mit AZD1222 umfasste Daten aus der Phase-II/III-Studie COV002 (NCT04400838) in Großbritannien und der Phase-III-Studie COV003 8 (NCT04536051) in Brasilien. Insgesamt wurde die Wirksamkeit sowie Sicherheit an 23.000 Teilnehmer nach
- zwei Dosen einer halben Dosis (2,5x1010 Viruspartikel) und später einer vollen Dosis (5x1010 Viruspartikel) oder
- zwei volle Dosen AZD1222
gegenüber eines Vergleichs-Meningokokken-Konjugat-Impfstoffs namens MenACWY oder Kochsalzlösung evaluiert.
Wirksamkeit
- In der Zwischenanalyse wurden insgesamt 131 COVID-19-Fälle bestätigt. Wurde AZD1222 mit halbierter Dosis (n=2.741) gefolgt von einer vollen Dosis im Abstand von mindestens einem Monat verabreicht, zeigte sich eine Impfwirksamkeit von 90%.
- Wurden zwei volle Dosen im Abstand von mindestens einem Monat appliziert (n=8.895) zeigte sich eine Wirksamkeit von 62%.
- Die kombinierte Analyse beider Dosierungsschemata (n=11.636) ergab eine durchschnittliche Wirksamkeit von 70%.
- Alle Ergebnisse waren statistisch signifikant (p<=0,0001).
- Nach Daten aus The Lancet wirkt der Impfstoff bei verschiedenen Altersgruppen einschließlich älterer Patienten.
Panne bei den Dosierungen und was daraus gemacht wurde
Alle vier klinischen Studien (COV001, COV002, COV003 und COV005) wurden ursprünglich als Einzeldosis-Schema geplant; im Juli 2020 wurde dies allerdings in ein Zwei-Dosis-Schema geändert. Der Boost sollte zum frühestmöglichen Zeitpunkt (28 Tage nach der Erstdosis) verabreicht werden. Die Auswertung zeigte, dass Probanden, die eine niedrigere Prime-Dosis (halbe Dosis) und eine Standard-Boost-Dosis (LDSD) bekommen hatten, nach der Boosterung höhere Antikörpertiter und einen besseren Schutz aufwiesen als diejenigen, die zwei Standarddosen (SDSD) erhielten.
Trotzdem wurde der Impfstoff für die Verwendung der höheren Dosierungen zugelassen. Das ergibt im ersten Moment nicht wirklich Sinn.
Im Zulassungsdokument findet man die Erklärung
In der SDSD-Gruppe wurde ein Trend beobachtet, dass längere Dosisintervalle mit höheren Reaktionen verbunden waren. Beim Vergleich von SDSD- und LDSD-Gruppen mit demselben Dosisintervall sei die Immunantwort nach der zweiten Dosis ähnlich. Es heißt weiter „Angesichts der Tatsache, dass das mittlere Dosisintervall in der LDSD-Gruppe 12 Wochen betrug, verglichen mit 5 Wochen in der SDSD-Gruppe in Brasilien und 10 Wochen in der SDSD-Gruppe in Großbritannien, deuten diese Daten darauf hin, dass die in der LDSD-Gruppe hervorgerufenen höheren Immunogenitätsniveaus stärker vom Intervall als von der Dosisstufe beeinflusst werden.“
Wirksamkeit
In den bisher ausgewerteten Zulassungsstudien konnte über alle Altersgruppen Folgendes gezeigt werden:
- Der Impfschutz setzte bereits drei Wochen nach der 1. Dosis mit Vaxzevria ein. Ab der 3. Woche nach Impfung mit der 1. Dosis Vaxzevria wurde kein Studienteilnehmer mehr wegen einer moderaten oder schweren COVID-19-Erkrankung hospitalisiert (WHO-Schweregrad ≥ 4) – im Vergleich zu 14 Fällen in der Kontrollgruppe. Ein längeres Dosierungsintervall zwischen 1. und 2. Dosis erhöhte die Wirksamkeit der Impfung mit Vaxzevria. Optimal sind 12 Wochen, da ab der 12. Woche eine Wirksamkeit von 81,3% beobachtet wurde.
- Vaxzevria zeigte über alle Ethnien und Altersgruppen hinweg eine konsistente Wirksamkeit. Bei Patienten ≥ 65 Jahre lag die Wirksamkeit bei 85%.
Aus der Impfpraxis (Real-World-Daten) konnte bei älteren Personen Folgendes gezeigt werden:
- 35 Tage nach der 1. Dosis ergab sich bei Patienten ≥ 70 Jahre eine Wirksamkeit von 73%.
- Nach der 1. Dosis konnte das Hospitalisierungsrisiko um 94% gesenkt werden, wobei die Wirkung über alle Altersgruppen (einschließlich Personen ≥ 80 Jahre) vergleichbar war. 28 bis 34 Tage nach der 1. Dosis war die Wirksamkeit des Impfstoffs am höchsten.
Britische Variante B.1.1.7:
- Die Wirksamkeit wurde in der bisher ausgewerteten Studie bestätigt und betrug im Mittel 74,6%. (Emary K et al. Efficacy of ChAdOx1nCoV-19 (AZD1222) Vaccine Against SARS-CoV-2 VOC 202012/01 (B.1.1.7). The Lancet 2021)
- Schwere Verläufe und Hospitalisierungen wurden vollständig verhindert.
Südafrikanische Variante B.1.351:
- Die Wirksamkeit gegen leichte und moderate Erkrankungsverläufe konnte bisher nicht belegt werden.
- In der zugrunde liegenden klinischen Studie (Madhi SA et al. Safety and efficacy of the ChAdOx1 nCoV-19 (AZD1222) Covid-19 vaccine against the B.1.351 variant in South Africa. Lancet 2020) wurden insgesamt keine schweren Krankheitsverläufe beobachtet.
Anwendungshinweise
Thrombose mit Thrombozytopenie-Syndrom, TTS
Im Zusammenhang mit Adenovirus-basierten Vektorimpfstoffen gegen COVID-19, (Vaxzevria® [COVID-19 Vaccine AstraZeneca], COVID-19 Vaccine Janssen) wurde sehr selten über eine ungewöhnliche Kombination von Thrombosen und Thrombozytopenie (Thrombose mit Thrombozytopenie-Syndrom, TTS) berichtet. Die Thrombosen können an ungewöhnlichen Stellen auftreten, zum Beispiel als zerebrale Sinusvenenthrombosen, Portal-, Leber- oder Mesenterialvenenthrombosen, tiefe Beinvenenthrombosen, Lungenembolien sowie arterielle Thrombosen. Auch Blutungen sind möglich. TTS wird durch eine Antikörperbildung gegen Plättchenfaktor 4 ausgelöst, was ähnlich wie bei der heparininduzierten Thrombozytopenie (HIT) zu einer massiven Thrombozytenaktivierung führt, jedoch ohne vorherige Heparin-Exposition.
Geimpfte sollten umgehend einen Arzt aufsuchen wenn in einem zeitlichen Abstand von mehr als drei Tagen bis etwa drei Wochen nach der Impfung Symptome auftreten wie:
- Kurzatmigkeit
- Brustschmerzen
- Beinschwellungen oder -schmerzen
- anhaltende Bauchschmerzen
- Übelkeit oder Erbrechen
- Blutergüsse außerhalb des Verabreichungsortes
- neurologische Symptome wie starke oder anhaltende Kopfschmerzen, verschwommenes Sehen oder Krampfanfälle, sollten
Weitere Maßnahmen, wie bspw. Vorstellung in einer Notaufnahme, sollten dann rasch eingeleitet werden, da eine frühzeitige Diagnose und Behandlung sowie ggf. die Hinzuziehung von Spezialisten (z. B. Hämatologen, Gerinnungsspezialisten) angesichts des lebensbedrohlichen Krankheitsbilds wichtig sind.
Folgende Empfehlungen sollten im Falle von TTS nach einer Impfung berücksichtigt werden:
- In solchen Fällen sollte das Blutbild (mit Thrombozytenzahl), ein Blutausstrich, die D-Dimere sowie der Fibrinogenwert untersucht und ggf. eine weiterführende bildgebende Diagnostik durchgeführt werden.
- Patienten mit Thrombozytopenie sollten aktiv auf Anzeichen einer Thrombose untersucht werden, Patienten mit Thrombose sollten auf eine Thrombozytopenie untersucht werden. Ggf. sind wiederholte Untersuchungen auf TTS erforderlich.
- Bei Vorliegen einer Thrombose mit Thrombozytopenie und erhöhtem D-Dimer-Wert sollte unabhängig von einer Heparin-Exposition ein HIT-Screening-Test und ggf. weitere Untersuchungen pathophysiologisch relevanter Antikörper erfolgen. Dabei ist zu beachten, dass nicht alle HIT-Screening-Tests für die Diagnostik eines TTS geeignet sind.
- Bis zum Ausschluss einer HIT sollte auf Heparine zur Antikoagulation verzichtet und stattdessen z. B. Danaparoid, Argatroban oder direkte orale Antikoagulanzien angewendet werden.
- Bei bestätigter autoimmuner Genese kann wahrscheinlich der Pathomechanismus durch die Gabe von hochdosierten intravenösen Immunglobulinen unterbrochen werden. Einzelbeobachtungen weisen darauf hin, dass die frühzeitige Gabe von intravenösen Immunglobulinen die Prognose der Patienten verbessert.
- Stets müssen auch andere Ursachen für Thrombozytopenien/Thrombosen in Betracht gezogen werden.
Bei Patienten mit Thrombose oder Thrombophilie in der Anamnese scheint das Risiko für diese spezifische Komplikation nicht erhöht zu sein. Weitere Details, einschließlich eines Flussdiagramms, zum Vorgehen bei Verdacht auf HIT/TTS können der Stellungnahme der GTH (Gesellschaft für Thrombose- und Hämostaseforschung) entnommen werden.
Anaphylaktische Reaktionen
Für akute anaphylaktische Reaktionen muss eine medizinische Notfallausrüstung zur Verfügung stehen. Eine Nachbeobachtung sollte für mindestens 15 Minuten gewährleistet sein. Wenn nach der ersten Dosis anaphylaktische Reaktionen auftreten soll die zweite Impfung nicht erfolgen.
Akute Infektionen
Bei akuten Infektionen sollte die Impfung verschoben werden. Milde Krankheitssymptome sind kein Grund, die Impfung zu verschieben.
Gerinnungsstörungen
Bei antikoagulierten Personen oder Personen mit Gerinnungsstörungen, bei denen eine intramuskuläre Injektion kontraindiziert ist, sollte die Impfung nur erfolgen, wenn der Nutzen die Risiken übersteigt. Nach sorgfältiger Nutzen Risiko-Abwägung kann eine intramuskuläre Injektion mit einer dünnen Nadel (23 G oder 25 G) und anschließender Kompression mit einem Tupfer auf die Injektionsstelle erfolgen.
Immunsupprimierte Personen
Immunsupprimierte Personen, einschließlich Personen, die eine immunsuppressive Therapie erhalten, können eine verminderte Immunantwort auf die Impfung zeigen. Es liegen keine Daten zur gleichzeigen Gabe von Immunsuppressiva oder zu Personen, die schon eine Impfung mit einem anderen COVID19 Impfstoff erhalten haben, vor.
Alternativen
Neben AZD1222 gibt es noch zwei weitere replikationsinkompetente Vektor-Impfstoffe gegen das Coronavirus: Ad26.COV2.S von von Janssen und GRAd-COV2 von ReiThera (Rom), Leukocare (München) und Univercells (Brüssel).
In Deutschland sind zwei mRNA-Impfstoffe namens BNT162b2 von BioNTech/Pfizer und mRNA-1273 von Moderna sowie die Vektorvakzine Ad26.COV2.S von von Janssen in Deutschland zur Prävention von COVID-19 zugelassen.
Eine umfangreiche Vergleichsseite der zugelassenen Impfstoffe finden Sie hier.
- The Lancet: Safety and immunogenicity of ChAdOx1 nCoV-19 vaccine administered in a prime-boost regimen in young and old adults (COV002): a single-blind, randomised, controlled, phase 2/3 trial
- AstraZeneca: AZD1222 vaccine met primary efficacy endpoint in preventing COVID-19
- Information for UK healthcare professionals: COVID-19 Vaccine AstraZeneca
- AstraZeneca: Zwischenergebnisse der Oxford-Phase-III-Studie zu AZD1222 in The Lancet veröffentlicht
- EMA: COVID-19 Vaccine AstraZeneca
- KVWL: Vaxzevria











