SARS-CoV-2-Spike-Glycoprotein (Ad26.COV2-S)
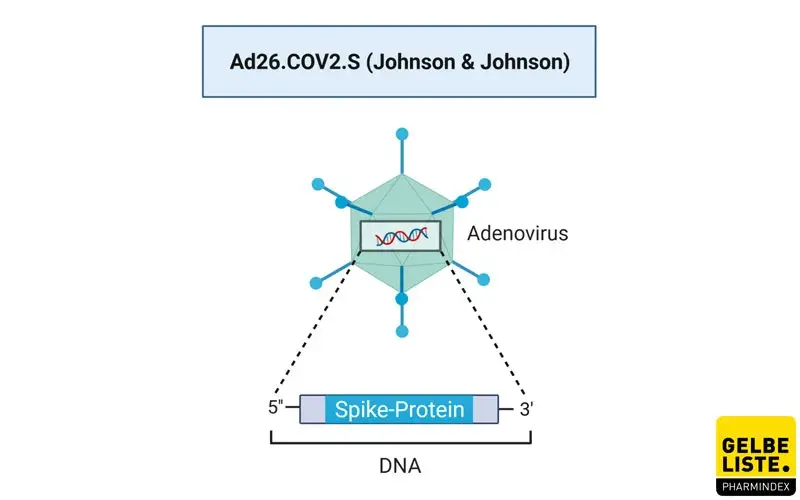
Bei Ad26.COV2.S (Jcovden) handelt es sich um einen vektorbasierten Corona-Impfstoff des US-Pharmakonzerns Johnson & Johnson, dem Mutterkonzern des forschenden belgischen Pharmaunternehmens Janssen. Die Vakzine besteht aus einem Adenovirus (Ad26), der die genetische Information für das SARS-CoV-2-Spikeprotein in Form von DNA enthält.
SARS-CoV-2-Vektorimpfstoff (Ad26.COV2.S): Übersicht
Anwendung
Ad26.COV2.S (Jcovden, COVID-19 Vaccine Janssen) ist zur aktiven Immunisierung von Personen ab 18 Jahren zur Vorbeugung von COVID-19 indiziert. Basierend auf der momentanen Datenlage empfiehlt die STIKO im Regelfall die Impfung mit den beiden Vektorbasierten Impfstoffen Vaxzevria und der COVID-19 Vaccine Janssen nur für Menschen im Alter ≥ 60 Jahre, da in dieser Altersgruppe aufgrund der ansteigenden Letalität einer COVID-19- Erkrankung die Risiko-Nutzen-Abwägung eindeutig zu Gunsten der Impfung ausfällt. Nach Anwendung der COVID-19 Vaccine Janssen sind in den USA sehr seltene Fälle von TTS überwiegend bei jüngeren Geimpften aufgetreten. Aus Europa gibt es hierzu noch keine Beobachtungen, weil der Impfstoff hier erst seit Kurzem und bisher nur in kleinen Mengen zur Anwendung gekommen ist.
Änderung Grundimmunisierung
Zwar wurde die COVID-19 Vaccine Janssen als einmalige Impfung zugelassen, diese ist jedoch seit Mitte Januar 2022 nach Angaben der entsprechenden Website des PEI für eine vollständige Grundimmunisierung nicht mehr ausreichend: Für einen vollständigen Immunschutz muss eine zweite Impfung entweder in Form eines homologen oder heterologen Impfschemas erfolgen.
Daraus ergeben sich folgende Möglichkeiten für die Grundimmunisierung:
- Sowohl die erste als auch die zweite Impfung erfolgen mit der COVID-19-Vaccine Janssen (Johnson & Johnson)
- Die erste Impfung erfolgt mit der COVID-19-Vaccine Janssen, die zweite Impfung mit Comirnaty von BioNTech/Pfizer
- Die erste Impfung erfolgt mit der COVID-19-Vaccine Janssen, die zweite Impfung mit Spikevax von Moderna
Der vollständige Impfschutz gilt ab dem 15. Tag nach der letzten Einzelimpfung.
Ausnahmeregelung für Genesene
- Für Personen, die vor der ersten oder zweiten Impfung der Grundimmunisierung an COVID-19 erkrankt sind, gelten die folgenden Ausnahmeregelungen.
- Bei Infektion mit dem Coronavirus SARS-CoV-2 vor der ersten Impfung gilt bei vorhandenem Nachweis der vollständige Immunschutz sofort ab dem Tag der einmaligen Impfung
- Bei Infektionen nach der Erst- und vor der Zweitimpfung gelten betroffene Personen ab dem 29. Tag nach Abnahme des positiven Testnachweises als vollständig geimpft
Anwendungsart
Ad26.COV2.S wird intramuskulär als Einzeldosis (0,5 ml) verabreicht.
Alle Updates zu Lagerung, Transport, Herstellung, Haltbarkeit etc. im Vergleich zu den anderen zugelassenen Corona-Impfstoffen finden Sie hier.
Aussehen
Farblose bis leicht gelbe, klare bis sehr opaleszierende Suspension mit einem von pH 6 - 6,4.
Lagerung/Haltbarkeit
Der Impfstoff wird zunächst vom Hersteller gefroren gelagert und dann bei 2°C bis 8°C versandt. Er soll lichtgeschützt bei 2°C bis 8°C gelagert werden. Nicht durchstochene Durchstechflaschen können bis zu 12 Stunden zwischen 9°C und 25°C aufbewahrt werden. Nach der ersten Punktion des Impfstofffläschchens kann der Impfstoff bis zu 2 Stunden bei Raumtemperatur (maximal 25°C) und bis zu 6 Stunden zwischen 2°C und 8°C gelagert werden.
Bei Raumtemperatur (maximal 25°C) dauert das Auftauen eines Kartons mit 10 Fläschchen ungefähr 2 Stunden; Das Auftauen eines einzelnen Fläschchens dauert ungefähr eine Stunde.
CAVE: Nach dem Auftauen dürfen die Fläschchen nicht wieder eingefroren werden.
Herstellung einer Einmaldosis-Spritze
- Der Impfstoff ist eine leicht gelbe, klare Suspension. Überprüfen Sie vor der Verabreichung visuell ob Partikel und/oder Verfärbungen zu sehen sind. Wenn ja, soll der Impfstoff NICHT verabreicht werden.
- Vor Applikation jeder Impfstoffdosis den Inhalt der Mehrfachdosis-Durchstechflasche sorgfältig mischen, indem Sie diese 10 Sekunden lang vorsichtig in aufrechter Position schwenken. Nicht schütteln.
- Jede Durchstechflasche enthält fünf Dosen mit je 0,5 ml.
- Sammeln Sie keinen überschüssigen Impfstoff aus mehreren Durchstechflaschen.
- Notieren Sie Datum und Uhrzeit der ersten Verwendung auf dem Etikett der Impfstoffflasche.
- Bewahren Sie die Durchstechflasche nach Applikation der ersten Dosis bis zu 6 Stunden zwischen 2°C und 8°C oder bis zu 2 Stunden bei Raumtemperatur (maximal 25°C) auf.
- Wenn der Impfstoff innerhalb dieser Zeit nicht verwendet wird, muss er entsorgt werden.
Wirkmechanismus
Der Impfstoff besteht aus einem replikationsinkompetenten rekombinanten Adenovirus Typ 26 (Ad26)-Vektor, der DNA enthält, welche das SARS-CoV-2-Spike (S)-Protein in einer stabilisierten Konformation exprimiert. Adenoviren können nicht in das Genom der Zelle integrieren und werden während der Zellteilung auch nicht repliziert. Die DNA des Vektors gelangt in den Zellkern, wo sie zunächst in mRNA umgeschrieben (transkribiert) wird, die die genetische Information für den Aufbau des Proteins trägt, welches dann in den Ribosomen produziert wird. Neben Ad26.COV2.S wird auch bei Sputnik V (Gam-COVID-Vac) auf eine Adenoviren basierende Vektorimpfung zurückgegriffen.
Dosierung
Ad26.COV2.S wird intramuskulär als Einzeldosis mit 0,5 ml (5 × 1010 Viruspartikel) verabreicht.
Hilfsstoffe
Hilfsstoffe pro 0,5 ml Impfstoff:
- Zitronensäuremonohydrat (0,14 mg)
- Trinatriumcitratdihydrat (2,02 mg)
- Ethanol (2,04 mg)
- 2-Hydroxypropyl -β-Cyclodextrin (HBCD) (25,50 mg)
- Polysorbat-80 (0,16 mg)
- Natriumchlorid (2,19 mg)
Jede Dosis kann auch Restmengen an Wirtszellproteinen (≤ 0,15 µg) und / oder Wirtszell-DNA (≤ 3 ng) enthalten.
Nebenwirkungen
Die häufigsten Nebenwirkungen von Ad26.COV2.S waren Schmerzen an der Injektionsstelle (48,6%), Kopfschmerzen (38,9%), Müdigkeit (38,2%) und Myalgie (33,2%). Diese waren überwiegend leicht und mittelschwer, wobei 0,7% bzw. 1,8% der lokal und systemisch angeforderten Nebenwirkungen als Grad 3 gemeldet wurden. Berichte über Nebenwirkungen waren bei Teilnehmern ab 60 Jahren weniger häufig.
Thrombose mit Thrombozytopenie-Syndrom (TTS)
Im Zusammenhang mit Adenovirus-basierten Vektorimpfstoffen gegen COVID-19, (Vaxzevria von AstraZeneca], COVID-19 Vaccine Janssen) wurde sehr selten über eine ungewöhnliche Kombination von Thrombosen und Thrombozytopenie (Thrombose mit Thrombozytopenie-Syndrom, TTS) berichtet. Die Thrombosen können an ungewöhnlichen Stellen auftreten, zum Beispiel als zerebrale Sinusvenenthrombosen, Portal-, Leber- oder Mesenterialvenenthrombosen, tiefe Beinvenenthrombosen, Lungenembolien sowie arterielle Thrombosen. Auch Blutungen sind möglich. Am 26. April wurde ein Rote-Hand-Brief versendet.
Auf folgende Symptome achten:
Medizinisches Fachpersonal soll auf die Anzeichen und Symptome einer Thromboembolie und/oder Thrombozytopenie achten. Die geimpften Personen sollen angewiesen werden, sofort einen Arzt aufzusuchen, wenn sie nach der Impfung folgende Symptome entwickeln.
- Kurzatmigkeit
- Brustkorbschmerzen
- Beinschmerzen, Beinschwellungen
- Anhaltende Bauchschmerzen
- Starke oder anhaltende Kopfschmerzen
- Krampfanfälle
- Veränderungen des geistigen Zustands
- Verschwommenes Sehen
- Hautblutungen (Petechien) nach einigen Tagen außerhalb des Verabreichungsortes der Impfung
Die Kombination von Thrombosen mit Thrombozytopenie erfordert eine spezifische klinische Behandlung. Medizinisches Fachpersonal sollte die geltenden Leitlinien und/oder Spezialisten (z. B. Hämatologen, Gerinnungsspezialisten) zur Diagnose und Behandlung dieser Erkrankung zu Rate ziehen. Personen, bei denen innerhalb von drei Wochen nach der Impfung mit COVID-19 Vaccine Janssen eine Thrombozytopenie diagnostiziert wird, sollen aktiv auf Anzeichen einer Thrombose untersucht werden. Ebenso sollen Personen, bei denen innerhalb von drei Wochen nach der Impfung eine Thrombose auftritt, auf Thrombozytopenie untersucht werden.
Kapillarlecksyndrom (Capillary Leak Syndrome, CLS)
In den ersten Tagen nach der Impfung mit der COVID-19 Vaccine Janssen wurden sehr selten Fälle des Kapillarlecksyndroms berichtet, in einigen Fällen mit tödlichem Ausgang. In mindestens einem Fall wurde in der Anamnese ein Kapillarlecksyndrom berichtet. Das Kapillarlecksyndrom ist charakterisiert durch akute Episoden von Ödemen, hauptsächlich die Extremitäten betreffend, Hypotonie, Hämokonzentration und Hypoalbuminämie.
Guillain-Barré-Syndrom und transverse Myelitis
Das Auftreten des Guillain-Barré-Syndroms (GBS) und der transversen Myelitis (TM) wurde sehr selten nach einer Impfung mit COVID-19 Vaccine Janssen berichtet. Medizinisches Fachpersonal soll auf Anzeichen und Symptome von GBS und TM achten, um die richtige Diagnose sicherzustellen, angemessene unterstützende Maßnahmen und die Behandlung einzuleiten und um andere Ursachen auszuschließen.
Sicherheitsprofil
Erfahrungen mit der Ad26-Plattform wurden bereits durch den Ebola-Impfstoff Ad26.ZEBOV / MVA-BN-Filo (genehmigt von der Europäischen Arzneimittel-Agentur am 1. Juli 2020) und Prüfpräparaten gegen Zika, Filovirus, HIV, HPV, Malaria und respiratorisches Syncytialvirus gesammelt.
Vollständiger Sicherheitsbericht des Paul-Ehrlich-Instituts vom 27.12.2020 bis 30.11.2021
Kontraindikation
Der Janssen COVID-19-Impfstoff darf nicht angewendet werden bei Personen mit einer bekannten Vorgeschichte schwerer allergischer Reaktionen (z. B. Anaphylaxie) auf eine Komponente des Impfstoffs. Darüber hinaus darf die Vakzine nicht an Personen appliziert werden die in der Vergangenheit ein Kapillarlecksyndrom entwickelt hatten.
Schwangerschaft
Es gibt ein Schwangerschafts-Expositionsregister, das die Schwangerschaften bei Frauen überwacht, die während der Schwangerschaft Ad26.COV2.S erhalten haben. Bisher reichen die verfügbaren Daten des Janssen COVID-19-Impfstoffs nicht aus, um Informationen über Impfstoff-assoziierte Risiken in der Schwangerschaft zu haben. In einer Studie zur Reproduktionstoxizität wurden weiblichen Kaninchen 7 Tage vor der Paarung und an den Trächtigkeitstagen 6 und 20 1 ml des Janssen COVID-19-Impfstoffs (eine Einzeldosis beim Menschen beträgt 0,5 ml) durch intramuskuläre Injektion verabreicht (Impfung während der frühen bzw. späten Schwangerschaft). Es wurden keine impfstoffbedingten nachteiligen Auswirkungen auf die weibliche Fertilität, die embryo-fetale oder postnatale Entwicklung bis zum postnatalen Tag 28 beobachtet.
Stillzeit
Es ist nicht bekannt ob Ad26.COV2.S in die Muttermilch übergeht. Die Ständige Impfkommission (STIKO) hält es jedoch für unwahrscheinlich, dass eine Impfung der Mutter während der Stillzeit ein Risiko für den Säugling darstellt (siehe COVID-19 Impfempfehlung). Nach bisherigem Kenntnisstand ist mit der Verabreichung von Nicht-Lebendimpfstoffen während der Stillzeit kein erhöhtes Risiko für die Stillende oder den Säugling verbunden.
Die Deutsche Gesellschaft für Gynäkologie und Geburtshilfe (DGGG) weist in einer Stellungnahme darauf hin, dass auch die Society for Maternal Fetal Medicine (SMFM) keinen Grund zu der Annahme sieht, dass der Impfstoff ein Sicherheitsrisiko in der Stillperiode für Mutter und/oder Säugling darstellt. Ein biologisch nachvollziehbarer Mechanismus, der Schaden verursachen könnte, sei derzeit nicht bekannt. Zum jetzigen Zeitpunkt liegen jedoch keine aussagekräftigen Studien zum Übertritt von Impf-Bestandteilen in die Muttermilch vor.
Die DGGG empfiehlt, dass in der Beratung und Aufklärung die (potenziellen) Vorteile einer Impfung für Mutter und Säugling dargestellt und eine partizipative Entscheidungsfindung ermöglicht werden. Der Entwicklungs- und Gesundheitsnutzen des Stillens sollte dabei zusammen mit dem klinischen Bedarf der Frau an einer Immunisierung gegen COVID-19 (in Abhängigkeit von Risikofaktoren für eine SARS-CoV-2-Infektion/schwere COVID-19) berücksichtigt werden, und über das Fehlen von Sicherheitsdaten für den Impfstoff bei stillenden Frauen soll informiert werden. Bei erhöhtem Sicherheitsbedürfnis der Stillenden kann eine individuelle Festlegung eines stillfreien Zeitraums von ein bis drei Tagen nach der Impfung in Erwägung gezogen werden. Internationale Empfehlungen sehen hier jedoch keine Notwendigkeit für die Verzögerung eines Stillbeginns, einer Stillunterbrechung oder des Abstillens nach Impfung.
Verkehrstüchtigkeit
Ad26.COV2.S hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Bestimmte Nebenwirkungen können jedoch vorübergehend die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen.
Studienlage
- Am 15 Juli 2020 startete eine klinische Phase-I/II-Studie COV1001 (NCT04436276) mit 1085 Probanden, in der die Sicherheit, Reaktogenität und Immunogenität von Ad26.COV2.S bei 2 Dosisstufen bewertet wurde. Erste Ergebnisse wurden am 13. Januar 2021 in The New England Journal of Medicine veröffentlicht.
- Eine weitere Phase-I-Studie (NCT04509947) startete am 12. August 2020 mit 250 Teilnehmern in Japan.
- Eine klinische Phase-II- Studie (NCT04535453) zur Bewertung einer Reihe von Dosisstufen und Impfintervallen von Ad26.COV2.S bei gesunden Erwachsenen und Jugendlichen startete am 28. August 2020.
- Seit dem 7. September 2020 läuft die multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie ENSEMBLE (NCT04505722) mit 43.783 Personen. Untersucht werden die Wirksamkeit und Sicherheit des Impfstoffkandidaten im Hinblick auf den Schutz vor einer mittelschweren bis schweren COVID-19-Infektion 14 und 28 Tage nach der Impfung.
- Eine weitere klinische Phase-III-Studie namens ENSEMBLE 2 (NCT04614948) startete am 16. November 2020 startetet. An der Studie werden bis zu 30.000 Teilnehmer teilnehmen, um die Wirksamkeit von Ad26.COV2.S bei der Prävention von COVID-19 im Vergleich zu Placebo bei erwachsenen Teilnehmern zu bewerten.
- Seit 26. Februar 2021 läuft eine klinische Phase-II-Studie (NCT04765384) an 400 gesunden Schwangeren zur Bewertung der Sicherheit und Reaktogenität von Ad26.COV2 bei Applikation während des zweiten und / oder dritten Schwangerschaftstrimesters und (möglicherweise) nach der Geburt.
Aktuell läuft in den USA, Südafrika, Brasilien, Chile, Argentinien, Kolumbien, Peru und Mexiko die multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie (ENSEMBLE, NCT04505722) mit 44.325 Personen. Untersucht werden die Wirksamkeit und Sicherheit des Impfstoffkandidaten im Hinblick auf den Schutz vor einer mittelschweren bis schweren COVID-19-Infektion 14 und 28 Tage nach der Impfung. Die Randomisierung erfolgte nach Alter (18-59 Jahre, 60 Jahre und älter) und Vorhandensein oder Nichtvorhandensein von Komorbiditäten. Die Studie ermöglichte die Einbeziehung von Personen mit stabilen vorbestehenden Erkrankungen, definiert als Krankheit, die keine signifikante Änderung der Therapie drei Monate vor der Impfung erforderte, sowie von Personen mit einer stabilen Infektion mit dem humanen Immundefizienzvirus (HIV).
Ergebnisse
Die Population der primären Wirksamkeitsanalyse von 39.321 Personen (19.630 in der Janssen COVID-19-Impfstoffgruppe und 19.691 in der Placebogruppe) umfasste 38.059 SARS-CoV-2 seronegative Personen zu Studienbeginn und 1.262 Personen mit unbekanntem Serostatus. Die demografischen und grundlegenden Merkmale waren bei Personen, die den Janssen COVID-19-Impfstoff erhielten, und bei Personen, die Placebo erhielten, vergleichbar. Unabhängige Gutachter hatten keine Sicherheitssignale detektiert.
Insgesamt zeigte der Impfstoff in der Studie nach 28 Tagen einen zu 66% wirksamen Schutz vor einer moderaten bis schweren COVID-19-Infektion. Ein Einsetzen der Schutzwirkung wurde bereits nach 14 Tagen beobachtet. 28 Tage nach der Impfung betrug der Schutz in den USA 72%, in Lateinamerika 66% und in Südafrika 57%. Die Schutzwirkung zeigte sich konsistent bei allen ethnischen Gruppen und Altersgruppen (inkl. Erwachsene über 60 Jahre (n=13.610)) sowie im Hinblick auf die Wirksamkeit gegen neu auftretende Stämme des Coronavirus, darunter einige hochinfektiöse Varianten, die in den USA, Lateinamerika und Südafrika vorkommen.
Die Wirksamkeit im Hinblick auf Schutz vor schweren COVID-19 betrug bei allen Erwachsenen ab 18 Jahren nach 28 Tagen 85% und nahm im Laufe der Zeit zu. Nach Tag 49 wurden bei geimpften Teilnehmern keine entsprechenden Fälle mehr gemeldet. 28 Tage nach der Impfung zeigte Ad26.COV2.S einen vollständigen Schutz vor COVID-19-bedingten Krankenhausaufenthalten und Todesfällen. Die Anzahl der COVID-19-Fälle, die eine medizinische Intervention wie z.B. einen Krankenhausaufenthalt, die Aufnahme auf der Intensivstation, mechanische Beatmung oder eine extrakorporale Membranoxygenierung (ECMO) erforderten, ging deutlich zurück. Bei den Studienteilnehmern, die den Impfstoffkandidaten erhalten hatten, wurden 28 Tage nach der Impfung keine Fälle gemeldet, in denen solche medizinischen Interventionen notwendig waren. Wie lange der Impfschutz anhält, ist derzeit nicht bekannt.
Wirksamkeit bei Älteren
Von den 21.895 Personen, die eine Einzeldosis des Janssen COVID-19-Impfstoffs in der Studie COV3001 erhielten, waren 19,5% (n=4.259) 65 Jahre und älter und 3,7% (n=809) 75 Jahre und älter. Nach bisherigen Erkenntnissen scheint die Wirksamkeit in den Untergruppen (Alter, Komorbidität, ethnische Zugehörigkeit) in der gesamten Studienpopulation ähnlich zu sein. Eine niedrigere Wirksamkeit wurde jedoch für die Untergruppe der Teilnehmer ab 60 Jahren mit Komorbiditäten im Vergleich zur Gesamtbevölkerung beobachtet. Doch trotz der geringeren Wirksamkeit, gab es bei Teilnehmern ab 60 Jahren keine COVID-19-Todesfälle und keine COVID-19-Fälle, bei denen eine medizinische Intervention erforderlich war. Die Wirksamkeitsergebnisse bei Teilnehmern ≥ 75 Jahre sind nach Angaben des FDA Briefing Dokuments nur begrenzt interpretierbar. Die Daten reichen noch nicht aus, um die Wirksamkeit zu bewerten.
Wirksamkeit
Insgesamt zeigte der Impfstoff in der Studie NCT04505722 nach 28 Tagen einen zu 66% wirksamen Schutz vor einer moderaten bis schweren COVID-19-Infektion. Die Wirksamkeit im Hinblick auf Schutz vor schweren COVID-19 betrug bei allen Erwachsenen ab 18 Jahren nach 28 Tagen 85%. Der Schutz beginnt etwa 14 Tage nach der Impfung.
Ab 14 Tagen nach der Impfung:
- Wirksamkeit gegen COVID-19 Erkrankung: 66,9%
- Wirksamkeit gegen schwere COVID-19-Verläufe: 76,7%
Ab 28 Tagen nach der Impfung:
- Wirksamkeit gegen COVID-19 Erkrankung: 66,1%
- Wirksamkeit gegen schwere COVID-19 Verläufe: 85,4%
Anwendungshinweise
Für den Fall, dass nach Verabreichung von Ad26.COV2.S eine akute anaphylaktische Reaktion auftritt, muss sofort eine geeignete medizinische Behandlung allergischer Reaktionen verfügbar sein.
Thrombose mit Thrombozytopenie-Syndrom, TTS
Im Zusammenhang mit Adenovirus-basierten Vektorimpfstoffen gegen COVID-19, (Vaxzevria® [COVID-19 Vaccine AstraZeneca], COVID-19 Vaccine Janssen) wurde sehr selten über eine ungewöhnliche Kombination von Thrombosen und Thrombozytopenie (Thrombose mit Thrombozytopenie-Syndrom, TTS) berichtet. Die Thrombosen können an ungewöhnlichen Stellen auftreten, zum Beispiel als zerebrale Sinusvenenthrombosen, Portal-, Leber- oder Mesenterialvenenthrombosen, tiefe Beinvenenthrombosen, Lungenembolien sowie arterielle Thrombosen. Auch Blutungen sind möglich. TTS wird durch eine Antikörperbildung gegen Plättchenfaktor 4 ausgelöst, was ähnlich wie bei der heparininduzierten Thrombozytopenie (HIT) zu einer massiven Thrombozytenaktivierung führt, jedoch ohne vorherige Heparin-Exposition.
Geimpfte sollten umgehend einen Arzt aufsuchen wenn in einem zeitlichen Abstand von mehr als drei Tagen bis etwa drei Wochen nach der Impfung Symptome auftreten wie:
- Kurzatmigkeit
- Brustschmerzen
- Beinschwellungen oder -schmerzen
- anhaltende Bauchschmerzen
- Übelkeit oder Erbrechen
- Blutergüsse außerhalb des Verabreichungsortes
- neurologische Symptome wie starke oder anhaltende Kopfschmerzen, verschwommenes Sehen oder Krampfanfälle, sollten
Weitere Maßnahmen, wie bspw. Vorstellung in einer Notaufnahme, sollten dann rasch eingeleitet werden, da eine frühzeitige Diagnose und Behandlung sowie ggf. die Hinzuziehung von Spezialisten (z. B. Hämatologen, Gerinnungsspezialisten) angesichts des lebensbedrohlichen Krankheitsbilds wichtig sind.
Folgende Empfehlungen sollten im Falle von TTS nach einer Impfung berücksichtigt werden:
- In solchen Fällen sollte das Blutbild (mit Thrombozytenzahl), ein Blutausstrich, die D-Dimere sowie der Fibrinogenwert untersucht und ggf. eine weiterführende bildgebende Diagnostik durchgeführt werden.
- Patienten mit Thrombozytopenie sollten aktiv auf Anzeichen einer Thrombose untersucht werden, Patienten mit Thrombose sollten auf eine Thrombozytopenie untersucht werden. Ggf. sind wiederholte Untersuchungen auf TTS erforderlich.
- Bei Vorliegen einer Thrombose mit Thrombozytopenie und erhöhtem D-Dimer-Wert sollte unabhängig von einer Heparin-Exposition ein HIT-Screening-Test und ggf. weitere Untersuchungen pathophysiologisch relevanter Antikörper erfolgen. Dabei ist zu beachten, dass nicht alle HIT-Screening-Tests für die Diagnostik eines TTS geeignet sind.
- Bis zum Ausschluss einer HIT sollte auf Heparine zur Antikoagulation verzichtet und stattdessen z. B. Danaparoid, Argatroban oder direkte orale Antikoagulanzien angewendet werden.
- Bei bestätigter autoimmuner Genese kann wahrscheinlich der Pathomechanismus durch die Gabe von hochdosierten intravenösen Immunglobulinen unterbrochen werden. Einzelbeobachtungen weisen darauf hin, dass die frühzeitige Gabe von intravenösen Immunglobulinen die Prognose der Patienten verbessert.
- Stets müssen auch andere Ursachen für Thrombozytopenien/Thrombosen in Betracht gezogen werden.
Bei Patienten mit Thrombose oder Thrombophilie in der Anamnese scheint das Risiko für diese spezifische Komplikation nicht erhöht zu sein. Weitere Details, einschließlich eines Flussdiagramms, zum Vorgehen bei Verdacht auf HIT/TTS können der Stellungnahme der GTH (Gesellschaft für Thrombose- und Hämostaseforschung) entnommen werden.
Anaphylaktische Reaktionen
Für akute anaphylaktische Reaktionen muss eine medizinische Notfallausrüstung zur Verfügung stehen. Eine Nachbeobachtung sollte für mindestens 15 Minuten gewährleistet sein.
Akute Infektionen
Bei akuten Infektionen sollte die Impfung verschoben werden. Milde Krankheitssymptome sind kein Grund, die Impfung zu verschieben.
Gerinnungsstörungen
Bei antikoagulierten Personen oder Personen mit Gerinnungsstörungen, bei denen eine intramuskuläre Injektion kontraindiziert ist, sollte die Impfung nur erfolgen, wenn der Nutzen die Risiken übersteigt. Nach sorgfältiger Nutzen Risiko-Abwägung kann eine intramuskuläre Injektion mit einer dünnen Nadel (23 G oder 25 G) und anschließender Kompression mit einem Tupfer auf die Injektionsstelle erfolgen.
Immunsupprimierte Personen
Immunsupprimierte Personen, einschließlich Personen, die eine immunsuppressive Therapie erhalten, können eine verminderte Immunantwort auf die Impfung zeigen. Es liegen keine Daten zur gleichzeigen Gabe von Immunsuppressiva oder zu Personen, die schon eine Impfung mit einem anderen COVID19 Impfstoff erhalten haben, vor.
Alternativen
Neben Ad26.COV2.S sind in der EU noch vier weitere Corona-Impfstoffe zugelassen, darunter:
- BNT162b2 (Comirnaty) von BioNTech/Pfizer
- mRNA-1273 (Spikevax) von Moderna
- AZD1222 (Vaxzevria) von AstraZeneca
- NVX-CoV2373 (Nuvaxovid) von Novavax
Eine umfangreiche Vergleichsseite der zugelassenen Impfstoffe finden Sie hier.
- Johnson & Johnson: Johnson & Johnson Announces Single-Shot Janssen COVID-19 Vaccine Candidate Met Primary Endpoints in Interim Analysis of its Phase 3 ENSEMBLE Trial
- Nature: Ad26 vector-based COVID-19 vaccine encoding a prefusion-stabilized SARS-CoV-2 Spike immunogen induces potent humoral and cellular immune responses
- Janssen: Covid-19-Impfstoffkandidat: Zwischenergebnisse der Phase-3-Studie
- FDA: FACT SHEET FOR HEALTHCARE PROVIDERS ADMINISTERING VACCINE (VACCINATION PROVIDERS)
- NEJM: Interim Results of a Phase 1–2a Trial of Ad26.COV2.S Covid-19 Vaccine
- Science Direct: Vaccines based on replication incompetent Ad26 viral vectors: Standardized template with key considerations for a risk/benefit assessment
- KVWL: COVID-19 Vaccine Janssen











